食管癌是临床上常见的消化系统恶性肿瘤,其中鳞状细胞癌是其最主要的病理类型[1]。2020年我国食管癌死亡病例约30.1万,占全球近50%[2]。对晚期食管鳞癌病人进行术前新辅助放化疗可缩小肿瘤体积,提高手术切除效果和病理缓解率,从而改善病人预后,但因病人细胞氧合状态、微血管分布、遗传状态等因素影响,肿瘤组织对放化疗敏感性差异很大[3-4]。乳酸脱氢酶(LDH)在组织低氧时和恶性肿瘤中表达升高,清蛋白(ALB)则反映机体营养状态[5-6]。近年来,LDH与ALB比值(LAR)在多种恶性肿瘤预后评估中显示出潜在价值[7-8]。然而,LAR在晚期食管鳞癌新辅助放化疗预后评估中的应用研究尚少见。因此,本研究探讨LAR与晚期食管鳞癌病人新辅助放化疗预后的关系,并分析了影响预后的危险因素,旨在为临床精准治疗提供参考。现将结果报告如下。
1 对象与方法 1.1 研究对象按照纳入和排除标准,选取2021年12月—2022年12月临汾市中心医院诊治的86例晚期食管鳞癌病人为研究对象。其中,男性49例,女性37例;平均年龄(58.3±5.5)岁。平均体质量指数(BMI)为(20.9±4.9)kg/m2。纳入标准:①经影像学、胃镜组织病理学检查诊断为食管鳞癌,分期为Ⅳ期;②均在本院接受新辅助放疗和化疗;③Karnofsky功能状态评分(KPS)≥65分;④临床资料完整;⑤全部病人及监护人签署同意书,医院伦理委员会已审核通过(伦审第2021-28号)。排除标准:①合并其他部位恶性肿瘤以及血液系统疾病;②严重器官功能障碍;③对放化疗不耐受,有过敏反应;④测量病灶不能显示者,包括小病灶(长径<10 mm)或者病理检测淋巴结短径为10~15 mm。
1.2 研究方法 1.2.1 一般资料收集收集所有研究对象的基线资料,包括病人的年龄、性别、BMI、吸烟饮酒史、血清总胆固醇(TC)和三酰甘油(TG)、发病部位、分化程度、浸润深度及肿瘤最大长径等信息。
1.2.2 血清LDH和ALB检测使用全自动生化分析仪(北京瑞科中仪科技有限公司)检测所有研究对象血清LDH活力和ALB含量,并计算LAR。具体操作流程按试剂盒说明书进行。
1.2.3 肿瘤浸润深度检测[9-10]采用EU-ME2超声诊断仪和GF-UCT260超声内镜(UM-3R探头频率为20 MHz)进行检测。首先确定病变位置后将胃内空气排尽,注入无菌水;然后插入超声微探头,在病变部位充满水后进行扫描,扫描范围包括病灶及其周围。及时记录黏膜累及层次和浸润深度,并查看是否有淋巴结增大。
1.2.4 新辅助放化疗方法[11-12]所有病人均接受新辅助放化疗,28 d为1周期,共治疗5周期。放疗方案: 放疗前行CT模拟定位扫描,扫描层厚5 mm,由院内放疗专业医师修改、确认靶区,计划靶体积(PTV)95%接受100%以上的处方照射剂量;肺的照射剂量限制为受照射剂量≥5 Gy的肺体积占全肺体积的比例(V5,以下类推)≤55%(或≤60%)、V20≤25%(或≤30%)、V30≤18%,心脏的照射剂量限制为平均剂量≤30 Gy,脊髓的最大剂量应≤45 Gy;采用调强适形放射治疗方式,处方剂量DT为40 Gy/20 F,每次2.0 Gy,每天1次,每周5次,共4周。化疗方案:于放疗15 d后实施化疗治疗,采用紫杉醇与顺铂联合化疗方案,第1天使用紫杉醇(国药准字:H10980068,北京协和药厂有限公司)125 mg/m2静脉滴注,第1~3天使用顺铂(国药准字:H37020523,德州德药制药有限公司)20 mg/m2静脉滴注;若在化疗后白细胞计数<4.0×109/L,则给予粒细胞刺激因子治疗。
1.2.5 预后判断标准与分组根据RECIST 1.1实体瘤疗效评价标准[13-15]:完全缓解(CR),治疗后肿瘤病灶完全消失,所有淋巴结短径减少至<10 mm;部分缓解(PR),治疗后肿瘤病灶面积减少≥50%;稳定(SD),治疗后肿瘤病灶面积减少<50%或者增大<25%;进展(PD),治疗后肿瘤病灶面积增大≥25%,或所有病灶长径之和绝对值增加>5 mm,或出现≥1个新发病灶。以CR和PR者为预后良好,SD和PD者为预后不良,将病人分为预后良好组与预后不良组。
1.3 统计学方法使用SPSS 24.0软件进行统计学分析。计量资料符合正态分布的数据以x±s表示,组间均数比较采用t检验;计数资料以例数或(和)百分比表示,组间比较采用χ2检验;采用二分类Logistic逐步回归(α入=0.05、α出=0.10)分析晚期食管鳞癌病人新辅助放化疗预后的影响因素;采用受试者工作特征(ROC)曲线及曲线下面积(AUC)分析LAR对晚期食管鳞癌病人新辅助放化疗预后的评估价值。以P<0.05为差异有统计学意义。
2 结果 2.1 两组治疗后LDH、ALB及LAR比较预后良好组LDH和LAR显著低于预后不良组,而ALB明显高于预后不良组,差异均有统计学意义(t=11.584~14.984,P<0.05)。提示晚期食管鳞癌病人新辅助放化疗后的LDH、ALB及LAR与其预后密切相关。见表 1。
| 表 1 两组治疗后LDH、ALB及LAR比较(x±s) |
|
|
LDH、ALB及LAR评估晚期食管鳞癌病人新辅助放化疗预后的AUC分别为0.832、0.744和0.919,其中以LAR的AUC为最大、特异度最高。提示LAR对病人预后有较高的评估价值。见表 2和图 1。
| 表 2 LDH、ALB及LAR对病人预后的评估价值 |
|
|
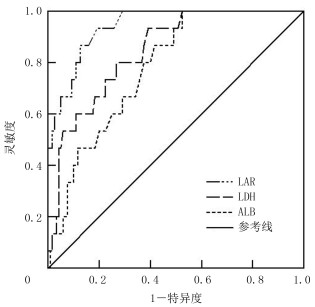 |
| 图 1 LDH、ALB及LAR对病人预后评估的ROC曲线 |
两组病人的年龄、性别、BMI、吸烟饮酒史、TC、TG、发病部位和肿瘤最大长径等因素比较,差异均无统计学意义(P>0.05)。预后不良组肿瘤为低分化和浸润深度≥5 mm的构成比均明显高于预后良好组,差异均有统计学意义(χ2=8.524、10.223,P<0.05)。提示肿瘤分化程度和浸润深度是影响晚期食管鳞癌病人新辅助放化疗预后的危险因素。见表 3。
| 表 3 影响晚期食管鳞癌病人新辅助放化疗预后的单因素分析(例(χ/%)) |
|
|
以晚期食管鳞癌病人新辅助放化疗的预后为因变量(良好=0、不良=1),以单因素分析差异有显著性的指标为自变量(赋值为分化程度:中/高分化=0,低分化=1;浸润深度:<5 mm=0,≥5 mm=1;LAR:<8.4=0,≥8.4=1)进行多因素Logistic回归分析。结果表明,肿瘤的分化程度、浸润深度和LAR是晚期食管鳞癌病人新辅助放化疗预后不良的独立危险因素(OR=3.043~4.604,95%CI=(1.468~1.801)~(6.310~11.773),P<0.05)。提示肿瘤分化程度、浸润深度和LAR等变量是影响晚期食管鳞癌病人新辅助放化疗不良预后的风险因素。见表 4。
| 表 4 影响晚期食管鳞癌病人新辅助放化疗预后的多因素Logistic回归分析 |
|
|
2020年流行病学数据显示,我国食管癌发病率和死亡率在恶性肿瘤中分别居第5位和第4位,极高的发病率与死亡率严重威胁人们生活质量与生命安全[16-18]。我国食管癌以鳞癌为主,约占总体发病率的92%[19-20]。针对晚期食管鳞癌病人的治疗难度较大,即便采取有效的新辅助放化疗,仍只有约35%的病人获得病理学的完全缓解[21-22]。因此,寻找有效的预后评估指标对临床有重要价值。
LDH是糖酵解过程中的关键催化酶,对细胞的代谢状态高度敏感,其活力异常升高预示着机体无氧酵解、低氧状态和恶性细胞转化过程[23-24]。ALB可维持血浆渗透压,反映机体营养状态,用于辅助诊断影响肝脏代谢功能的疾病[25-26]。诸多关于癌症预后的研究中均有显示,LAR可用于判断恶性肿瘤病人的预后,术前LAR对判断肝细胞癌病人预后有一定价值,在结肠癌和胶质瘤病人中LAR是其预后不良的独立危险因素[27-28]。本研究结果显示,预后良好组LDH和LAR显著低于预后不良组,而ALB显著高于预后不良组。提示LAR与晚期食管鳞癌病人新辅助放化疗的预后有关,且高水平的LAR是预后不良的危险因素。分析原因可能是在肿瘤细胞代谢过程中,LDH是糖酵解途径中的重要限速酶,而在肿瘤细胞增殖活跃时微环境会严重低氧,需通过上调LDH无氧酵解来维持其存活和增殖所需要的能量,以保证在低氧状态下肿瘤细胞进行糖酵解代谢并降低需氧量[29-31]。同时,LDH与丙酮酸相互转换产生的乳酸可改变肿瘤微环境,可让肿瘤细胞免疫逃避,使肿瘤细胞能够抑制免疫攻击[32-33]。众所周知,在肿瘤微环境中炎症细胞会释放炎症细胞因子、活性递质,不断产生炎症反应,使机体免疫防御功能被削弱,对肿瘤细胞的恶变、侵袭和转移起到促进作用[34-36]。ALB含量可反映晚期食管鳞状细胞癌病人的系统营养状态,其值越低说明病人的营养状况及免疫力越差。此外,低ALB血症与机体慢性炎症密切相关,炎症反应会导致蛋白分解加速,刺激相关细胞释放白细胞介素4和6等炎症因子影响ALB的合成,从而使ALB含量下降,促使微血管的生成,影响晚期食管鳞癌病人新辅助放化疗的预后[37-39]。本文的研究结果显示,LAR评估晚期食管鳞癌病人新辅助放化疗预后的AUC为0.919,灵敏度为88.6%,且LAR≥8.4是不良预后的独立危险因素。提示LAR可作为评估晚期食管鳞癌病人新辅助放化疗预后的辅助指标。本研究结果还显示,肿瘤分化程度低和浸润深度≥5 mm也是晚期食管鳞癌病人新辅助放化疗不良预后的独立危险因素。这是由于肿瘤细胞低分化意味着其组织分化差、异质性高,预后一般较差。肿瘤浸润深度通常是指肿瘤细胞侵袭病人组织器官的深度,一般被用作评价肿瘤侵袭力的指标[40-41]。提示对于肿瘤分化程度低和浸润深度≥5 mm的病人应予以重点监测,以降低晚期食管鳞癌病人新辅助放化疗预后不良人群数量[42]。
综上所述,LAR在新辅助放化疗预后不良的晚期食管鳞癌病人中显著升高,可作为评估病人预后的生物学指标。但是,本研究尚存在不足之处,本文为单中心研究且样本量小,没有长期全面地对病人进行充分评估,可能对本文结果造成偏倚,还需要扩大样本量及来源,进行长时间、多中心、前瞻性的研究,以验证本文的结论。
| [1] |
BOUSTANI J, CRÉHANGE G. Dose-escalated radiotherapy in esophageal cancer: a review of the literature[J]. Cancer Radiotherapie, 2022, 26(6-7): 884-889. DOI:10.1016/j.canrad.2022.06.021 |
| [2] |
周笑世, 常江, 彭立雄, 等. MC1R在食管鳞癌细胞和组织中高表达[J]. 南方医科大学学报, 2022, 42(10): 1552-1559. DOI:10.12122/j.issn.1673-4254.2022.10.16 |
| [3] |
李彬, 时振国, 高丽娟, 等. 18F-FDG PET/CT评估食管鳞癌新辅助放化疗近期疗效的研究进展[J]. 中华实用诊断与治疗杂志, 2021, 35(9): 892-895. |
| [4] |
WATERS J K, REZNIK S I. Update on management of squamous cell esophageal cancer[J]. Current Oncology Reports, 2022, 24(3): 375-385. DOI:10.1007/s11912-021-01153-4 |
| [5] |
QU J, ZHU H H, HUANG X J, et al. Abnormal indexes of liver and kidney injury markers predict severity in COVID-19 patients[J]. Infection and Drug Resistance, 2021, 14: 3029-3040. DOI:10.2147/IDR.S321915 |
| [6] |
TONG S F, YIN C, GE Y Z, et al. Albumin (ALB) and protein disulfide isomerase family A member 4 (PDIA4) are novel markers to predict sperm freezability of Erhualian boar[J]. Cryobiology, 2022, 109: 37-43. |
| [7] |
卢洁, 王宏强, 陆风雁. 国产硼替佐米对多发性骨髓瘤患者的疗效及对血清sFLC、LDH和ALB的影响[J]. 现代实用医学, 2022, 34(8): 1036-1038. |
| [8] |
胡茹, 郭怀娟, 王颖, 等. C-PLAN指数作为免疫检查点抑制剂治疗晚期食管癌预后指标的临床研究[J]. 实用临床医药杂志, 2024, 28(1): 1-6, 12. |
| [9] |
PENG H X, WU X R, LIU S P, et al. Cellular dynamics in tumour microenvironment along with lung cancer progression underscore spatial and evolutionary heterogeneity of neutrophil[J]. Clinical and Translational Medicine, 2023, 13(7): e1340. DOI:10.1002/ctm2.1340 |
| [10] |
盛倩, 章国东, 温敏雅. 血清G-17、PGⅠ、PGⅡ、Hp-IgG检测对胃癌与癌前病变的筛查价值及与肿瘤浸润深度关系[J]. 世界华人消化杂志, 2022, 30(5): 235-241. |
| [11] |
胡芳, 方向东, 付江萍, 等. 局部晚期食管癌患者血清miR-193b、miR-330-5p水平与新辅助放化疗疗效的关系[J]. 山东医药, 2024, 64(5): 60-63. |
| [12] |
李干斌, 韩加刚, 王振军, 等. 新辅助放化疗治疗局部进展期直肠癌的远期疗效及预后因素分析[J]. 临床外科杂志, 2021, 29(5): 422-427. |
| [13] |
刘娅, 邓红彬. 实体瘤免疫治疗的非常规反应及其疗效评价标准的研究进展[J]. 中国肿瘤生物治疗杂志, 2020, 27(6): 698-704. |
| [14] |
FANTINATO E. The impact of (mass) tourism on coastal dune pollination networks[J]. Biological Conservation, 2019, 236: 70-78. DOI:10.1016/j.biocon.2019.05.037 |
| [15] |
蒋琼慧, 路泽军, 杨平. 肿瘤免疫治疗疗效评价标准: iRECIST解读[J]. 转化医学杂志, 2020, 9(1): 57-60. |
| [16] |
MORGAN E, SOERJOMATARAM I, RUMGAY H, et al. The global landscape of esophageal squamous cell carcinoma and esophageal adenocarcinoma incidence and mortality in 2020 and projections to 2040: new estimates from GLOBOCAN 2020[J]. Gastroenterology, 2022, 163(3): 649-658. |
| [17] |
陈瑜, 蔡文科, 罗小迪, 等. 食管癌地域性差异研究进展[J]. 肿瘤防治研究, 2024, 51(6): 488-494. |
| [18] |
马一楷, 王耿, 刘彩霞. 1990—2019年中国归因于吸烟因素的食管癌疾病负担分析[J]. 中山大学学报(医学科学版), 2024, 45(4): 593-601. |
| [19] |
赵静, 李良, 郏莉莉. MiR-330-3p、FAM83H、LncRNA SNHG7在食管鳞癌组织中的表达及相关性研究[J]. 国际检验医学杂志, 2022, 43(14): 1733-1737. |
| [20] |
王静静, 付亚如, 刘军清, 等. 中国人群食管癌主要危险因素Meta分析[J]. 临床心身疾病杂志, 2024, 30(3): 115-122. |
| [21] |
闫茂慧, 曲宝林, 蔡博宁, 等. 新辅助放化疗联合手术治疗胸段食管鳞癌的临床研究[J]. 中国现代医学杂志, 2019, 29(10): 122-124. |
| [22] |
杨日辉, 钟怡, 范伟雄, 等. 基于高分辨率T2WI影像组学联合临床特征预测食管癌新辅助放化疗疗效的价值[J]. 放射学实践, 2024, 39(3): 377-382. |
| [23] |
陈文君, 江启安, 汪志求. 5-FU联合奥沙利铂或紫杉醇治疗晚期胃癌患者的临床疗效及对血清铁蛋白、糖类抗原、乳酸脱氢酶的影响[J]. 临床和实验医学杂志, 2022, 21(19): 2044-2047. |
| [24] |
韦小婉, 沈小卫, 尚鹏, 等. 白细胞介素-21、β2微球蛋白、白蛋白水平与霍奇金淋巴瘤患者临床特征和预后的关系[J]. 癌症进展, 2022, 20(16): 1690-1692, 1696. |
| [25] |
PAN Q Y, LOU J G, YAN P H, et al. WTAP contributes to the tumorigenesis of osteosarcoma via modulating ALB in an m6A-dependent manner[J]. Environmental Toxicology, 2023, 38(6): 1455-1465. |
| [26] |
COMANDATORE A, FRANCZAK M, SMOLENSKI R T, et al. Lactate Dehydrogenase and its clinical significance in pancreatic and thoracic cancers[J]. Seminars in Cancer Biology, 2022, 86(Pt 2): 93-100. |
| [27] |
谢智惠, 吴平, 高敏国. 联合检测手术前后外周血乳酸脱氢酶与白蛋白比值变化对结肠癌预后的评估价值[J]. 南京医科大学学报(自然科学版), 2022, 42(9): 1259-1264, 1278. |
| [28] |
刘援援, 王豪升, 胡帅, 等. 术前血清乳酸脱氢酶与白蛋白比值对脑胶质瘤患者预后影响的研究[J]. 医学研究杂志, 2023, 52(6): 91-95. |
| [29] |
崔杨, 曲璇. 乳酸在肿瘤中的作用及乳酸脱氢酶作为治疗靶点的研究进展[J]. 肿瘤预防与治疗, 2022, 35(6): 572-578. |
| [30] |
ZHU H, BLUM R H, BERNAREGGI D, et al. Metabolic reprograming via deletion of CISH in human iPSC-derived NK cells promotes in vivo persistence and enhances anti-tumor activity[J]. Cell Stem Cell, 2020, 27(2): 224-237. e6. |
| [31] |
ROTHMAN D L, SHULMAN R G. Two transition states of the glycogen shunt and two steady states of gene expression support metabolic flexibility and the Warburg effect in cancer[J]. Neoplasia, 2021, 23(9): 879-886. |
| [32] |
聂佳琪, 潘凤, 李晓宁, 等. LDHA及LDHB对胃癌组织中免疫微环境的影响及临床意义[J]. 临床与实验病理学杂志, 2022, 38(4): 421-426. |
| [33] |
SUN W X, JIA M S, FENG Y Y, et al. Lactate is a bridge linking glycolysis and autophagy through lactylation[J]. Autophagy, 2023, 19(12): 3240-3241. |
| [34] |
侯婉云, 刘发煇, 龙朴泽, 等. 肿瘤微环境对铁死亡的影响[J]. 实用肿瘤杂志, 2022, 37(4): 371-375. |
| [35] |
BHAT A A, NISAR S, SINGH M, et al. Cytokine- and chemokine-induced inflammatory colorectal tumor microenvironment: Emerging avenue for targeted therapy[J]. Cancer Communications, 2022, 42(8): 689-715. |
| [36] |
HABANJAR O, BINGULA R, DECOMBAT C, et al. Crosstalk of inflammatory cytokines within the breast tumor microenvironment[J]. International Journal of Molecular Sciences, 2023, 24(4): 4002. |
| [37] |
赵婷, 潘云, 高波. MyD88在肿瘤免疫耐受及免疫治疗中的研究进展[J]. 中国肿瘤, 2020, 29(9): 695-700. |
| [38] |
LI X J, QURESHI A R, SULIMAN M E, et al. Interleukin-6-to-albumin ratio as a superior predictor of mortality in end-stage kidney disease patients[J]. American Journal of Nephro-logy, 2023, 54(7-8): 268-274. |
| [39] |
田妍. 基于剪切波弹性成像及超微血管成像影像学参数构建乳腺癌新辅助化疗疗效预测模型的预测效能[J]. 中国中西医结合影像学杂志, 2024, 22(3): 316-321. |
| [40] |
HUANG L J, WANG X G, PEI S Y, et al. Single-cell profiling reveals sustained immune infiltration, surveillance, and tumor heterogeneity in infiltrative basal cell carcinoma[J]. 2023, 143(11): 2283-2294. e17.
|
| [41] |
李二峰, 张全卯. 小探头超声内镜在结直肠侧向发育型肿瘤浸润深度评估中的应用[J]. 中国内镜杂志, 2024, 30(3): 25-30. |
| [42] |
王亚钦, 孙趁意, 王嫦华, 等. 早期胃食管结合部癌内镜黏膜特征与肿瘤浸润深度的关系[J]. 实用癌症杂志, 2022, 37(10): 1649-1652. |
 2024, Vol. 60
2024, Vol. 60
