2. 青岛大学附属医院医学研究中心,山东 青岛 266555
在中国,肺癌是最常见的癌症事件,也是癌症死亡的主要原因[1-2]。光动力疗法(PDT)作为一种有前景的、非侵入性的癌症治疗方式,在近几十年广泛用于肺癌的治疗。PDT由3个基本成分组成,即光、氧和光敏剂(PS)[3-4]。血卟啉衍生物(HPD)存在化学纯度低、组织穿透性差、半衰期长等缺点,但到目前为止仍是最常用、且是唯一一种被FDA批准用于多种实体恶性肿瘤临床治疗的PS[5-6]。PS的细胞摄取、胞内分布是决定PDT功效的重要因素[7]。实体肿瘤由多种具有不同PS摄取特性的细胞组成。因此,细胞水平的药代动力学是优化PDT效果的一个重要参数[8]。本实验以人支气管上皮BEAS-2B细胞作对照,选取3种肺癌细胞系如人肺腺癌A549、人肺鳞癌H520、人肺小细胞癌H446细胞进行研究,在体外通过多功能酶标仪、流式细胞仪、激光扫描共聚焦显微镜等仪器检测细胞内荧光强度,比较分析HPD在4种细胞内的摄取、定位差异,以期为针对不同的肺癌类型选取特定方案(特定的PS注射浓度和时间)来增强HPD介导的PDT疗效提供一定的指导。
1 材料与方法 1.1 主要试剂HPD由重庆迈乐生物制药有限公司生产,规格为5 mL:25 mg;在超净工作台分装后于-20 ℃冰箱避光保存,用含体积分数0.10胎牛血清和体积分数0.01青霉素/链霉素双抗溶液的DMEM高糖完全培养液现配现用。DMEM高糖培养液、胰蛋白酶、青霉素/链霉素双抗溶液及40 g/L多聚甲醛固定液均购于大连meilunbio公司,胎牛血清购于武汉Procell公司,4′, 6-二脒基-2-苯基吲哚(DAPI)、抗荧光淬灭封片液购于北京Solarbio公司。
1.2 细胞培养人肺腺癌A549细胞系购于美国菌种保藏中心(ATCC),人支气管上皮BEAS-2B细胞系、人肺鳞癌H520细胞系、人肺小细胞癌H446细胞系均购于武汉Procell公司,于青岛大学附属医院中心实验室液氮罐中保存。4种细胞系均使用含体积分数0.10胎牛血清和体积分数0.01青霉素/链霉素双抗溶液的DMEM高糖完全培养液,于37 ℃、含体积分数0.05 CO2的饱和湿度孵箱中培养。
1.3 绘制HPD荧光值的标准曲线取96孔板,将HPD浓度设为5.0、7.5、10.0、12.5、15.0 mg/L,每个浓度设3个复孔,应用多功能酶标仪检测不同浓度HPD的荧光值(激发波长为405 nm,发射波长为630 nm),取其平均值,从低浓度开始绘制标准曲线。
1.4 多功能酶标仪检测4种细胞系对HPD的摄取将4种细胞以每孔104个细胞的密度接种于5块96孔板中,每组设4个复孔,12 h后随机分为对照组(无HPD孵育)和实验组(用HPD孵育不同时间)。实验组加入5 mg/L的HPD,分别于培养箱内继续避光培养4、8、12、24、48 h,后弃去未结合HPD,加入完全培养液后用多功能酶标仪检测荧光强度,激发波长为405 nm,发射波长为630 nm。
1.5 流式细胞仪检测4种细胞系对HPD的摄取将4种细胞以每孔105个细胞的密度接种于12孔板中,至12 h细胞贴壁以后随机分为对照组(无HPD孵育)和实验组(用HPD孵育不同时间)。实验组加入5 mg/L的HPD,于培养箱内继续避光培养24、48 h,后弃去未结合HPD。两组均用PBS洗2次后收集细胞,以PBS重悬,各取400 μL(每组细胞总数为105个),过滤后用流式细胞仪检测细胞荧光强度。
1.6 激光扫描共聚焦显微镜观察4种细胞系HPD的细胞定位将盖玻片用体积分数0.75的乙醇浸泡、培养液冲洗后置于24孔板中,4种细胞以每孔104个细胞的密度接种,12 h后随机分为对照组(无HPD孵育)和实验组(用HPD孵育)。实验组加入15 mg/L的HPD,于培养箱内继续避光培养48 h,后弃去未结合HPD,用40 g/L多聚甲醛常温固定20 min,PBS洗3次后用DAPI避光染8 min,以PBS洗3次。将染色好的盖玻片盖于滴有抗荧光淬灭封片液的载玻片上并封片,于激光扫描共聚焦显微镜下观察并拍照。
1.7 统计学分析采用SPSS 26.0和GraphPad Prism 8统计软件进行数据分析。本研究实验均独立重复3次及以上,所得计量资料结果用x±s表示,多组均数比较采用F检验,组间两两比较采用Tukey检验,P < 0.05表示差异具有统计学意义。
2 结果 2.1 HPD荧光值标准曲线绘制利用5.0、7.5、10.0、12.5、15.0 mg/L HPD测得的荧光值绘制标准曲线(图 1),同时做相关回归分析,得回归方程Y=2 276×X+17 563(式中Y表示荧光强度,X表示浓度),相关系数r=0.992 0,P=0.000 9,95%CI=(0.878 7~0.999 5)。结果表明,在一定浓度范围内HPD浓度与荧光强度呈正相关,可以用HPD的荧光强度来代表HPD含量。
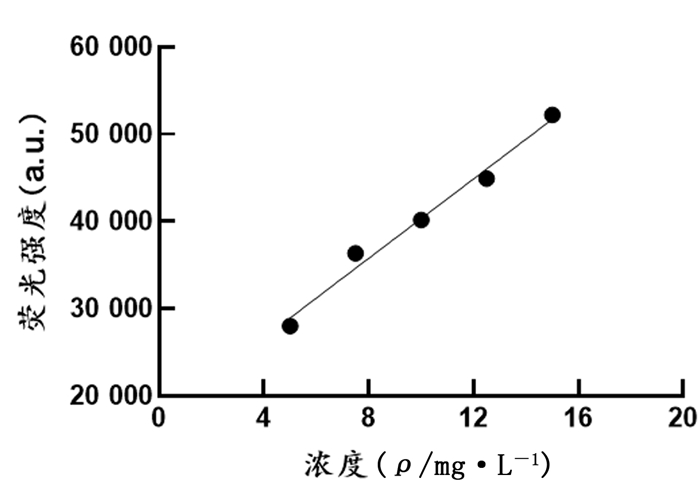 |
| 图 1 HPD荧光值的标准曲线 |
将5 mg/L HPD与4种细胞分别共孵育4、8、12、24、48 h,多功能酶标仪检测荧光强度,绘制时间依赖曲线(图 2)。如图 2所示,4种细胞系的HPD时间依赖曲线总体呈现上升的趋势,表明随着时间增加细胞摄取HPD增加。4种细胞系摄取HPD在4、8、12 h无明显增加,BEAS-2B、A549、H446细胞在12 h之后HPD迅速积累,H520细胞则出现一定的延缓,在24 h后才表现出摄取速率的加快。
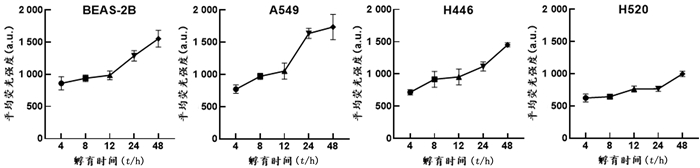 |
| 图 2 4种细胞系摄取HPD的时间依赖曲线 |
为了排除细胞增殖差异的影响,进一步量化细胞摄取,对5 mg/L HPD孵育24、48 h的细胞进行流式细胞仪检测。结果显示,4种细胞在24、48 h表现出很强的荧光信号,表明HPD在细胞内高效累积,且48 h累积量高于24 h。随着孵育时间延长细胞摄取HPD增加,但4种细胞系在48 h均未达到摄取饱和。见图 3。HPD孵育24、48 h时,4种细胞内平均荧光强度差异具有统计学意义(F=199.00、71.15,P < 0.001),其中A549细胞内HPD平均荧光强度显著高于H446、BEAS-2B、H520细胞,H446和BEAS-2B细胞内平均荧光强度显著高于H520细胞(P < 0.05),而H446和BEAS-2B细胞内平均荧光强度差异无统计学意义(P>0.05)。所以,A549细胞摄取HPD的能力最强,BEAS-2B细胞和H446细胞次之,H520细胞摄取HPD的能力最弱。见图 4。
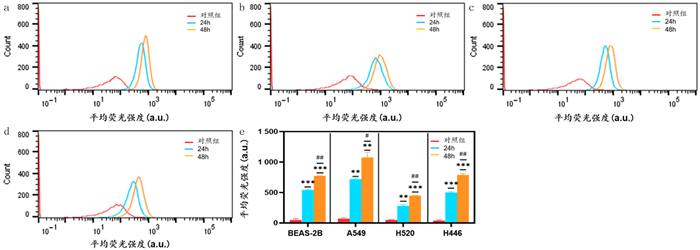 |
| BEAS-2B(a)、A549(b)、H520(c)、H446(d)细胞分别与HPD共孵育24、48 h,流式细胞仪检测细胞内HPD荧光强度;4种细胞系在24、48 h时的HPD摄取差异(e)。*、#:P < 0.05;**、##:P < 0.01;***、###:P < 0.001。*:对照组与摄取HPD 24 h比较;#:摄取HPD 24 h与摄取HPD 48 h比较。 图 3 4种细胞系HPD摄取的时间差异 |
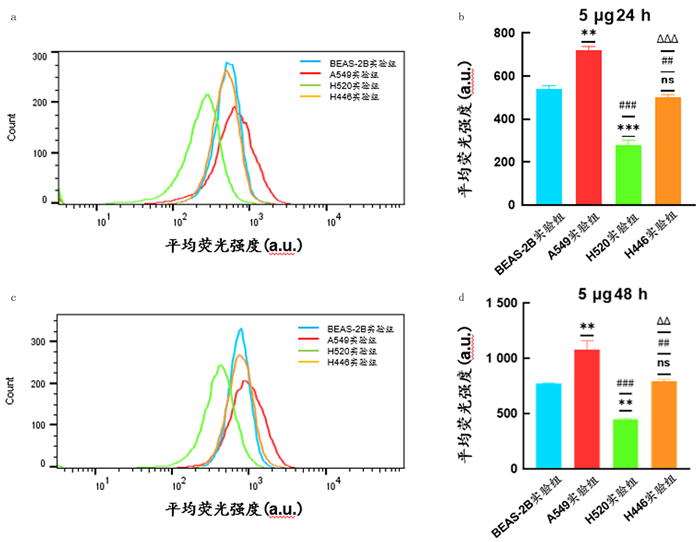 |
| HPD共孵育24 h(a、b)和48 h(c、d),流式细胞仪检测4种细胞系之间的摄取差异。*、#、△:P < 0.05;**、##、△△:P < 0.01;***、###、△△△:P < 0.001。*、ns:与BEAS-2B实验组比较;#:与A549实验组比较;△: 与H520实验组比较。 图 4 HPD共孵育24、48 h时4种细胞系的摄取差异 |
本文激光扫描共聚焦显微镜观察结果显示,与15 mg/L HPD共孵育48 h后,4种细胞系的实验组细胞内呈现出强度不等的红色荧光信号,均呈点状分布于细胞质内,而在对照组几乎观察不到。表明4种细胞系摄取HPD定位于细胞质中,且分布未观察到明显差异。见图 5。
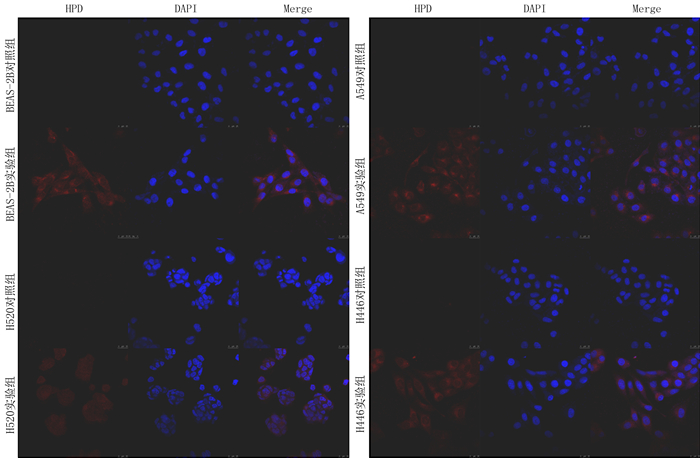 |
| 红色表示HPD荧光,蓝色表示DAPI荧光,比例尺=25 μm。 图 5 HPD在4种细胞内的定位 |
PDT治疗的原理是PS在符合其吸收光谱的光波长照射下,吸收光子的能量转移给氧分子,产生超氧阴离子、单线态氧等细胞毒性活性氧(ROS),导致氧化应激进而破坏肿瘤细胞。单线态氧的寿命极短(10~320 ns),其在细胞内的扩散范围仅为10~55 nm,因此PDT的效果在一定程度上取决于所使用PS的细胞内分布、定位[6, 9-10]。PS的细胞摄取、细胞内分布和滞留取决于PS的化学性质、PS浓度、孵育时间以及细胞特性,包括细胞体积、增殖状态、细胞内靶位点与PS结合的亲和力以及细胞类型等[7, 11]。
已知一个特定的细胞类型有它自己的PS吸收和清除的比例(即细胞动力学特征)。早在1990年PERRY等[12]就研究证明了Photofrin Ⅱ的细胞摄取在不同细胞系间有所差异。随后FICKWEILER等[13]的实验研究证明了另外一种PS(ATMPn)在皮肤细胞系之间的细胞摄取差异。CHWIŁKOW-SKA等[14]在2003年研究显示,Photofrin Ⅱ在不同肿瘤细胞(乳腺腺癌MCF7细胞和白血病T细胞淋巴瘤Jurkat细胞)之间存在着摄取差异。本研究探讨临床上应用的HPD(喜泊分)在不同组织学类型肺癌细胞中摄取的差异性。多功能酶标仪检测结果显示,支气管上皮BEAS-2B细胞、肺腺癌A549细胞、肺小细胞癌H446细胞与HPD共孵育12 h后,HPD迅速累积,而肺鳞癌H520细胞摄取HPD速率缓慢,在24 h后摄取加快。由于多功能酶标仪检测的是细胞总的荧光强度,所以在24、48 h进一步用流式细胞仪量化细胞内平均荧光强度,结果显示,4种细胞48 h的细胞内平均荧光强度均高于24 h。以上结果表明,随着时间增加4种细胞系摄取HPD的速率不同,也进一步证实细胞类型不同,其PS摄取存在差异。
本实验中细胞与HPD共孵育48 h后,肺腺癌A549细胞内的平均荧光强度甚至达到了肺鳞癌H520细胞的2倍,肺小细胞癌H446细胞内荧光强度也远高于肺鳞癌H520细胞,表明不同类型的肺癌细胞之间HPD摄取存在差异。可能随着孵育时间的延长,细胞的增殖状态影响了PS的摄取。此外,也可能是由于在HPD孵育初期,HPD更多地定位于线粒体,随后在溶酶体中表现出时间依赖性的摄取[15]。这也解释了本研究4种细胞与HPD共孵育4、8、12、24、48 h细胞内HPD荧光强度随着时间延长而增强的现象。
PS的特性之一是选择性靶向肿瘤组织[16]。有研究发现,肿瘤细胞中HPD的摄取量甚至比相应组织的正常细胞高5倍[17]。然而本研究结果显示,正常支气管上皮BEAS-2B细胞内HPD的摄取量高于肺鳞癌H520细胞,与肺小细胞癌H446细胞相比无统计学差异;虽然肺腺癌A549细胞内HPD的摄取量高于正常支气管上皮BEAS-2B细胞,但远不到5倍。1990年,PERRY等[12]的实验也表明,正常肺纤维母细胞CCL-210细胞内PS的浓度高于肺癌细胞。这可能是由于体内体外实验条件差异所引起,在体内情况下,多种因素可能促进HPD对肿瘤组织的高选择性。可能因素包括:肿瘤组织中的肿瘤相关巨噬细胞(TAM)水平高于正常组织[18];与正常组织相比,肿瘤毛细血管相对高的渗透性和扩散作用[19];肿瘤组织存在增强渗透性和保留效应[20]。也有研究表明,在体外单独肿瘤细胞中PS的累积并不是都高于正常组织来源的细胞[21]。
PS在细胞内的定位对于确定PS的靶点很重要,而PS的靶点可能决定了PDT产生光动力损伤的位点和程度,并且决定了细胞死亡的途径和类型[22-23]。卟啉主要通过被动扩散、与脂蛋白结合以及与外周苯二氮受体结合等方式在细胞中累积,定位于线粒体、溶酶体、内质网、高尔基体、核膜等细胞膜结构,在细胞中发出弥漫性荧光[24-26]。本研究在激光扫描共聚焦显微镜下观察4种细胞系HPD的细胞内定位,结果显示,HPD在细胞质内弥漫性分布,并未观察到明显的分布差异,其亚细胞定位是否有差异需进一步研究。
综上所述,在体外控制一定条件的情况下,不同的人肺癌细胞系摄取HPD存在差异,HPD的细胞摄取能力肺腺癌A549细胞>肺小细胞癌H446细胞>肺鳞癌H520细胞。然而是否所有的肺腺癌细胞均具有高HPD摄取能力,以及HPD细胞摄取与组织学分型的相关性,还需要进一步研究验证。未来将在本实验的基础上选用动物移植瘤模型、类器官模型等模拟体内环境,探究HPD对肿瘤组织高选择性的机制。
| [1] |
FENG R M, ZONG Y N, CAO S M, et al. Current cancer situation in China: good or bad news from the2018 Global Can-cer Statistics?[J]. Cancer Communications, 2019, 39(1): 22. |
| [2] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA: a Cancer Journal for Clinicians, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
ZHANG Y H, WANG B L, ZHAO R B, et al. Multifunctio-nal nanoparticles as photosensitizer delivery carriers for enhanced photodynamic cancer therapy[J]. Materials Science & Engineering C, Materials for Biological Applications, 2020, 115: 111099. |
| [4] |
WANG K, YU B X, PATHAK J L. An update in clinical utilization of photodynamic therapy for lung cancer[J]. Journal of Cancer, 2021, 12(4): 1154-1160. DOI:10.7150/jca.51537 |
| [5] |
ZHANG J, JIANG C S, FIGUEIRÓ LONGO J P, et al. An updated overview on the development of new photosensitizers for anticancer photodynamic therapy[J]. Acta Pharmaceutica Sinica B, 2018, 8(2): 137-146. DOI:10.1016/j.apsb.2017.09.003 |
| [6] |
KWIATKOWSKI S, KNAP B, PRZYSTUPSKI D, et al. Photodynamic therapy-mechanisms, photosensitizers and combinations[J]. Biomedicine & Pharmacotherapy, 2018, 106: 1098-1107. |
| [7] |
GUPTA S, DWARAKANATH B S, MURALIDHAR K, et al. Cellular uptake, localization and photodynamic effects of haematoporphyrin derivative in human glioma and squamous carcinoma cell lines[J]. Journal of Photochemistry and Photobiology B, Biology, 2003, 69(2): 107-120. DOI:10.1016/S1011-1344(02)00408-6 |
| [8] |
ROUSSET N, VONARX V, ELÉOUET S, et al. Cellular distribution and phototoxicity of Benzoporphyrin derivative and Photofrin[J]. Research in Experimental Medicine, 1999, 199(6): 341-357. DOI:10.1007/s004339900044 |
| [9] |
KWON S, LEE Y, JUNG Y, et al. Mitochondria-targeting indolizino[3, 2-c]quinolines as novel class of photosensitizers for photodynamic anticancer activity[J]. European Journal of Medicinal Chemistry, 2018, 148: 116-127. DOI:10.1016/j.ejmech.2018.02.016 |
| [10] |
LIM C K, HEO J, SHIN S, et al. Nanophotosensitizers toward advanced photodynamic therapy of Cancer[J]. Cancer Letters, 2013, 334(2): 176-187. DOI:10.1016/j.canlet.2012.09.012 |
| [11] |
CASTANO A P, DEMIDOVA T N, HAMBLIN M R. Mechanisms in photodynamic therapy: part one—photosensitizers, photochemistry and cellular localization[J]. Photodiagnosis and Photodynamic Therapy, 2004, 1(4): 279-293. DOI:10.1016/S1572-1000(05)00007-4 |
| [12] |
PERRY R R, MATTHEWS W, MITCHELL J B, et al. Sensitivity of different human lung cancer histologies to photodynamic therapy[J]. Cancer Research, 1990, 50(14): 4272-4276. |
| [13] |
FICKWEILER S, ABELS C, KARRER S, et al. Photosensitization of human skin cell lines by ATMPn (9-acetoxy-2, 7, 12, 17-tetrakis-(beta-methoxyethyl)-porphycene) in vitro: mechanism of action[J]. Journal of Photochemistry and Photobiology B, Biology, 1999, 48(1): 27-35. DOI:10.1016/S1011-1344(99)00004-4 |
| [14] |
CHWIŁKOWSKA A, SACZKO J, MODRZYCKA T, et al. Uptake of photofrin Ⅱ, a photosensitizer used in photodyna-mic therapy, by tumour cells in vitro[J]. Acta Biochimica Polonica, 2003, 50(2): 509-513. DOI:10.18388/abp.2003_3703 |
| [15] |
WOODBURN K W, VARDAXIS N J, HILL J S, et al. Subcellular localization of porphyrins using confocal laser scanning microscopy[J]. Photochemistry and Photobiology, 1991, 54(5): 725-732. DOI:10.1111/j.1751-1097.1991.tb02081.x |
| [16] |
KOU J Y, DOU D, YANG L M. Porphyrin photosensitizers in photodynamic therapy and its applications[J]. Oncotarget, 2017, 8(46): 81591-81603. DOI:10.18632/oncotarget.20189 |
| [17] |
DOCCHIO F, RAMPONI R, SACCHI C A, et al. Time-resolved fluorescence microscopy of hematoporphyrin-derivative in cells[J]. Lasers in Surgery and Medicine, 1982, 2(1): 21-28. DOI:10.1002/lsm.1900020103 |
| [18] |
KORBELIK M. Low density lipoprotein receptor pathway in the delivery of Photofrin: how much is it relevant for selective accumulation of the photosensitizer in tumors?[J]. Journal of Photochemistry and Photobiology B, Biology, 1992, 12(1): 107-109. DOI:10.1016/1011-1344(92)85022-M |
| [19] |
OENBRINK G, JVRGENLIMKE P, GABEL D. Accumulation of porphyrins in cells: influence of hydrophobicity aggregation and protein binding[J]. Photochemistry and Photobiology, 1988, 48(4): 451-456. DOI:10.1111/j.1751-1097.1988.tb02844.x |
| [20] |
IYER A K, GREISH K, SEKI T, et al. Polymeric micelles of zinc protoporphyrin for tumor targeted delivery based on EPR effect and singlet oxygen generation[J]. Journal of Drug Targeting, 2007, 15(7-8): 496-506. DOI:10.1080/10611860701498252 |
| [21] |
HAMBLIN M R, NEWMAN E L. On the mechanism of the tumour-localising effect in photodynamic therapy[J]. Journal of Photochemistry and Photobiology B, Biology, 1994, 23(1): 3-8. DOI:10.1016/S1011-1344(94)80018-9 |
| [22] |
PUCELIK B, SUŁEK A, DROZD A, et al. Enhanced cellular uptake and photodynamic effect with amphiphilic fluorinated porphyrins: the role of sulfoester groups and the nature of reactive oxygen species[J]. International Journal of Molecular Sciences, 2020, 21(8): 2786. DOI:10.3390/ijms21082786 |
| [23] |
MROZ P, YAROSLAVSKY A, KHARKWAL G B, et al. Cell death pathways in photodynamic therapy of cancer[J]. Cancers, 2011, 3(2): 2516-2539. DOI:10.3390/cancers3022516 |
| [24] |
VERMA A, SNYDER S H. Peripheral type benzodiazepine receptors[J]. Annual Review of Pharmacology and Toxicology, 1989, 29: 307-322. DOI:10.1146/annurev.pa.29.040189.001515 |
| [25] |
SHULOK J R, WADE M H, LIN C W. Subcellular localization of hematoporphyrin derivative in bladder tumor cells in culture[J]. Photochemistry and Photobiology, 1990, 51(4): 451-457. DOI:10.1111/j.1751-1097.1990.tb01736.x |
| [26] |
VAN STRATEN D, MASHAYEKHI V, DE BRUIJN H S, et al. Oncologic photodynamic therapy: basic principles, current clinical status and future directions[J]. Cancers, 2017, 9(2): 19. |
 2023, Vol. 59
2023, Vol. 59

