帕金森病(PD)是一种常见的神经退行性疾病,主要发生于老年人[1],其神经病理学基础是黑质致密带多巴胺能神经元选择性丢失,纹状体轴突末梢多巴胺含量减少,基底神经核直接和间接通路失平衡[2-3],从而引起一系列运动症状,包括静止性震颤、运动迟缓、僵硬和姿势不稳等[4]。脑深部电刺激是临床治疗PD运动症状的高效治疗手段,被认为能干预被刺激核团神经元的放电活动,并影响相关神经传导通路的信息传递,从而调控脑区的功能[5]。丘脑底核和苍白球内侧部是最经典的刺激靶点,最近的研究表明未定带也可作为脑深部电刺激的靶点,未定带电刺激与丘脑底核电刺激相比效果相似甚至更优[6-8],且无明显副作用,病人术后吞咽、认知和语言功能均未受影响[9]。脑深部电刺激改善PD病人运动症状的机制可能是影响了神经元的放电活动[10],但在PD状态下未定带神经元的放电是否发生了变化目前尚不清楚。本实验选用神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)制备PD小鼠模型,利用脑片膜片钳技术观察其未定带γ-氨基丁酸(GABA)能神经元的放电变化,为了解未定带在PD进展和治疗中的作用提供实验依据。
1 材料与方法 1.1 实验动物及主要试剂SPF级8周龄C57BL/6小鼠,由北京维通利华公司提供。小鼠饲养于25 ℃、12 h昼夜循环光照条件下,可自由饮水、摄食、活动。动物手术符合青岛大学动物伦理学要求。MPTP购自美国Sigma公司,酪氨酸羟化酶(TH)抗体购于美国Millipore公司。参考文献方法配制人工脑脊液及冷冻切片液进行脑片膜片钳实验[11]。
1.2 分组及给药方法将26只小鼠随机分为对照组和MPTP组,每组13只,其中7只小鼠用于旷场实验和免疫荧光实验,6只小鼠用于脑片膜片钳实验。MPTP组小鼠连续5 d腹腔注射MPTP(30 mg·kg-1·d-1),对照组小鼠连续5 d腹腔注射等量生理盐水。
1.3 旷场实验在给药结束24 h后进行旷场实验,将小鼠放于旷场测试盒里,让其自由活动,利用Ethvision XT7系统设定好旷场程序,将待测小鼠放在测试盒的中心位置,点击开始,计时10 min记录小鼠的运动情况。每次检测结束后用体积分数0.75的乙醇及擦手纸擦拭,彻底清理测试盒,散去味道后开始下一只小鼠的测试,避免陌生味道对小鼠行为产生干扰。
1.4 脑标本采集旷场实验结束之后进行脑标本的采集。麻醉小鼠,固定其四肢,暴露心脏,将静脉注射针头小心插入左心室同时剪开右心耳。先用9 g/L的NaCl对小鼠进行灌注,再应用40 g/L的多聚甲醛溶液(用0.1 mol/L的PBS配制,pH值7.2~7.4,现用现配,4 ℃避光保存)对小鼠进行灌注。待小鼠肝脏由红色变为黄白色且四肢和尾部出现僵直时,停止灌注操作。立刻取出小鼠大脑,在40 g/L多聚甲醛溶液中固定过夜,再用200 g/L蔗糖溶液(用0.1 mol/L的PBS配制)脱水,大脑沉底后,转入到300 g/L蔗糖溶液中脱水,大脑沉入底部提示脱水完成。
1.5 脑组织切片及免疫荧光染色用恒温冷冻切片机(Leica,CM1950)进行冷冻切片。切片之前将机器预冷至-20 ℃,将脑组织用包埋剂OCT(Sakura Finetek)包埋并固定在冻头托上。将小鼠脑组织切成厚度为20 μm的脑片,黑质区脑片切成完整的4套,将脑片置于含有0.01 mol/L PBS溶液的12孔板中放在4 ℃保存,进行免疫荧光实验时取出完整的1套进行染色。使用TH一抗(稀释比为1∶1 000,rabbit)和PBST稀释的荧光二抗(donkey anti-rabbit 555,稀释比为1∶500),参照文献方法进行免疫荧光染色[12]。在Olympus光学显微镜下拍片,应用OlyVIA软件进行计数。计数该套脑片在20倍物镜下黑质区TH阳性神经元个数,再乘以4即可得到黑质区TH阳性神经元的个数。统计黑质区每个高倍视野(400倍)内的阳性细胞数目并取平均值。
1.6 离体未定带脑片制备及电生理学记录记录电极由水平拉制仪拉制而成,尖端直径为1~2 μm。选取电阻为4~9 MΩ的玻璃电极进行实验。参考文献的方法进行离体未定带脑片的制备及电生理学记录[11]。
1.7 统计学分析应用Graph Pad Prism 6软件进行统计学分析。实验结果以x±s表示,组间比较采用t检验。P<0.05表示差异具有统计学意义。
2 结果 2.1 PD模型小鼠黑质TH阳性神经元数目及运动行为的变化免疫荧光染色结果显示,与对照组相比,MPTP组小鼠黑质区TH阳性神经元数目减少,差异具有统计学意义(t=2.775,P<0.05),提示小鼠出现黑质区多巴胺能神经元损伤。旷场实验结果显示,与对照组相比,MPTP组小鼠在旷场中的运动距离明显减少(t=17.870,P<0.001),提示小鼠出现运动障碍,PD模型制备成功。见图 1及表 1。
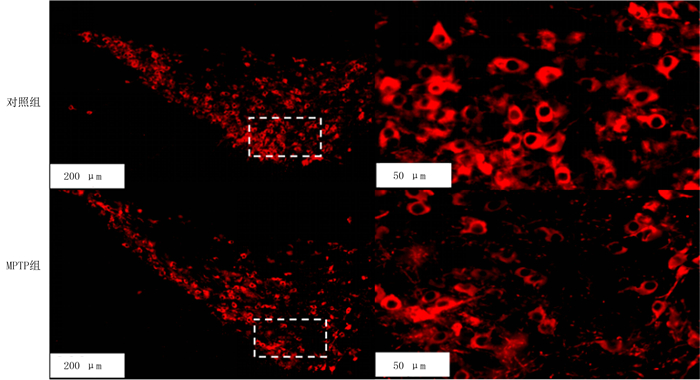 |
| 图 1 PD模型小鼠黑质区TH阳性神经元数目变化 |
| 表 1 两组小鼠黑质区TH阳性神经元数目及旷场运动距离比较(n=7,x±s) |
|
|
在全细胞记录形成之后,转为电流钳模式,给予神经元-200 pA的超极化电流刺激,神经元膜电位未出现显著的内向整流特征,且在Gap free模式下,神经元表现出较快且规则的自发放电活动,判断为GABA能神经元[13]。本实验记录到的未定带神经元放电频率约为24.17 Hz,动作电位时程较短,半宽高为(1.36±0.65)ms,符合GABA能神经元的放电特征。本实验在每组6只小鼠中各记录10个神经元,对照组和MPTP组小鼠未定带GABA能神经元放电频率分别为(24.17±8.60)和(6.73±2.18)Hz,MPTP组小鼠未定带GABA能神经元放电频率较对照组显著降低(t=5.895,P<0.001)。提示在PD状态下,未定带GABA能神经元放电活动发生了变化。见图 2。
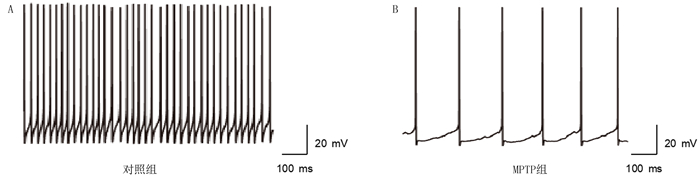 |
| 图 2 PD模型小鼠未定带GABA能神经元的放电变化 |
未定带是底丘脑的重要核团,被认为是中脑网状结构的吻部延伸,主要含GABA能神经元[14]。在啮齿类动物中,未定带大致分为4个亚区(吻侧区、背侧区、腹侧区和尾侧区),各亚区与不同的大脑区域具有纤维联系,如背侧区和吻侧区的GABA能神经元投射到皮质和丘脑,腹侧区的GABA能神经元投射到基底前脑和脑干,尾侧区接收来自小脑的纤维投射。此外,未定带内部的GABA能神经元之间也有互相联系[7]。通过复杂的纤维投射,未定带在机体多种功能的调控中均发挥重要作用,影响摄食、姿势与运动、睡眠与觉醒、大脑皮质发育、神经病理痛等多种生理病理过程[14-17]。
未定带与PD的研究近年来也受到较多关注。有临床研究观察到,在未定带实施脑深部电刺激术可显著改善PD病人的运动症状[18],这提示在PD疾病状态下,未定带神经元出现异常的电活动。已知大脑的许多功能都与神经元的电活动相关,脑深部电刺激术被认为能干预被刺激核团神经元的异常放电活动,并影响相关神经传导通路的信息传递,从而调控脑区的功能[5]。本实验首次在MPTP制备的PD模型小鼠中,利用脑片膜片钳技术观察比较未定带GABA能神经元的自发放电活动变化。本研究首先通过免疫荧光染色观察到黑质TH阳性神经元数目减少,证实多巴胺能神经元受损,旷场行为学检测进一步证明PD模型建立成功,然后观察到未定带GABA能神经元自发放电频率在模型小鼠中显著降低。以往研究也表明,在PD动物模型中,多个与PD发病相关核团神经元的电活动都出现了变化。例如,内侧苍白球神经元放电频率较正常动物增加20%~50%,其中爆发式的放电类型显著增加[19];PD大鼠模型中黑质网状带区GABA能神经元自发放电频率显著增高,并且簇状放电的神经元增多[20]。但神经元电活动出现变化的具体机制还不明确,推测可能与离子通道的开放程度有关。探索PD状态下神经元电活动的变化可为脑深部电刺激提供可选择的刺激靶点。鉴于本团队前期研究已经证实未定带神经元数目在PD小鼠模型中减少[21],我们推测,在PD状态下未定带神经元出现损伤,同时放电活动降低。本实验为进一步了解未定带神经元在PD中的病理改变提供了实验依据。
| [1] |
BLOEM B R, OKUN M S, KLEIN C. Parkinson's disease[J]. Lancet, 2021, 397(10291): 2284-2303. DOI:10.1016/S0140-6736(21)00218-X |
| [2] |
TAO M Z, DOU K X, XIE Y J, et al. The associations of cerebrospinal fluid biomarkers with cognition, and rapid eye movement sleep behavior disorder in early Parkinson's disease[J]. Frontiers in Neuroscience, 2022, 16: 1049118. DOI:10.3389/fnins.2022.1049118 |
| [3] |
JELLINGER K A. The pathobiological basis of depression in Parkinson disease: challenges and outlooks[J]. Journal of Neural Transmission, 2022, 129(12): 1397-1418. DOI:10.1007/s00702-022-02559-5 |
| [4] |
PAJARES M, I ROJO A, MANDA G, et al. Inflammation in Parkinson's disease: mechanisms and therapeutic implications[J]. Cells, 2020, 9(7): 1687. DOI:10.3390/cells9071687 |
| [5] |
YUAN G H, ZHENG Y J, WANG Y, et al. Multiscale entropy and small-world network analysis in rs-fMRI-new tools to evaluate early basal Ganglia dysfunction in diabetic peripheral neuropathy[J]. Frontiers in Endocrinology, 2022, 13: 974254. DOI:10.3389/fendo.2022.974254 |
| [6] |
BAUMGARTNER A J, THOMPSON J A, KERN D S, et al. Novel targets in deep brain stimulation for movement disorders[J]. Neurosurgical Review, 2022, 45(4): 2593-2613. DOI:10.1007/s10143-022-01770-y |
| [7] |
OSSOWSKA K. Zona incerta as a therapeutic target in Parkinson's disease[J]. Journal of Neurology, 2020, 267(3): 591-606. DOI:10.1007/s00415-019-09486-8 |
| [8] |
MARCO R D, BHARGAVA D, MACEROLLO A, et al. Could ZI have a role in DBS for Parkinson's disease? An observational study to optimize DBS target localization[J]. Journal of Clinical Neuroscience, 2020, 77: 89-93. DOI:10.1016/j.jocn.2020.05.029 |
| [9] |
PHILIPSON J, BLOMSTEDT P, FREDRICKS A, et al. Short- and long-term cognitive effects of deep brain stimulation in the caudal zona incerta versus best medical treatment in patients with Parkinson's disease[J]. Journal of Neurosurgery, 2020, 134(2): 357-365. |
| [10] |
AUBIGNAT M, LEFRANC M, TIR M, et al. Deep brain stimulation programming in Parkinson's disease: introduction of current issues and perspectives[J]. Revue Neurologique, 2020, 176(10): 770-779. DOI:10.1016/j.neurol.2020.02.009 |
| [11] |
CHANG X L, MA Z G, SHI L M, et al. Effects of ghrelin on the electrical activities of substantia nigra dopaminergic neurons treated with MPP[J]. Neurochemistry International, 2020, 138: 104780. DOI:10.1016/j.neuint.2020.104780 |
| [12] |
IM K, MARENINOV S, DIAZ M P, et al. An introduction to performing immunofluorescence staining[J]. Methods in Molecular Biology, 2019, 1897: 299-311. |
| [13] |
TRAGESER J C, BURKE K A, MASRI R, et al. State-dependent gating of sensory inputs by zona incerta[J]. Journal of Neurophysiology, 2006, 96(3): 1456-1463. DOI:10.1152/jn.00423.2006 |
| [14] |
YANG Y, JIANG T, JIA X Y, et al. Whole-brain connectome of GABAergic neurons in the mouse zona incerta[J]. Neuroscience Bulletin, 2022, 38(11): 1315-1329. DOI:10.1007/s12264-022-00930-w |
| [15] |
YE Q Y, ZHANG X B. Serotonin activates paraventricular thalamic neurons through direct depolarization and indirect di-sinhibition from zona incerta[J]. The Journal of Physiology, 2021, 599(21): 4883-4900. DOI:10.1113/JP282088 |
| [16] |
OH S G, HWANG Y G, LEE H S. LIM homeobox 6 (Lhx6)+ neurons in the ventral zona incerta project to the core portion of the lateral supramammillary nucleus in the rat[J]. Brain Research, 2020, 1748: 147125. DOI:10.1016/j.brainres.2020.147125 |
| [17] |
HU T T, WANG R R, DU Y, et al. Activation of the intrinsic pain inhibitory circuit from the midcingulate Cg2 to zona incerta alleviates neuropathic pain[J]. The Journal of Neuroscience, 2019, 39(46): 9130-9144. DOI:10.1523/JNEUROSCI.1683-19.2019 |
| [18] |
STENMARK PERSSON R, NORDIN T, HARIZ G M, et al. Deep brain stimulation of caudal zona incerta for Parkinson's disease: one-year follow-up and electric field simulations[J]. Neuromodulation, 2022, 25(6): 935-944. DOI:10.1111/ner.13500 |
| [19] |
HOOVER J E, STRICK P L. The organization of cerebellar and basal ganglia outputs to primary motor cortex as revealed by retrograde transneuronal transport of Herpes simplex virus type 1[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 1999, 19(4): 1446-1463. DOI:10.1523/JNEUROSCI.19-04-01446.1999 |
| [20] |
BOLAM J P, HANLEY J J, BOOTH P A, et al. Synaptic organisation of the basal Ganglia[J]. Journal of Anatomy, 2000, 196(Pt 4): 527-542. |
| [21] |
曹中凯, 陈凤华, 谢俊霞, 等. 帕金森病模型小鼠PV和NOS阳性神经元数目变化[J]. 青岛大学学报(医学版), 2022, 58(3): 345-348. |
 2023, Vol. 59
2023, Vol. 59

