脑缺血是指大脑各部分血液供应不足导致脑组织缺血低氧,进而导致脑组织发生不可逆的损伤,具有高发生率、高致死率和高致残率的特点,严重影响了人类的生命健康。脑缺血是一个宽泛的术语,其相关疾病包括缺血性脑卒中、短暂性脑缺血发作、烟雾病等。其中缺血性脑卒中的特征是大脑某个区域的血液循环突然丧失,导致相应的神经功能丧失,临床上常用组织性纤溶酶原激活剂(TPA)静脉给药进行溶栓。但是当脑缺血持续时间较长时,恢复血流再灌注会加重脑损伤的程度[1]。因此,许多学者将目光移向新型神经保护药物的开发,以减少脑缺血以及随后再灌注引起的损伤。葛根素是豆科植物葛根中的一种黄酮苷,一项涉及3 224名缺血性脑卒中参与者的meta分析表明,葛根素注射液治疗缺血性脑卒中临床效果较好,且相对安全[2]。本文对葛根素的抗脑缺血作用及其机制进行综述,以期为葛根素治疗和预防脑缺血相关疾病的基础和临床研究提供理论依据。
1 葛根素的临床抗脑缺血作用血管狭窄、闭塞所致的脑供血不足会导致相应供血区的脑组织发生不可逆损害改变,脑缺血所致的脑梗死致残率和致死率极高,在我国已经成为危害人们健康的一大疾病。传统西医疗法使用阿替普酶等溶栓药进行治疗难以达到预期疗效。葛根素作为传统中药,具有活血化瘀及下调炎症反应的作用,可改善脑供血。有临床研究结果显示,接受常规抗血小板药物奥扎格雷联合葛根素治疗后,急性脑梗死病人日常生活活动能力量表(ADL)评分升高,美国国立卫生研究院卒中量表(NIHSS)评分降低,同时血清炎性因子及血小板活化因子水平降低[3]。有相似研究表明,葛根素注射液联合阿替普酶静脉溶栓治疗能有效改善脑梗死病人的预后[4]。还有临床研究结果表明,对于脑动脉硬化所致脑缺血的病人,盐酸氟桂利嗪胶囊联合葛根素注射液治疗能够改善脑血流动力学和血管内皮功能,从而提高治疗效果[5]。以上研究均表明,葛根素注射液联合临床常用药治疗脑缺血及其相关疾病有较好的疗效,具有一定的临床推广价值。
2 葛根素抗脑缺血的作用机制 2.1 抗炎脑缺血会引发显著的炎症反应,包括脑内小胶质细胞和巨噬细胞的激活以及促炎细胞因子的上调。因此,抗炎可能是治疗缺血再灌注脑损伤的一种可行的潜在策略。有动物实验研究表明,在大鼠大脑中动脉阻塞模型中,葛根素可能是通过抑制Toll样受体4(TLR4)介导的和髓样分化因子88(MyD88)依赖性的信号通路抑制核因子kappa B(NF-κB)的活化,进而降低促炎因子基因的表达;葛根素还可通过下调早期生长反应因子1(Egr-1)及激活AMPK通路抑制炎性反应,从而减少脑梗死面积,改善大鼠术后神经功能,起到保护作用[6-8]。此外,葛根素还可以通过激活JAK2/STAT3通路,增加磷酸化STAT3的表达,与NF-κB竞争结合胆碱能抗炎途径中的DNA,降低NF-κB基因的表达,从而部分调节炎症反应[9]。最近,伍忠根等[10]应用散峰度成像技术进一步证实,葛根素可通过降低JAK的磷酸化水平抑制下游炎症反应。
此外,还有很多研究提出葛根素可与许多药物配伍使用发挥抗炎作用。LING等[11]的研究证实,葛根素与丹参中的主要活性成分丹酚酸B配伍,能协同抑制TLR4和MyD88蛋白表达,从而降低炎症分子基因的表达,达到抑制炎症的效果,并提出7∶10的比例是它们的最佳组合。刘钊等[12]的研究表明,葛根素和栀子苷、川芎嗪合理配伍,能有效抑制炎症因子的释放,起到抗炎、促进脑部血流恢复的作用,三者的最佳配伍比为4∶3∶1。上述研究提示,葛根素临床应用前景广泛,具有较大的开发潜能。
2.2 抗氧化应激氧化应激被认为是脑缺血引起脑组织损伤的重要因素[13]。葛根素可提高脑内超氧化物歧化酶(SOD)活性,降低线粒体丙二醛(MDA)含量,从而降低自由基含量,减弱其对脑组织造成的损伤[14]。郑王巧等[15]的实验进一步证明了以上结论,并提出葛根素可能是通过抑制线粒体氧自由基的产生,恢复ATP酶活性,对缺血再灌注损伤发挥保护作用。此外,氧化应激还通过激活基质金属蛋白酶(MMP,特别是MMP-9)和损伤内皮细胞增加血-脑脊液屏障的通透性[16],而葛根素可以通过下调MMP-9的表达发挥抗氧化应激作用[17]。尚远宏[18]使用梓葛冻干粉(由梓醇和葛根素组成)进行动物实验,进一步验证了葛根素的上述作用。以上研究结果提示,葛根素作为一种异黄酮类化合物,具有缓解氧化应激、保护受损脑组织的作用。
2.3 抑制细胞凋亡和自噬研究证实,PI3K/Akt信号通路是参与细胞增殖调控的重要通路之一,Akt在PI3K调控下通过多种途径调控细胞的凋亡,主要途径包括:①调节Bcl-2家族成员的活性,通过抑制磷酸化Bad、增加游离的Bcl-2发挥抗凋亡作用;②通过磷酸化叉头蛋白O1FKHR,抑制促凋亡基因的转录,抗细胞凋亡;③促进环磷腺苷效应元件结合蛋白(CREB)的表达;④增强Mdm2转录因子的活性,促进p53的失活,负调控细胞凋亡;⑤直接抑制caspase-9磷酸化而使其失活,抑制细胞凋亡;⑥通过抑制糖原合成酶激酶3(GSK-3)活性抑制细胞凋亡,同时加快糖酵解的速度,使ATP的生成增加,抑制细胞凋亡;⑦抑制线粒体释放细胞色素C、凋亡诱导因子,抑制凋亡[19-21]。见图 1。
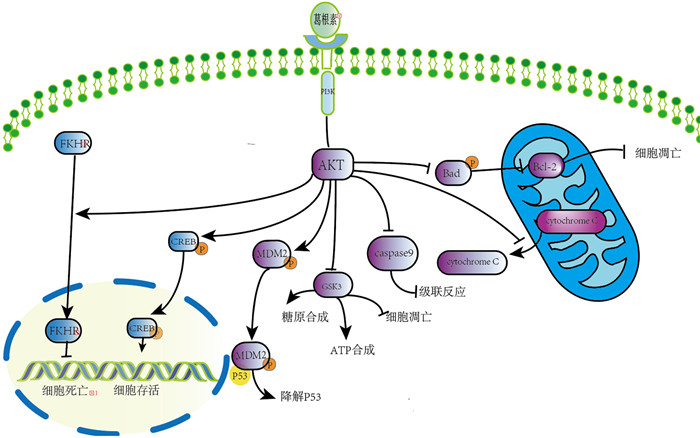 |
| 图 1 葛根素抑制细胞凋亡和自噬的作用机制 |
已知缺血低氧以及缺血再灌注后产生的大量自由基可以下调抗凋亡蛋白Bcl-2的水平,上调凋亡相关基因Bax、Bim、caspase-3等的表达,激活caspase通路发生级联反应,加速细胞凋亡。相关研究表明,葛根素一方面可以通过上调Bcl-2的水平,降低Beclin1的表达和LC3-Ⅱ/LC3-Ⅰ的比例,抑制自噬及凋亡;另一方面,葛根素可通过调节凋亡相关因子、脑源性神经营养因子(BDNF)、PI3K/Akt信号通路和MAPK/ERK信号通路等减少脑缺血损伤星形胶质细胞的凋亡[22-23]。同时,葛根素还可以增加尼氏小体和胶质纤丝酸性蛋白质(GFAP)阳性的细胞数目,上调BDNF和X染色体连锁凋亡抑制蛋白质(XIAP)的表达[24]。此外,葛根素和辛醇配伍使用可通过激活ERK和PI3K/Akt/mTOR途径,上调低氧诱导因子1α(HIF-1α)表达,下调细胞凋亡水平[25]。
众所周知,AMPK能够促进自噬,而mTOR抑制自噬。葛根素可能通过激活APMK/mTOR/ULK1信号通路,降低AMPK和ULK1 Ser317的磷酸化,从而解除激活的AMPK对mTOR的抑制作用,使mTOR水平上调,而mTOR通过磷酸化ULK1 Ser757并破坏ULK1和AMPK之间的相互作用来防止ULK1活化,减轻自噬[26-27]。有相关研究表明,葛根素在神经元间的分布比在星形胶质细胞间的分布更广,保留时间更长;葛根素对脑缺血损伤的神经保护作用是通过减弱缺血诱导的神经元自噬实现的,而不是通过减弱星形胶质细胞的自噬[28-29]。最近LIU等[30]的研究也发现,经葛根素处理后的K562/ADR(耐阿霉素)细胞表现出Akt和JNK磷酸化水平的降低,因此推断葛根素可以通过Akt途径诱导细胞自噬。对于自噬激活在脑缺血中是有益还是有害仍有争议,但大多数学者认为调节自噬水平是脑卒中的潜在治疗靶点。
2.4 扩张脑血管及改善血流葛根素可以扩张血管、降低血液黏稠度,改善微循环。有临床研究结果显示,葛根素治疗可以提高病人血浆中一氧化氮(NO)、内皮素-1(ET-1)、前列环素(PGI2)、血栓素B2(TXB2)、6-酮-前列腺素1α水平,升高大脑中动脉平均血流速度,改善脑灌注[31]。还有研究显示,葛根素具有β肾上腺素能受体阻滞作用,能够对抗垂体后叶素引起的动脉血管痉挛[25]。葛根素与辛醇配伍使用,可上调HIF-1α表达,进而促进tip细胞形成和内皮祖细胞归巢,从而促进大鼠脑缺血后新血管的生成。葛根素还可抑制血小板聚集,增加PGI2合成,降低血栓素A2(TXA2)水平,从而降低TXA2/PGI2比值[31-32]。葛根素具有封闭CD18、CD11a抗原作用,可抑制白细胞表面黏附因子蛋白表达[32]。综上所述,葛根素可通过扩张血管、抑制血小板聚集、降低血液黏稠度、抑制白细胞表面黏附因子表达等途径改善脑灌注和微循环[32-33]。
2.5 发挥植物类雌激素样作用有研究表明,葛根素可能作为一种植物类雌激素,通过与雌激素受体结合和CaMKⅡ依赖性途径刺激PI3K/Akt和AMPK活化,进而激活内皮型一氧化氮合酶,促进NO的生成,扩张血管;葛根素还能抑制肿瘤坏死因子α(TNF-α)诱导的NF-κB的活化,从而抑制炎症[34-35]。已知髓样细胞白血病-1(Mcl-1) 是一种属于bcl-2家族的抗凋亡蛋白,经葛根素-雌激素受体途径激活的Akt可以通过磷酸化GSK-3β,上调Mcl-1蛋白表达水平,阻断caspase-3激活,从而促进大鼠海马细胞存活。
2.6 增强低氧诱导的miR-214的表达miR-214与神经组织的发育和再生有关,最近有研究证实,miR-214在脑缺血再灌注损伤的发病机制中起着关键作用,可能会成为潜在的治疗靶点[36]。已知低氧会诱导miR-214的表达,改善细胞的代谢活动,而葛根素可以通过调节微小RNA(miRNA)来调节特定基因的表达[37-38]。WANG等[39]的研究表明,葛根素预处理后的细胞内miR-214的水平增高,低氧诱导的细胞凋亡减轻,提示葛根素的这种保护作用可能与其激活下游的PI3K/Akt和MEK/ERK信号通路有关。
3 临床应用葛根素的不同给药途径葛根素应用于临床已经获得了满意的效果,然而,由于葛根素渗透度较差,导致传统口服给药生物利用度低。一些相关研究对葛根素的不同给药途径进行了探索。与口服给药相比,经鼻至脑(NBDD)给药可以提高葛根素的生物利用度和药物靶向效率,因为NBDD给药避开了血-脑脊液屏障,且避免了经胃肠的吸收以及肝脏的首过消除。有研究表明,葛根素联用渗透促进剂,如薄荷醇,可以增加其在Calu-3细胞中的吸收[40-41]。且环氧树脂改性水性聚氨酯(PUE)加载的微乳液可以延长葛根素在鼻腔内的停留时间,提高葛根素的渗透率[42]。近些年来有人提出了一个新的理论,脑缺血的治疗应该针对整个功能单元即神经血管单元(NVU,由微血管、星形胶质细胞、神经元、细胞外基质和其他类型的胶质细胞组成)。有研究表明,地黄的主要活性成分辛醇和葛根素配伍能够通过增强有利因素和减少氧化应激、炎症、血-脑脊液屏障损伤来保护NVU的3种主要类型的细胞[43]。
4 小结及展望目前,有关葛根素的动物实验和临床研究取得了重大成果,其作用机制主要包括抗炎、抗氧化应激、抗凋亡和自噬、扩张脑血管和改善血流、植物类雌激素样作用等。然而,有关脑缺血中自噬激活的利弊和葛根素扩张血管的机制等目前还不够明确,有待进一步的实验研究。探索葛根素与其他中药的配伍使用以及配伍比例有助于挖掘其更多的药理作用及作用机制,从而使葛根素更好地应用于临床。
| [1] |
庄灿彬, 万杰清. 颅内动脉闭塞治疗进展[J]. 心脑血管病防治, 2020, 20(4): 333-339. DOI:10.3969/j.issn.1009-816x.2020.04.001 |
| [2] |
ZHENG Q H, LI X L, MEI Z G, et al. Efficacy and safety of puerarin injection in curing acute ischemic stroke: a meta-analysis of randomized controlled trials[J]. Medicine, 2017, 96(1): e5803. DOI:10.1097/MD.0000000000005803 |
| [3] |
孟新颜, 耿德勤. 奥扎格雷联合葛根素治疗急性脑梗死患者的临床疗效及其对病灶侧支循环的影响[J]. 实用心脑肺血管病杂志, 2019, 27(10): 104-108. DOI:10.3969/j.issn.1008-5971.2019.10.020 |
| [4] |
郭玉远. 葛根素联合阿替普酶静脉溶栓对急性脑梗死的效果[J]. 河南医学研究, 2019, 28(4): 696-697. DOI:10.3969/j.issn.1004-437X.2019.04.062 |
| [5] |
董来宾. 葛根素注射液联合氟桂利嗪治疗脑动脉硬化症的临床研究[J]. 现代药物与临床, 2018, 33(11): 2832-2835. |
| [6] |
王晓晨, 吉爱国. NF-κB信号通路与炎症反应[J]. 生理科学进展, 2014, 45(1): 68-71. |
| [7] |
ZHOU F, WANG L, LIU P P, et al. Puerarin protects brain tissue against cerebral ischemia/reperfusion injury by inhibiting the inflammatory response[J]. Neural Regeneration Research, 2014, 9(23): 2074-2080. DOI:10.4103/1673-5374.147934 |
| [8] |
祝春华, 葛龙敏, 郭家辉, 等. 葛根素对脑梗死大鼠p-AMPK、Egr-1水平的影响[J]. 河北医药, 2020, 42(18): 2792-2795. DOI:10.3969/j.issn.1002-7386.2020.18.015 |
| [9] |
LIU X J, MEI Z G, QIAN J P, et al. Puerarin partly counteracts the inflammatory response after cerebral ischemia/reperfusion via activating the cholinergic anti-inflammatory pathway[J]. Neural Regeneration Research, 2013, 8(34): 3203-3215. DOI:10.3969/j.issn.1673-5374.2013.34.004 |
| [10] |
伍忠根, 刘培文, 刘晖, 等. 葛根素对大鼠脑缺血-再灌注损伤的影响[J]. 江苏医药, 2021, 47(2): 109-113, 104. |
| [11] |
LING C L, LIANG J M, ZHANG C, et al. Synergistic effects of salvianolic acid B and puerarin on cerebral ischemia reperfusion injury[J]. Molecules (Basel, Switzerland), 2018, 23(3): 564. DOI:10.3390/molecules23030564 |
| [12] |
刘钊, 钟菊迎, 高尔宁, 等. 栀子苷、川芎嗪和葛根素配伍对脑缺血再灌注损伤的保护作用[J]. 中成药, 2020, 42(7): 1754-1759. |
| [13] |
BROUNS R, DE DEYN P P. The complexity of neurobiological processes in acute ischemic stroke[J]. Clinical Neurology and Neurosurgery, 2009, 111(6): 483-495. DOI:10.1016/j.clineuro.2009.04.001 |
| [14] |
王培源, 王海萍, 李光武. 葛根黄酮对大鼠脑缺血再灌注损伤的保护作用[J]. 中国中药杂志, 2006, 31(7): 577-579. DOI:10.3321/j.issn:1001-5302.2006.07.014 |
| [15] |
郑王巧, 郭春花, 张晓一, 等. 葛根素对大鼠局灶性脑缺血再灌注线粒体损伤的保护作用[J]. 中华中医药学刊, 2009, 27(5): 1072-1073. |
| [16] |
TANG X Q, ZHONG W, TU Q Y, et al. NADPH oxidase mediates the expression of MMP-9 in cerebral tissue after ischemia-reperfusion damage[J]. Neurological Research, 2014, 36(2): 118-125. DOI:10.1179/1743132813Y.0000000266 |
| [17] |
封菲, 洪鸣鸣, 高越. 葛根素对脑缺血大鼠脑组织MMP-9表达和脑水肿的影响[J]. 浙江中西医结合杂志, 2013, 23(6): 440-442. |
| [18] |
尚远宏. 梓葛冻干粉针对大鼠脑微循环障碍的改善作用及其机制研究[D]. 重庆: 西南大学, 2014.
|
| [19] |
黄秀兰, 崔国辉, 周克元. PI3K-Akt信号通路与肿瘤细胞凋亡关系的研究进展[J]. 癌症, 2008, 27(3): 331-336. |
| [20] |
潘蓉蓉, 金永喜, 朱文宗. PI3K/Akt信号通路介导的细胞凋亡机制研究进展[J]. 浙江中西医结合杂志, 2013, 23(1): 70-72. |
| [21] |
王维, 张琍. PI3K/Akt信号转导通路的研究进展[J]. 现代医药卫生, 2010, 26(7): 1051-1052. |
| [22] |
王昆, 罗小娜, 李时光, 等. Nrf2/HO-1信号通路在6-羟基多巴胺帕金森病模型大鼠神经损伤中的作用[J]. 中国医药生物技术, 2019, 14(3): 237-244. |
| [23] |
王静静, 梅志刚, 汪露, 等. 葛根素对脑缺血再灌注大鼠海马组织中Bcl-2、Beclin1及LC3蛋白表达的影响[J]. 时珍国医国药, 2018, 29(5): 1064-1068. |
| [24] |
WANG N, ZHANG Y M, WU L, et al. Puerarin protected the brain from cerebral ischemia injury via astrocyte apoptosis inhibition[J]. Neuropharmacology, 2014, 79: 282-289. |
| [25] |
刘杨. 基于HIF-1α梓葛冻干粉针抗脑缺血血管内皮细胞凋亡和促新血管形成作用及其机制研究[D]. 重庆: 西南大学, 2018.
|
| [26] |
WANG J F, MEI Z G, FU Y, et al. Puerarin protects rat brain against ischemia/reperfusion injury by suppressing autophagy via the AMPK-mTOR-ULK1 signaling pathway[J]. Neural Regeneration Research, 2018, 13(6): 989-998. |
| [27] |
KIM J, KUNDU M, VIOLLET B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nature Cell Biology, 2011, 13(2): 132-141. |
| [28] |
HE H Y, GUO T, ZHANG P Y, et al. Puerarin provides a neuroprotection against transient cerebral ischemia by attenuating autophagy at the ischemic penumbra in neurons but not in astrocytes[J]. Neuroscience Letters, 2017, 643: 45-51. |
| [29] |
WEI S Y, TONG J, XUE Q, et al. Puerarin exhibits greater distribution and longer retention time in neurons than astrocytes in a co-cultured system[J]. Neural Regeneration Research, 2015, 10(4): 605-609. |
| [30] |
LIU Q, WANG C Y, MENG Q, et al. Puerarin sensitized K562/ADR cells by inhibiting NF-κB pathway and inducing autophagy[J]. Phytotherapy Research, 2021, 35(3): 1658-1668. |
| [31] |
王嘉炜, 高觉民, 黄玉杰, 等. 葛根素对动脉瘤性蛛网膜下腔出血后脑血管痉挛相关血管活性因子的影响[J]. 中国中西医结合杂志, 2012, 32(2): 164-167. |
| [32] |
冯健. 葛根素对急性脑梗死患者血液流变学的影响[J]. 现代中西医结合杂志, 2007, 16(8): 1053-1054. |
| [33] |
杨恬恬, 姜康, 梅志刚, 等. 葛根素注射液防治缺血性中风的临床与基础研究[J]. 时珍国医国药, 2019, 30(10): 2477-2480. |
| [34] |
TAO J H, CUI Y H, DUAN Y, et al. Puerarin attenuates locomotor and cognitive deficits as well as hippocampal neuronal injury through the PI3K/Akt1/GSK-3β signaling pathway in an in vivo model of cerebral ischemia[J]. Oncotarget, 2017, 8(63): 106283-106295. |
| [35] |
HWANG Y P, KIM H G, HIEN T T, et al. Puerarin activates endothelial nitric oxide synthase through estrogen receptor-dependent PI3-kinase and calcium-dependent AMP-activated protein kinase[J]. Toxicology and Applied Pharmacology, 2011, 257(1): 48-58. |
| [36] |
SHI Y, TIAN T, CAI E L, et al. MiR-214 alleviates ischemic stroke-induced neuronal death by targeting DAPK1 in mice[J]. Frontiers in Neuroscience, 2021, 15: 649982. |
| [37] |
EL AZZOUZI H, LEPTIDIS S, DIRKX E, et al. The hypoxia-inducible microRNA cluster miR-199a~214 targets myocardial PPARδ and impairs mitochondrial fatty acid oxidation[J]. Cell Metabolism, 2013, 18(3): 341-354. |
| [38] |
LI Z F, XU W W, REN X Y, et al. Puerarin promotes DUSP1 expression by regulating miR-133a-3p in breast cancer[J]. Molecular Medicine Reports, 2019, 19(1): 205-212. |
| [39] |
WANG B Y, MA W N, YANG H Y. Puerarin attenuates hypoxia-resulted damages in neural stem cells by up-regulating microRNA-214[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1): 2746-2753. |
| [40] |
LONG Y, YANG Q Y, XIANG Y, et al. Nose to brain drug delivery-A promising strategy for active components from herbal medicine for treating cerebral ischemia reperfusion[J]. Pharmacological Research, 2020, 159: 104795. |
| [41] |
ZHANG L, DU S Y, LU Y, et al. Puerarin transport across a Calu-3 cell monolayer-an in vitro model of nasal mucosa permeability and the influence of paeoniflorin and menthol[J]. Drug Design, Development and Therapy, 2016, 10: 2227-2237. |
| [42] |
YU A H, WANG H G, WANG J L, et al. Formulation optimization and bioavailability after oral and nasal administration in rabbits of puerarin-loaded microemulsion[J]. Journal of Pharmaceutical Sciences, 2011, 100(3): 933-941. |
| [43] |
XUE Q, LIU Y, HE R, et al. Lyophilized Powder of catalpol and puerarin protects neurovascular unit from stroke[J]. International Journal of Biological Sciences, 2016, 12(4): 367-380. |
 2023, Vol. 59
2023, Vol. 59

