急性缺血性脑卒中是一种全球性疾病[1]。目前有效治疗方式包括静脉溶栓和血管内取栓治疗[2]。由于多种原因导致该疾病病人得到有效救治比例很低[3]。缺血性脑卒中的病理生理学机制极其复杂,开发其有效救治药物的需求极其迫切[4]。近年来,中医药治疗急性缺血性脑卒中受到越来越多的关注。荆防颗粒由荆防败毒散方剂演变而来[5-6]。荆防颗粒由荆芥、防风、羌活、独活、柴胡、前胡、川芎、枳壳、茯苓、桔梗、甘草11味中药组成,具有发汗解表、散风祛湿的作用,现已广泛应用于多种疾病治疗[7-8]。目前关于荆防颗粒治疗急性缺血性脑卒中的作用机制尚不清楚。本研究旨在从网络药理学的角度预测荆防颗粒治疗急性缺血性脑卒中的成分、靶点和信号通路,为临床应用荆防颗粒治疗急性缺血性脑卒中提供理论依据[9]。
1 资料和方法 1.1 荆防颗粒有效成分及靶点筛选本研究利用中药系统药理学数据库和分析平台(TCMSP)数据库[10](https://old.tcmsp-e.com/tcmsp.php)收集荆防颗粒中药的有效化学成分,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18为筛选标准,获得其活性成分以及其作用的蛋白质靶点。将收集到的作用靶点输入UnitProt数据库[11](https://www.uniprot.org)进行标准化转换,以获取目标基因名称。之后,将目标基因导入Cytoscape 3.9.1软件,建立荆防颗粒“中药-有效成分-基因靶点”网络,根据靶标Degree值定义图形大小。
1.2 急性缺血性脑卒中疾病靶点获取本研究使用在线人类孟德尔遗传(OMIM)数据库(https://www.omim.org)、Drugbank数据库[12](https://go.drugbank.com)以及GeneCards数据库[13](https://www.genecards.org),输入关键词“acute ischemic stroke”筛选疾病基因靶点,将3个数据库中所有疾病基因靶点汇总后去重,最终得到急性缺血性脑卒中疾病的相关基因靶点。
1.3 荆防颗粒与急性缺血性脑卒中靶点蛋白质相互作用(PPI)网络构建为明确荆防颗粒药物相关靶点与急性缺血性脑卒中疾病靶点之间的相互作用,将二者靶点取交集,并绘制韦恩图。将交集靶点输入到String数据库(https://cn.string-db.org)构建PPI网络模型图,利用Cytoscape 3.9.1软件对PPI网络进行分析,并通过Betweenness (BC)、Closeness (CC)、Degree (Dc)、Eigenvector (EC)值筛选核心靶点。
1.4 GO及KEGG通路富集分析将荆防颗粒与急性缺血性脑卒中的交集基因输入到Metascape数据库[14],设定物种为H. sapiens,设置P < 0.01,进行GO功能分析和KEGG通路分析。选取排名在前的相关信号通路,通过欧易生物信息云平台(https://cloud.oebiotech.com)进行可视化分析并生成条形图和气泡图。最后应用Cytoscape 3.9.1软件建立荆防颗粒与急性缺血性脑卒中交集基因与信号通路关系的网络图。
2 结果 2.1 荆防颗粒有效成分与靶点的筛选荆防颗粒由荆芥、防风、羌活、独活、柴胡、前胡、川芎、枳壳、茯苓、桔梗、甘草11味中药组成,根据OB≥30%和DL≥0.18进行筛选,获得11味中药的有效活性成分,其中荆芥有312个有效成分,见表 1。同时筛选出11味中药彼此重合的有效成分共有17个,见表 2。
| 表 1 荆防颗粒有效成分和基因个数 |
|
|
| 表 2 荆防颗粒重复有效成分 |
|
|
将上述11味中药在TCMSP数据库查阅到的有效成分输入到UniProt数据库中进行标准化处理,转化为基因靶点,再经过删除重复值和去除尚未证实的基因靶点,发现荆芥有效成分共对应155个基因靶点,其余各成分对应基因靶点个数见表 1。最后将荆防颗粒11味中药对应的基因全部整合在一起,删除重复基因靶点,最终得到与荆防颗粒相关的非重复性基因靶点共有215个,见表 1。将荆防颗粒有效成分和基因靶点导入Cytoscape 3.9.1软件,形成荆防颗粒“中药-有效成分-基因靶点”网络关系图(图 1)。
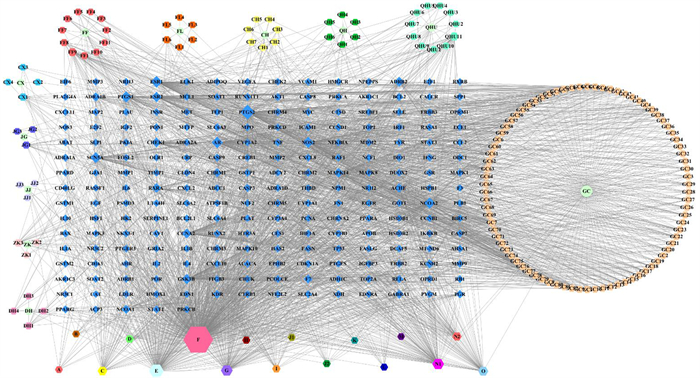 |
| 图 1 荆防颗粒“中药-有效成分-基因靶点”网络图 |
通过OMIM数据库中Gene Map分析得到急性缺血性脑卒中疾病184个基因靶点,通过OMIM数据库EntryRetrieval分析得到94个基因靶点,通过Drugbank数据库分析得到11个基因靶点,通过GeneCards数据得有1 087个基因靶点,将这些急性缺血性脑卒中疾病基因靶点汇总去重后,共获得1 256个非重复基因靶点(图 2)。
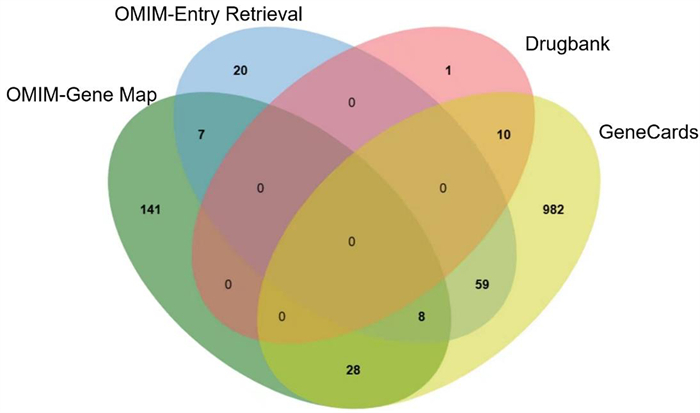 |
| 图 2 急性缺血性脑卒中疾病靶点基因个数 |
将荆防颗粒的215个基因靶点与急性缺血性脑卒中的1 256个潜在疾病基因靶点取交集,共得到114个交集基因靶点,并绘制韦恩图(图 3),这114个基因靶点被认为是荆防颗粒治疗急性缺血性脑卒中过程中发挥作用的潜在基因靶点。将靶点提交到String数据库,得到荆防颗粒治疗急性缺血性脑卒中基因靶点蛋白质相互作用网络(图 4)。同时,将蛋白质相互作用网络图导入Cytoscape 3.9.1软件,利用CytoNCA插件筛选核心靶点,并进行可视化分析(图 5、6),得到核心靶点共15个,它们分别为肿瘤蛋白P53(TP53)、信号转导和转录激活剂3(STAT3)、蛋白激酶B(AKT1)、白细胞介素6(IL-6)、肿瘤坏死因子(TNF)、雌激素受体α(ESR1)、丝裂原活化蛋白激酶1(MAPK1)、丝裂原活化蛋白激酶3(MAPK3)、白细胞介素1B(IL-1B)、纤维连接蛋白1(FN1)、表皮生长因子受体(EGFR)、趋化因子配体2(CCL2)、细胞间黏附分子1(ICAM1)、丝裂原活化蛋白激酶8(MAPK8)、前列腺素内过氧化物酶2(PTGS2)。
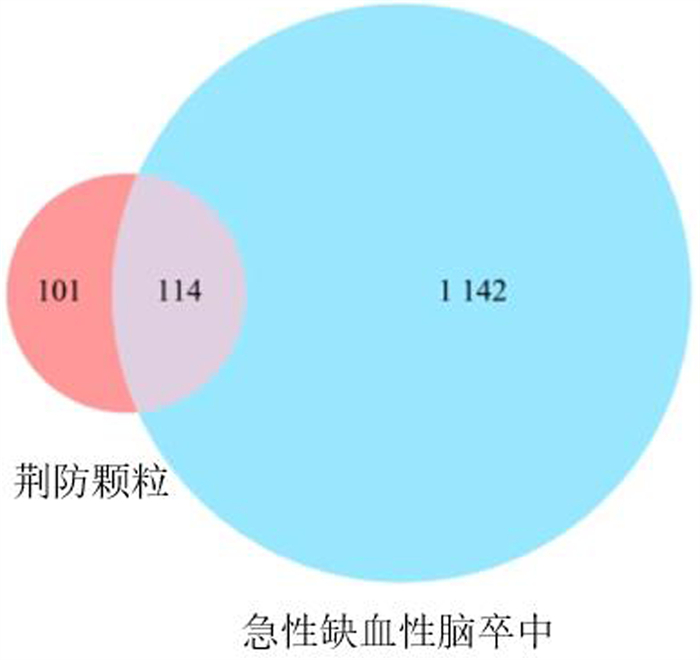 |
| 图 3 荆防颗粒基因靶点和急性缺血性脑卒中疾病基因靶点韦恩图 |
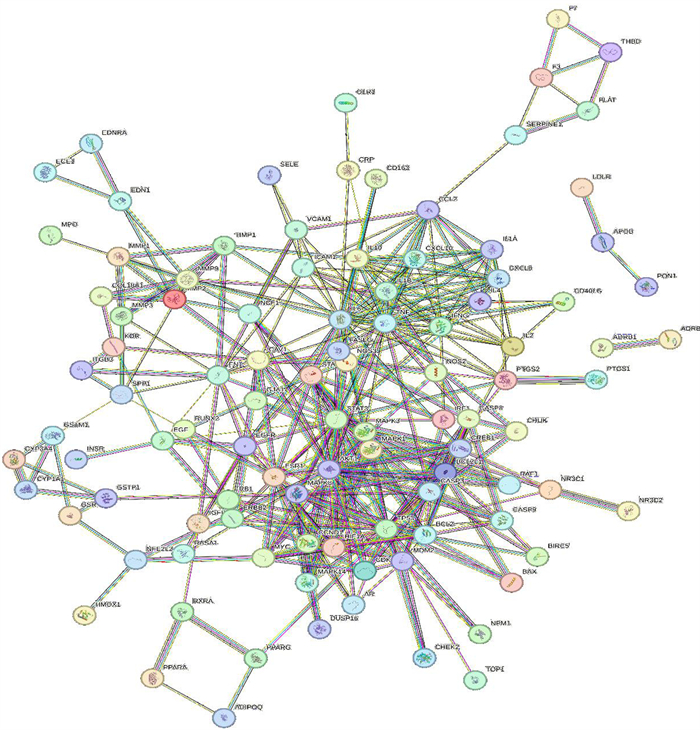 |
| 图 4 荆防颗粒与急性缺血性脑卒中PPI网络 |
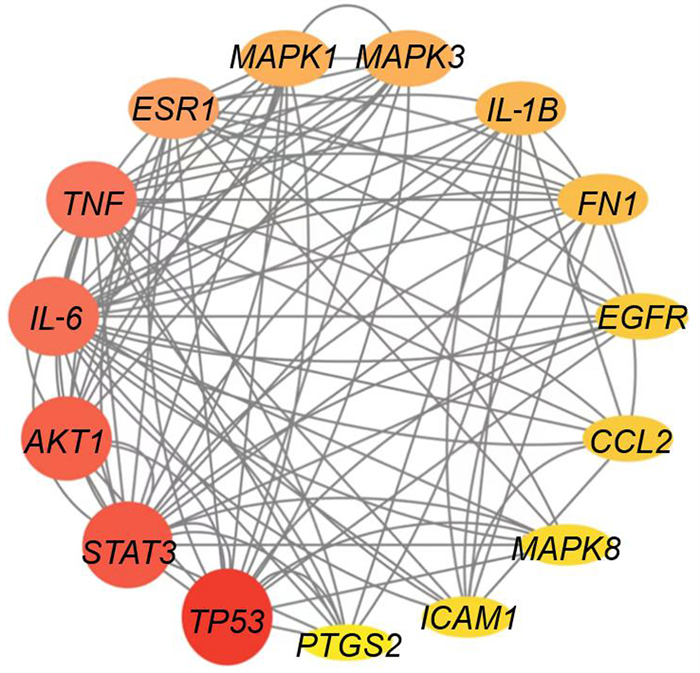 |
| 图 5 荆防颗粒治疗急性缺血性脑卒中核心靶点 |
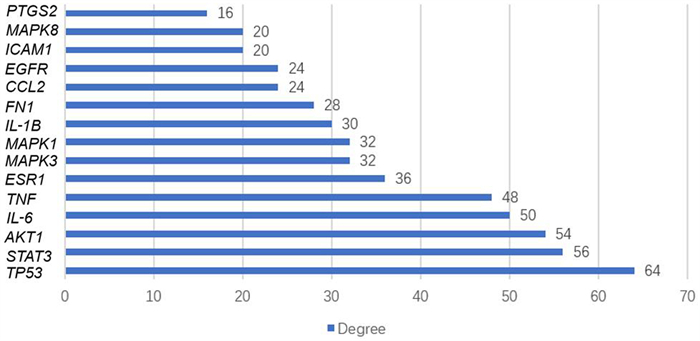 |
| 图 6 荆防颗粒治疗急性缺血性脑卒中疾病15个核心基因靶点的Degree值 |
GO功能富集分析主要包括生物过程(BP)、细胞成分(CC)和分子功能(MF)。将114个潜在治疗基因靶点输入到Metascape数据库,得到GO功能条目共1 888个, 其中BP条目共有1 674个,主要涉及细胞对激素的反应、对无机物的反应、对细菌的反应等;CC条目共有73个,主要涉及膜筏、膜微域、膜的侧面等;MF条目共有141个,主要参与蛋白质结构域特异性结合、蛋白质二聚体活性、激酶结合等(图 7)。
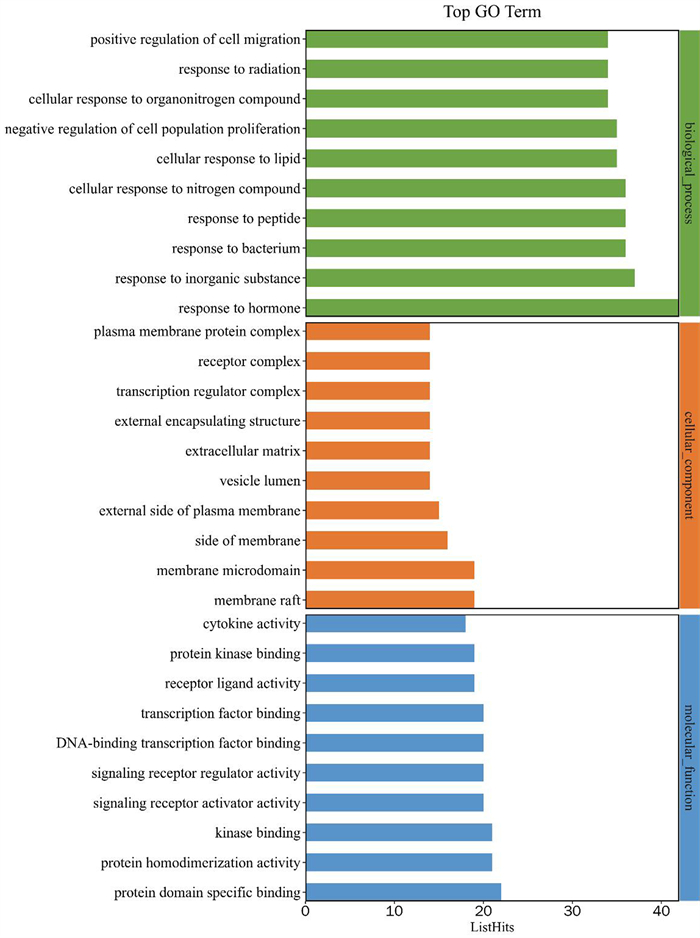 |
| 图 7 GO功能富集分析 |
KEGG通路富集分析共得到190条通路,按HitList中位数筛选出97条通路进行分析,结果表明,荆防颗粒中的活性成分主要通过作用于脂质和动脉粥样硬化信号通路、TNF信号通路、PI3K-AKT信号通路、IL-17信号通路、HIF-1信号通路等发挥治疗急性缺血性脑卒中的作用(图 8)。将97条信号通路和114个潜在治疗基因靶点输入到Cytoscape 3.9.1软件进行可视化分析,得到有关“基因-信号通路”网络关系图(图 9)。对其分析表明,荆防颗粒可能通过调节炎症反应、细胞因子、TNF信号通路以及PI3K/AKT信号通路等对急性缺血性脑卒中起到治疗作用。
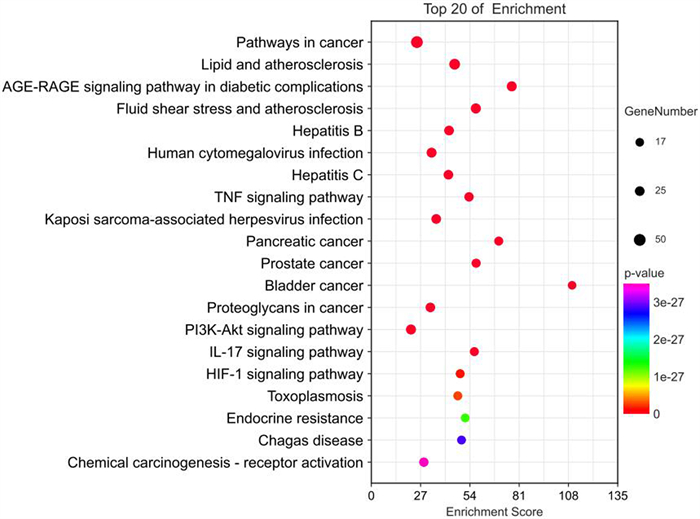 |
| 图 8 KEGG通路富集分析 |
 |
| 图 9 荆防颗粒治疗急性缺血性脑卒中“114个基因-97条信号通路”网络关系 |
目前,有效治疗急性缺血性脑卒中的方法非常有限,西药单一靶点难以解决所有问题,因此探索治疗急性缺血性脑卒中的有效药物至关重要[15]。近年来,中医药治疗急性缺血性脑卒中因其具有确切的疗效和低毒性而受到越来越多的关注[16]。荆防颗粒具有改善能量代谢循环、解表驱汗、抗炎等作用,动物实验表明,荆防颗粒可以通过降低促炎因子表达、抑制细胞凋亡和氧化应激损伤等发挥细胞保护作用[7, 17]。此外,荆防颗粒还可以通过PI3K/AKT信号通路发挥细胞保护作用[18]。
网络药理学通过结合各中药有效成分、相应基因靶点、对应疾病3个方面,形成“成分-靶点-疾病”网络关系图,揭示中药治疗相关疾病的有效成分和作用机制,并加快药物临床转化[19]。本研究筛选出荆防颗粒有效活性成分,其中槲皮素、β-谷甾醇、山奈酚等活性成分发挥重要作用。研究表明,槲皮素可以改善神经功能损伤评分、减少脑梗死体积、保护血脑屏障,从而对急性缺血性卒中病人发挥神经保护作用[20]。还有研究表明,槲皮素具有抗氧化、抗炎、抗凋亡和抵抗钙超载的能力[21]。作为天然存在的甾醇化合物,β-谷甾醇和豆甾醇在胆固醇稳态、抗氧化活性、抗炎活性和神经系统发育中发挥重要作用[22]。有研究表明,豆甾醇对缺血/再灌注损伤具有神经保护作用,可能通过AMPK/mTOR和JNK途径减少氧化应激和失活自噬发挥作用[23]。还有研究显示,山奈酚可以通过减少神经炎症、对抗神经元凋亡、预防氧-葡萄糖缺乏引起的细胞死亡和氧化应激,对脑卒中起到神经保护作用[24]。
在本文构建的PPI网络中,TP53、STAT3、IL-6、AKT1、TNF、MAPK3、MAPK1、MAPK8等被确定为药物发挥神经保护作用的核心靶点。研究表明,TP53诱导的糖酵解和细胞凋亡调节因子改善了脑缺血/再灌注诱导的脑损伤,从而起到神经保护作用[25]。部分药物可以通过激活STAT3、AKT等起到神经保护作用[26]。IL-6在正常中枢神经系统中表达,通过经典信号通路作为神经营养因子影响神经元稳态,在缺血性脑卒中中具有神经保护作用[27]。TNF也可调节缺血性脑卒中的组织损伤,是未来脑卒中治疗的潜在靶点[28]。MAPK家族的磷酸化在神经细胞的生长和稳态中发挥重要作用,可通过MAPK介导的机制保护脑神经元免受缺血/再灌注损伤,最终抑制细胞凋亡, 起到神经保护等作用[29]。总之,药物作用于核心靶点主要通过抗炎、抗凋亡、抗氧化应激等发挥积极治疗作用。
GO功能富集分析结果显示,荆防颗粒治疗急性缺血性脑卒中的活性成分主要作用于中枢神经系统的膜受体上,通过调节各受体功能及其下游信号通路靶点的活性发挥作用,还参与细胞对激素反应调节、细胞因子活性调节等。KEGG通路富集分析结果表明,荆防颗粒治疗急性缺血性脑卒中可能通过多条信号通路发挥作用,主要有脂质和动脉粥样硬化信号通路、TNF信号通路、PI3K-AKT信号通路、IL-17信号通路、HIF-1信号通路等。有研究表明,使用降脂类药物可降低缺血性卒中风险,而不增加出血性卒中风险,极大地减少了在高危环境中发生脑卒中的可能[30]。TNF是参与急性炎症反应的典型细胞因子之一,对缺血性脑卒中引起的炎症反应有一定的调节作用,并与缺血性脑卒中的严重程度密切相关[31]。有研究表明,PI3K/AKT信号通路是调节细胞代谢、生长、凋亡等生理活动的经典通路[32];激活PI3K/AKT信号通路可以起到抗神经元凋亡作用[33]。IL-17家族是一类重要的促炎症因子,可以促进多种细胞释放炎性因子,IL-17被认为在梗死后炎症级联反应的延迟期中具有特殊作用,也被视为一种有效的治疗靶点,其可最大限度地减少缺血性脑卒中发生后继发炎症诱导的脑损伤[33]。HIF-1是损伤反应的主要调节因子,有研究表明, HIF-1的稳定在急性缺血性脑卒中的严重程度和结局中起着关键作用[34]。
荆防颗粒治疗急性缺血性脑卒中的作用机制尚未可知。本研究从网络药理学角度预测荆防颗粒治疗急性缺血性脑卒中的成分、靶点及信号通路,为应用荆防颗粒治疗急性缺血性脑卒中提供理论基础,为发掘荆防颗粒潜在作用提供新方向。然而,本文研究也有一定的局限性。随着数据库的不断更新,相应筛选结果也需要不断完善,同时现有数据库的准确性和完整性也需要进一步验证。此外,网络药理学的结果还需要基础实验的进一步验证,以便为指导临床药物应用提供更有利的理论支持。
综上所述,本研究基于网络药理学分析了荆防颗粒治疗急性缺血性脑卒中的潜在作用机制,揭示了其多靶点与多途径之间的密切相互作用,为荆防颗粒治疗急性缺血性脑卒中提供了理论依据。
| [1] |
TSAO C W, ADAY A W, ALMARZOOQ Z I, et al. Heart disease and stroke statistics-2022 update: a report from the American heart association[J]. Circulation, 2022, 145(8): e153-e639. |
| [2] |
PHIPPS M S, CRONIN C A. Management of acute ischemic stroke[J]. BMJ, 2020, 16983. |
| [3] |
CAMPBELL B C V, DE SILVA D A, MACLEOD M R, et al. Ischaemic stroke[J]. Nature Reviews Disease Primers, 2019, 5(1): 70. DOI:10.1038/s41572-019-0118-8 |
| [4] |
WOODRUFF T M, THUNDYIL J, TANG S C, et al. Pathophysiology, treatment, and animal and cellular models of human ischemic stroke[J]. Molecular Neurodegeneration, 2011, 6(1): 11. DOI:10.1186/1750-1326-6-11 |
| [5] |
ZHU T, WANG L, WANG L P, et al. Therapeutic targets of neuroprotection and neurorestoration in ischemic stroke: applications for natural compounds from medicinal herbs[J]. Biomedecine & Pharmacotherapie, 2022, 148: 112719. |
| [6] |
梁红宝, 姜宇珺, 袁晓梅, 等. 基于GC-MS和UPLC-Q-Exactive MS技术的荆防颗粒化学成分研究[J]. 中草药, 2022, 53(6): 1697-1708. |
| [7] |
董利洋, 程国良, 姚景春, 等. 荆防颗粒对异丙肾上腺素诱导大鼠急性心肌梗死的保护作用研究[J]. 中草药, 2022, 53(21): 6785-6794. |
| [8] |
赵眉眉, 姚璐, 姚景春, 等. 荆防颗粒抗感染性肺炎的靶点发现及分子机制研究[J]. 中国中药杂志, 2023, 48(3): 789-796. |
| [9] |
NIU B X, ZHANG H, LI C Y, et al. Network pharmacology study on the active components of Pterocypsela elata and the mechanism of their effect against cerebral ischemia[J]. Drug Design, Development and Therapy, 2019, 13: 3009-3019. |
| [10] |
RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13. |
| [11] |
THE UNIPROT CONSORTIUM. UniProt: the universal protein knowledgebase[J]. Nucleic Acids Research, 2017, 45(D1): D158-D169. |
| [12] |
WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0: a major update to the DrugBank database for 2018[J]. Nucleic Acids Research, 2018, 46(D1): D1074-D1082. |
| [13] |
RAPPAPORT N, TWIK M, PLASCHKES I, et al. Mala-Cards: an amalgamated human disease compendium with diverse clinical and genetic annotation and structured search[J]. Nucleic Acids Research, 2017, 45(D1): D877-D887. |
| [14] |
ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nature Communications, 2019, 10(1): 1523. |
| [15] |
MENDELSON S J, PRABHAKARAN S. Diagnosis and ma-nagement of transient ischemic attack and acute ischemic stroke[J]. JAMA, 2021, 325(11): 1088. |
| [16] |
BU L, DAI O, ZHOU F, et al. Traditional Chinese medicine formulas, extracts, and compounds promote angiogenesis[J]. Biomedecine & Pharmacotherapie, 2020, 132: 110855. |
| [17] |
李郁茹, 赵亚芳, 程国良, 等. 荆防颗粒对CCl4诱导小鼠肝纤维化的治疗作用及其机制研究[J]. 中国中药杂志, 2022, 47(22): 6127-6136. |
| [18] |
高铭, 杨若聪, 刘淇, 等. 基于生物信息技术探究荆防颗粒解酒保肝的作用机制[J]. 中国中药杂志, 2021, 46(21): 5683-5692. |
| [19] |
NOGALES C, MAMDOUH Z M, LIST M, et al. Network pharmacology: curing causal mechanisms instead of treating symptoms[J]. Trends in Pharmacological Sciences, 2022, 43(2): 136-150. |
| [20] |
LI L, LIU Y, ZHENG Y W, et al. Exploring the mechanisms under Zuogui Pill's treatment of ischemic stroke through network pharmacology and in vitro experimental verification[J]. Frontiers in Pharmacology, 2023, 14: 1153478. |
| [21] |
WANG Y Y, CHANG C Y, LIN S Y, et al. Quercetin protects against cerebral ischemia/reperfusion and oxygen glucose deprivation/reoxygenation neurotoxicity[J]. The Journal of Nutritional Biochemistry, 2020, 83: 108436. |
| [22] |
GAO Q, TIAN D F, HAN Z Y, et al. Network pharmacology and molecular docking analysis on molecular targets and me-chanisms of Buyang Huanwu Decoction in the treatment of ischemic stroke[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2021, 2021: 8815447. |
| [23] |
SUN J D, LI X M, LIU J L, et al. Stigmasterol exerts neuro-protective effect against ischemic/reperfusion injury through reduction of oxidative stress and inactivation of autophagy[J]. Neuropsychiatric Disease and Treatment, 2019, 15: 2991-3001. |
| [24] |
WANG J, MAO J Q, WANG R, et al. Kaempferol protects against cerebral ischemia reperfusion injury through intervening oxidative and inflammatory stress induced apoptosis[J]. Frontiers in Pharmacology, 2020, 11: 424. |
| [25] |
ZHANG D M, ZHANG T, WANG M M, et al. TIGAR alle-viates ischemia/reperfusion-induced autophagy and ischemic brain injury[J]. Free Radical Biology & Medicine, 2019, 137: 13-23. |
| [26] |
HOU Y Y, WANG K, WAN W J, et al. Resveratrol provides neuroprotection by regulating the JAK2/STAT3/PI3K/AKT/mTOR pathway after stroke in rats[J]. Genes & Diseases, 2018, 5(3): 245-255. |
| [27] |
LAMBERTSEN K L, FINSEN B, CLAUSEN B H. Post-stroke inflammation—target or tool for therapy?[J]. Acta Neuropathologica, 2019, 137(5): 693-714. |
| [28] |
LAMBERTSEN K L, BIBER K, FINSEN B. Inflammatory cytokines in experimental and human stroke[J]. Journal of Cerebral Blood Flow & Metabolism, 2012, 32(9): 1677-1698. |
| [29] |
PAN B, SUN J, LIU Z Y, et al. Longxuetongluo Capsule protects against cerebral ischemia/reperfusion injury through endoplasmic reticulum stress and MAPK-mediated mechanisms[J]. Journal of Advanced Research, 2021, 33: 215-225. |
| [30] |
HACKAM D G, HEGELE R A. Lipid-modifying therapies and stroke prevention[J]. Current Neurology and Neuroscience Reports, 2022, 22(7): 375-382. |
| [31] |
OLIVEIRA D M G, AGUIAR L T, DE OLIVEIRA LIMONES M V, et al. Aerobic training efficacy in inflammation, neurotrophins, and function in chronic stroke persons: a randomized controlled trial protocol[J]. Journal of Stroke and Cerebrovascular Diseases, 2019, 28(2): 418-424. |
| [32] |
BADER A G, KANG S, ZHAO L, et al. Oncogenic PI3K deregulates transcription and translation[J]. Nature Reviews Cancer, 2005, 5(12): 921-929. |
| [33] |
WAISMAN A, HAUPTMANN J, REGEN T. The role of IL-17 in CNS diseases[J]. Acta Neuropathologica, 2015, 129(5): 625-637. |
| [34] |
TSAO C C, BAUMANN J, HUANG S F, et al. Pericyte hypoxia-inducible factor-1 (HIF-1) drives blood-brain barrier disruption and impacts acute ischemic stroke outcome[J]. Angiogenesis, 2021, 24(4): 823-842. |
 2024, Vol. 60
2024, Vol. 60

