缺血性脑卒中是一种高死亡率、高致残率的疾病,目前治疗手段仍相对匮乏,在中国其致死率排在所有重大疾病的首位, 给家庭和社会造成了沉重的负担[1]。褪黑素是松果体分泌的一类参与调节机体昼夜节律的重要激素,可以通过其受体褪黑激素受体1(MT1)和褪黑激素受体2(MT2)发挥生理作用。有研究表明,褪黑素可以通过抑制星形胶质细胞活化等机制在缺血性脑卒中中发挥神经保护作用[2-3]。ZHONG等[4]利用电针刺激内源性褪黑素的合成改善了缺血性脑损伤后大鼠的认知功能,提示内源性褪黑素在发挥神经保护作用方面扮演着重要角色。除增加褪黑素合成之外,是否可以通过增加受体MT1对褪黑素的敏感性促进内源性褪黑素发挥神经保护作用尚不明确。核因子E2相关因子2(NRF2)是一种重要的转录因子,参与了褪黑素减轻缺血性脑损伤的下游过程[5-6]。本文通过大脑中动脉栓塞(MCAO)法建立小鼠缺血性脑卒中模型,研究褪黑素受体MT1激动剂2-Iodomelatonin对缺血性脑损伤小鼠的神经保护作用及其作用机制。现将结果报告如下。
1 材料与方法 1.1 实验材料 1.1.1 实验动物SPF级雄性健康成年C57BL/6小鼠78只,6~8周龄,体质量(25±2)g,购自济南朋悦实验动物繁育有限公司,饲养于青岛大学实验动物中心。适应性饲养1周后进行实验。
1.1.2 主要实验试剂兔抗NRF2(江苏亲科生物公司);兔抗β-Actin(美国Cell Signaling Technology公司);羊抗兔IgG-HRP(英国Abcam公司);2,3,5-氯化三苯基四氮唑(TTC, 美国Sigma-Aldrich公司);NRF2抑制剂(Nrf2-IN-1,美国MCE公司);2-Iodomelatonin(美国MCE公司);BCA检测试剂盒(美国Thermo-Fisher公司);三溴乙醇(美国Sigma-Aldrich公司);Western Blot相关试剂(北京索莱宝公司);超敏发光液(美国Millipore公司)。
1.2 实验方法 1.2.1 实验分组为了研究2-Iodomelatonin对缺血性脑损伤小鼠的神经保护作用,实验分为Control组(A组)、Sham组(B组)、大脑中动脉栓塞组(MCAO组,C组)、MCAO+Vehicle组(D组)、MCAO+2-Iodomelatonin组(E组), 每组各6只小鼠。为了研究2-Iodomelatonin对缺血性脑损伤再灌注小鼠皮质半暗带NRF2的影响,实验分为Sham组、MCAO组、MCAO+Vehicle组、MCAO+2-Iodomelatonin组,每组各6只小鼠,用Western Blot方法检测各组小鼠皮质半暗带在缺血再灌注6 h后的NRF2表达情况并进行定量分析。为了研究2-Iodomelatonin以及NRF2水平对脑缺血再灌注损伤小鼠神经保护作用的影响,实验分为MCAO组、MCAO+Vehicle组、MCAO+2-Iodomelatonin组、MCAO+2-Iodomelatonin+Nrf2-IN-1组,每组各6只小鼠,MCAO+2-Iodomelatonin组、MCAO+2-Iodomelatonin+Nrf2-IN-1组小鼠连续14 d在褪黑素分泌较旺盛的夜间以5 mg/kg剂量尾静脉注射2-Iodomelatonin,在缺血再灌注损伤后第1、7、14天分别对各组小鼠进行改良神经功能缺损程度评分(mNSS)。各研究中MCAO+2-Iodomelatonin组小鼠均在恢复脑血流供应后尾静脉注射5 mg/kg剂量的2-Iodomelatonin,MCAO+Vehicle组小鼠在恢复脑血流供应后尾静脉注射等体积生理盐水, MCAO+2-Iodomelatonin+Nrf2-IN-1组在MCAO术前12 h以10 mg/kg剂量尾静脉注射NRF2抑制剂Nrf2-IN-1。
1.2.2 MCAO模型制备采用线栓法建立缺血性脑损伤体内模型。小鼠经20 g/L三溴乙醇麻醉, 仰卧位固定于手术台上, 消毒颈部皮肤, 取颈部正中切口, 暴露分离血管。结扎颈总动脉近心端和颈外动脉远心端, 将线栓插入颈内动脉, 固定线栓于特定深度以阻塞大脑中动脉开口处,90 min后拔去线栓恢复小鼠血流供应, 缝合皮肤。术后将小鼠头皮剪开暴露颅骨,将激光检测探头对准小鼠颅骨顶端,应用脑血流仪(PeriCam PSIZoom)检测术后大脑血流变化, 血流降低75%以上表示梗阻成功,随后缝合小鼠头皮。
1.2.3 Western Blot法检测NRF2蛋白表达在缺血再灌注后6 h,从小鼠颅骨中取出经PBS缓冲液灌注后的大脑,用镊子钳取大脑皮质梗死核心区与周围正常组织区交界处(梗死半暗带)的组织约100 mg,在冰上研磨、RIPA裂解液裂解、12 000 r/min离心10 min,收取上清,用BCA法测定蛋白浓度。以每孔10 μg蛋白标准上样至SDS-PAGE凝胶进行电泳(80 V),转膜(320 mA, 60 min)至PVDF膜后,用50 g/L的BSA溶液常温封闭2 h,弃去封闭液后换用一抗溶液(NRF2 1∶1 000; β-Actin 1∶5 000)4 ℃孵育过夜,TBST缓冲液洗脱3次,每次10 min, 使用羊抗兔二抗(1∶20 000)室温孵育1 h; TBST缓冲液洗脱3次,每次10 min, 化学发光法显影。用Image J(1.52a)软件分析条带灰度值, 计算NRF2蛋白的相对表达量。
1.2.4 TTC染色与梗死体积检测MCAO再灌注24 h后, 小鼠腹腔注射20 g/L三溴乙醇麻醉, 用生理盐水进行心脏灌注。剥离脑组织置于冠状位脑槽中, 2 mm厚度切片。将脑片置于20 g/L的TTC溶液中, 37 ℃避光孵育30 min, 每隔10 min摇晃1次。用40 g/L多聚甲醛固定液浸泡24 h, 磷酸盐缓冲液冲洗3次。将大脑冠状切片按从前至后的顺序依次从上至下摆放, 用扫描仪采集图像, Image J软件定量检测各组梗死体积。
1.2.5 行为学检测分别在缺血再灌注后第1、7、14天,应用mNSS方法对小鼠步态、悬尾后行为、感觉能力、平衡能力、神经反射等运动功能进行评定[7]:将小鼠悬尾,观察其肢体弯曲情况,由轻至重以0~3分评价;将小鼠平放于桌面,观察其行走能力和方向,由轻至重以0~3分评价;用物理方法刺激小鼠肢体,评价其深浅感觉能力,由轻至重以0~2分评价;用物理方法刺激小鼠特定位置,观察其耳郭反射、角膜反射、惊吓反射存在情况和异常活动情况,由轻至重以0~4分评价;将小鼠放置在平衡木实验装置上,观察其通过时间及肢体掉落次数,由轻至重以0~6分评价。将以上各项评分相加得到总评分,0分表示无运动功能损伤,1~6分表示轻度运动功能损伤,7~12分表示中度运动功能损伤,13~18分表示重度运动功能损伤。
1.3 统计学分析应用Graphpad Prism 9.4.1软件进行统计学分析。计量资料以x ± s表示,多组单因素比较采用单因素方差分析(one-way ANOVA),两两比较采用SNK法;各组mNSS得分的比较采用重复测量设计的方差分析(repeated measures ANOVA), 多重比较采用SNK法。以P < 0.05为差异有统计学意义。
2 结果 2.1 2-Iodomelatonin对脑缺血再灌注损伤小鼠大脑梗死体积的影响MCAO术后缺血侧与正常侧相比脑血流灌注显著下降,提示血流梗阻成功(图 1A、B)。
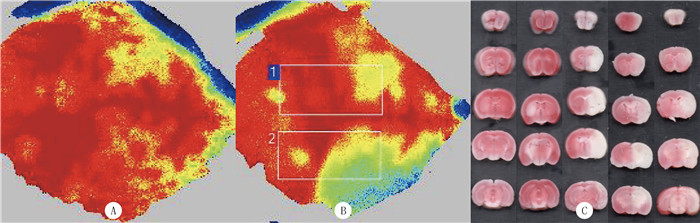 |
| A:小鼠MCAO术前大脑脑血流灌注图像;B:小鼠MCAO术后大脑脑血流灌注图像,区域1表示正常侧血流灌注量,区域2表示缺血侧血流灌注量;C:各组小鼠脑切片TTC染色观察。 图 1 MCAO术后小鼠大脑缺血侧血流灌注量观察及各组小鼠脑切片TTC染色观察 |
TTC染色显示,梗死区域为白色,正常区域为红色(图 1C),A、B、C、D、E组的脑梗死体积分别为0、0、(32.28±5.63)%、(31.09±5.25)%、(21.39±4.90)%,各组差异具有统计学意义(F=7.79,P < 0.01)。与MCAO组相比,MCAO+Vehicle组小鼠大脑梗死体积差异无显著性(q=0.55,P>0.05);与MCAO+Vehicle组相比,MCAO+2-Iodomelatonin组小鼠大脑梗死体积显著下降(q=5.06,P < 0.01),提示再灌注后2-Iodomelatonin干预降低大脑梗死体积。
2.2 2-Iodomelatonin对脑缺血再灌注损伤小鼠皮质梗死半暗带NRF2的影响Western Blot检测结果显示,Sham组、MCAO组、MCAO+Vehicle组、MCAO+2-Iodomelatonin组NRF2表达水平分别为0.66±0.11、0.98±0.22、0.98±0.23、1.31±0.22,各组间NRF2表达比较差异有统计学意义(F=10.56, P < 0.001)。两两比较显示,MCAO+Vehicle组小鼠的NRF2表达水平较Sham组显著上升(q=3.97,P < 0.05);而与MCAO+Vehicle组相比,MCAO+2-Iodomelatonin组小鼠皮质半暗带NRF2的表达显著上升(q=3.99,P < 0.05)。见图 2。
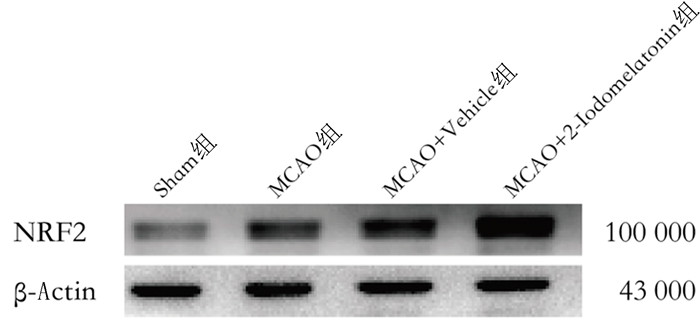 |
| 图 2 各组小鼠皮质梗死半暗带NRF2表达Western Blot检测 |
重复测量设计的方差分析显示,不同组间的mNSS评分差异无显著性(F组间=2.40,P>0.05),不同时间mNSS评分差异有显著性(F时间=439.40,P < 0.001),mNSS评分时间与组间存在交互作用(F交互=3.45, P < 0.01)。单因素方差分析显示,第14天时,各组mNSS评分差异有显著性(F=6.12,P < 0.05);两两比较显示,MCAO+2-Iodomelatonin组mNSS评分较MCAO+Vehicle组显著降低(q=4.79, P < 0.05),MCAO+2-Iodomelatonin+Nrf2-IN-1组的mNSS评分较MCAO+2-Iodomelatonin组显著升高(q=3.60, P < 0.05)。其他时间各组间mNSS评分比较差异无显著性(P>0.05)。见表 1。
| 表 1 各组不同时间mNSS评分比较(n=6, x ± s) |
|
|
缺血性脑卒中是一种在世界上各类重大疾病中致死率排在前列的疾病,并且70%的生存者会在后续的生活中劳动能力受限,给社会和家庭带来沉重的负担[8]。目前,对于缺血性脑卒中的治疗手段主要包括以静脉溶栓和机械取栓为代表的血管再通治疗、抗凝抗栓治疗以及脑保护药物治疗[9]。然而,由于缺乏对于缺血性脑损伤后细胞及分子机制足够的认识,现有的治疗手段虽能够使梗死脑组织快速恢复血流供应,但无法恢复梗死灶的脑功能。
褪黑素是一种由松果体分泌的内源性激素,发挥调控睡眠与觉醒的生理作用。内源性褪黑素可以通过减轻炎症反应、抗氧化、抗凋亡和减轻自噬功能障碍等途径,在缺血性脑损伤后发挥神经保护作用,而缺乏内源性褪黑素可能加重缺血性脑损伤[10-15]。ZHONG等[4]使用电针刺激促进内源性褪黑素的合成,有效改善了缺血性脑损伤后小鼠的认知功能。内源性褪黑素可以通过与细胞膜上的受体MT1和MT2结合发挥神经保护作用。近年的研究表明,MT1和MT2参与了一些中枢神经系统疾病的发生发展[16-17]。褪黑素可以通过MT2受体促进缺血性脑损伤后小鼠的神经生长,而MT1受体在缺血性脑损伤中发挥的作用尚不明确[18]。MT1是一个由350个氨基酸组成的G蛋白耦连受体,相关研究发现过表达MT1可以减缓缺血性脑损伤和新生儿缺血低氧性脑病的发展进程[19-20]。本文研究结果显示,给予缺血性脑损伤后小鼠MT1受体激动剂2-Iodomelatonin后24 h,小鼠大脑的梗死体积较损伤后给予生理盐水组显著下降,提示褪黑素受体MT1参与了内源性褪黑素发挥的神经保护作用。本文研究同时应用mNSS方法评估了2-Iodomelatonin干预第1、7、14天小鼠的行为学变化,结果显示,2-Iodomelatonin干预促进了缺血性脑损伤小鼠亚急性期的运动功能康复,同时NRF2抑制剂抑制了2-Iodomelatonin的神经保护效果,提示NRF2可能是2-Iodomelatonin在亚急性期发挥神经功能保护作用的途径之一。本文研究仅在内源性褪黑素分泌较旺盛的夜间给予2-Iodomelatonin干预,是否1 d内多次或其他时间点给予2-Iodomelatonin干预可以影响其神经保护作用效果仍需进一步研究。
本文研究结果显示,2-Iodomelatonin可以上调大脑梗死半暗带区皮质NRF2的表达水平,提示NRF2可能是2-Iodomelatonin在梗死半暗带发挥神经保护作用的下游靶点之一。NRF2是一种属于“帽领”家族的转录因子,在哺乳动物的细胞中广泛表达。有研究结果显示,NRF2在缺血性脑损伤后的神经元细胞、星形胶质细胞和缺血半暗带中的表达均上调[21-22]。在缺血性脑损伤后ROS的刺激下,NRF2可以脱离Keap-1进入细胞核内扮演转录因子的角色。进入细胞核内的NRF2可以通过NF-κB信号通路抑制炎症反应发挥神经保护作用,也可以与ARE结合调控抗氧化酶相关基因的表达发挥神经保护作用[23]。还有研究结果显示,NRF2表达上调可以在促进肿瘤生长的同时降低铁超载、抑制铁死亡[24-25]。由此推断,2-Iodomelatonin可能是通过NRF2参与抑制损伤后炎症反应、氧化应激以及铁死亡过程,发挥神经保护作用。本研究仅提取了缺血再灌注后急性期的大脑梗死半暗带蛋白,2-Iodomelatonin对于缺血再灌注损伤之后更长时间NRF2表达影响仍需进一步研究。
综上所述,褪黑素是一种可以发挥神经保护作用的内源性激素,2-Iodomelatonin是一种针对其受体MT1的激动剂,可能是一种潜在缺血性脑损伤后的神经保护靶标。针对MT1研究可能有利于未来神经保护药物的开发。
| [1] |
FEIGIN V L, NORRVING B, MENSAH G A. Global burden of stroke[J]. Circulation Research, 2017, 120(3): 439-448. DOI:10.1161/CIRCRESAHA.116.308413 |
| [2] |
BORLONGAN C V, YAMAMOTO M, TAKEI N, et al. Glial cell survival is enhanced during melatonin-induced neuroprotection against cerebral ischemia[J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2000, 14(10): 1307-1317. |
| [3] |
XIANG J, ZHU W, YANG F, et al. Melatonin-induced ApoE expression in mouse astrocytes protects endothelial cells from OGD-R induced injuries[J]. Translational Psychiatry, 2020, 10(1): 181. DOI:10.1038/s41398-020-00864-9 |
| [4] |
ZHONG X Y, CHEN B, LI Z F, et al. Electroacupuncture ameliorates cognitive impairment through the inhibition of NLRP3 inflammasome activation by regulating melatonin-mediated mitophagy in stroke rats[J]. Neurochemical Research, 2022, 47(7): 1917-1930. DOI:10.1007/s11064-022-03575-3 |
| [5] |
FARINA M, VIEIRA L E, BUTTARI B, et al. The Nrf2 pathway in ischemic stroke: a review[J]. Molecules, 2021, 26(16): 5001. DOI:10.3390/molecules26165001 |
| [6] |
GOU Z X, SU X J, HU X, et al. Melatonin improves hypoxic-ischemic brain damage through the Akt/Nrf2/Gpx4 signaling pathway[J]. Brain Research Bulletin, 2020, 163: 40-48. DOI:10.1016/j.brainresbull.2020.07.011 |
| [7] |
SAKATA H, NARASIMHAN P, NIIZUMA K, et al. Interleukin 6-preconditioned neural stem cells reduce ischaemic injury in stroke mice[J]. Brain: a Journal of Neurology, 2012, 135(Pt 11): 3298-3310. |
| [8] |
KATAN M, LUFT A. Global burden of stroke[J]. Seminars in Neurology, 2018, 38(2): 208-211. DOI:10.1055/s-0038-1649503 |
| [9] |
POWERS W J, RABINSTEIN A A, ACKERSON T, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2019, 50(12): e344-e418. |
| [10] |
REITER R J, MAYO J C, TAN D X, et al. Melatonin as an antioxidant: under promises but over delivers[J]. Journal of Pineal Research, 2016, 61(3): 253-278. DOI:10.1111/jpi.12360 |
| [11] |
CHEUNG R T F. The utility of melatonin in reducing cerebral damage resulting from ischemia and reperfusion[J]. Journal of Pineal Research, 2003, 34(3): 153-160. DOI:10.1034/j.1600-079X.2003.00034.x |
| [12] |
ZHANG H M, ZHANG Y Q. Melatonin: a well-documented antioxidant with conditional pro-oxidant actions[J]. Journal of Pineal Research, 2014, 57(2): 131-146. DOI:10.1111/jpi.12162 |
| [13] |
HUANG R, XU Y, LU X, et al. Melatonin protects inner re-tinal neurons of newborn mice after hypoxia-ischemia[J]. Journal of Pineal Research, 2021, 71(1): e12716. DOI:10.1111/jpi.12716 |
| [14] |
CHOI S I, KIM K S, OH J Y, et al. Melatonin induces autophagy via an mTOR-dependent pathway and enhances clea-rance of mutant-TGFBIp[J]. Journal of Pineal Research, 2013, 54(4): 361-372. DOI:10.1111/jpi.12039 |
| [15] |
MANEV H, UZ T, KHARLAMOV A, et al. Increased brain damage after stroke or excitotoxic seizures in melatonin-deficient rats[J]. FASEB Journal: Official Publication of the Fe-deration of American Societies for Experimental Biology, 1996, 10(13): 1546-1551. DOI:10.1096/fasebj.10.13.8940301 |
| [16] |
WANG X, SIRIANNI A, PEI Z J, et al. The melatonin MT1 receptor axis modulates mutant Huntingtin-mediated toxicity[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2011, 31(41): 14496-14507. DOI:10.1523/JNEUROSCI.3059-11.2011 |
| [17] |
SULKAVA S, MUGGALLA P, SULKAVA R, et al. Melatonin receptor type 1A gene linked to Alzheimer's disease in old age[J]. Sleep, 2018, 41(7): zsy103. |
| [18] |
CHERN C M, LIAO J F, WANG Y H, et al. Melatonin ameliorates neural function by promoting endogenous neuroge-nesis through the MT2 melatonin receptor in ischemic-stroke mice[J]. Free Radical Biology & Medicine, 2012, 52(9): 1634-1647. |
| [19] |
SUOFU Y, LI W, JEAN-ALPHONSE F G, et al. Dual role of mitochondria in producing melatonin and driving GPCR signaling to block cytochrome c release[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(38): e7997-E8006. |
| [20] |
SINHA B, WU Q F, LI W, et al. Protection of melatonin in experimental models of newborn hypoxic-ischemic brain injury through MT1 receptor[J]. Journal of Pineal Research, 2018, 64(1). doi: 10.1111/jpi.12443.Epub 2017 Oct 23.
|
| [21] |
TAKAGI T, KITASHOJI A, IWAWAKI T, et al. Temporal activation of Nrf2 in the penumbra and Nrf2 activator-mediated neuroprotection in ischemia-reperfusion injury[J]. Free Radical Biology & Medicine, 2014, 72: 124-133. |
| [22] |
PURDOM-DICKINSON S E, SHEVELEVA E V, SUN H P, et al. Translational control of nrf2 protein in activation of antioxidant response by oxidants[J]. Molecular Pharmacology, 2007, 72(4): 1074-1081. DOI:10.1124/mol.107.035360 |
| [23] |
AHMED S M, LUO L, NAMANI A, et al. Nrf2 signaling pathway: pivotal roles in inflammation[J]. Biochimica et Biophysica Acta Molecular Basis of Disease, 2017, 1863(2): 585-597. DOI:10.1016/j.bbadis.2016.11.005 |
| [24] |
FAN Z, WIRTH A K, CHEN D, et al. Nrf2-Keap1 pathway promotes cell proliferation and diminishes ferroptosis[J]. Oncogenesis, 2017, 6(8): e371. DOI:10.1038/oncsis.2017.65 |
| [25] |
KERINS M J, OOI A. The roles of NRF2 in modulating cellular iron homeostasis[J]. Antioxidants & Redox Signaling, 2018, 29(17): 1756-1773. |
 2024, Vol. 60
2024, Vol. 60

