2. 康复大学青岛医院(青岛市市立医院)感染性疾病科;
3. 康复大学青岛医院(青岛市市立医院)临床研究中心;
4. 山东省医药卫生肝脏疾病临床研究重点实验室
血色病是一种铁代谢障碍性疾病,过量的铁沉积在肝脏、胰腺、心脏、脾、皮肤、关节等组织器官,导致器官功能障碍和结构破坏,表现为肝病、糖尿病、心律失常、心肌病、关节炎、青铜色皮肤、性腺/甲状腺功能减退等[1]。该病男性较女性多见(2.2∶1)。现将本院收治的1例血幼素(HJV)基因突变相关血色病病人的临床资料报告如下。
1 病例报告病人,女,48岁,因间断腹泻1年就诊于当地医院,住院期间发现肝功能异常、肝硬化、血糖异常升高。为进一步明确病因,遂来我院就诊。既往史无特殊。查体:慢性肝病面容,全身皮肤颜色晦暗,上腹部轻压痛,双手指间关节肿痛。病人皮肤色素沉着情况见图 1。
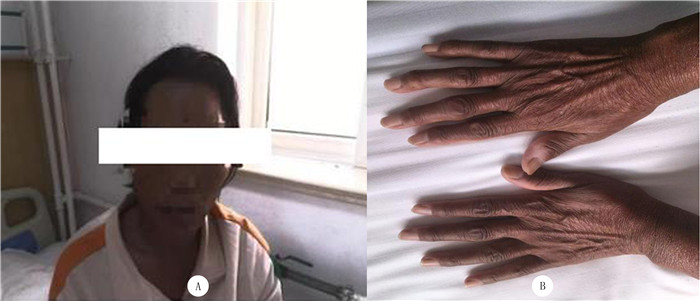 |
| A:面部;B:手背。 图 1 病人皮肤色素沉着情况 |
实验室检查:清蛋白32.7 g/L,血清总胆汁酸12.8 μmol/ L,总胆红素32.6 μmol/L,直接胆红素7.1 μmol/L,间接胆红素25.5 μmol/L,碱性磷酸酶181.9 U/L,丙氨酸氨基转移酶46.4 U/L,天门冬氨酸氨基转移酶73.0 U/L,钾离子3.3 mmol/L,红细胞计数3.3×1012/L,血小板计数64.0×1012/L,癌胚抗原5.5 μg/L,糖类抗原-125 40.4 kU/L,糖类抗原19-9 149.3 kU/L,血清铁41.3 μmol/L,铁蛋白水平3 105.1 μg/L。腹部增强CT检查:肝硬化、脾大、门脉高压、食管脾门静脉曲张、胆囊炎,肝脏CT值达95~120 Hu。胃镜检查:食管胃底静脉曲张,食管炎(LA-A),糜烂性胃炎(病人有门脉高压、血小板减少,为减少出血风险,未取活检)。电子结肠镜检查所见:结肠黏膜未见明显异常。肝脏穿刺病理检查:小叶内肝索结构紊乱,部分肝细胞气球样变性,肝细胞结节状分布,肝纤维化,肝细胞、胆管细胞内见弥漫的棕黄色颗粒沉着,小胆管增生显著,Perls(+)。见图 2。免疫组化检查:CK19(胆管+),CK7(胆管+)。病理诊断:血色素沉着症并肝纤维化。应用基因测序+MLPA技术对其血液样本进行HFE/HJV/HAMP/TFR2/SLC40A1基因检测,在HJV基因编码区检测到1处纯合无义变异:c.962_963delinsAA(p.Cys321*)。基因测序峰图见图 3。
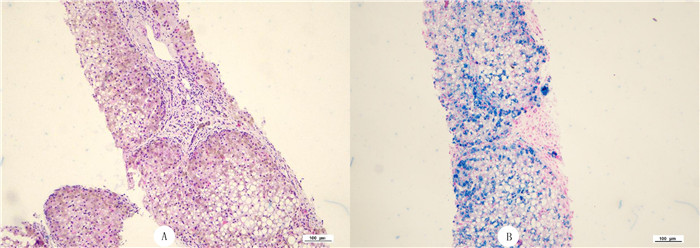 |
| A:苏木精-伊红染色,100倍;B:特殊染色,100倍。 图 2 肝脏穿刺病理检查结果 |
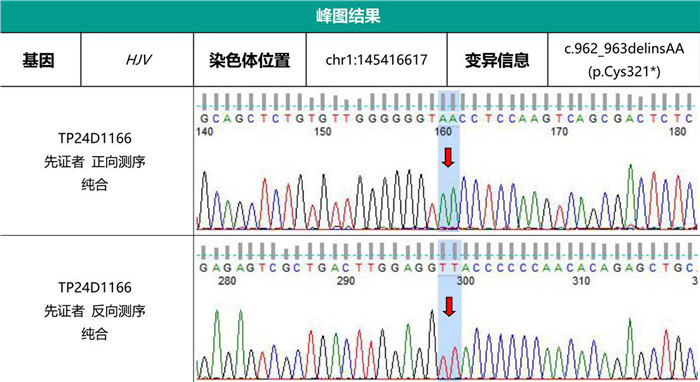 |
| 图 3 基因测序峰图 |
依据2022年欧洲肝病学会血色病临床实践指南[2]及美国肝病学会2011年血色病诊疗指南[3],排除继发性血色病后,综合病人临床症状、实验室检查、影像学检查、肝脏穿刺病理结果以及遗传性血色病(HH)相关基因检测,最终诊断为HJV基因突变相关血色病[4]。
去铁治疗是血色病的首选治疗方案,包括静脉放血疗法、去除红细胞疗法以及口服铁螯合剂(如地拉罗司)等[5];此外,还有口服铁转运蛋白拮抗剂、肠外补充外源性铁调素(铁代谢的负性调节激素)以及内源性刺激铁调素合成等新兴方法,但使用方法及具体治疗量仍在探索中[6];终末期血色病病人也可以选择肝移植治疗,研究显示血色病病人肝移植术后存活率与其他病因行肝移植病人相比并无明显差别[7]。综合病人意愿,给予病人新型铁螯合剂——地拉罗司分散片(1 000 mg/d)进行驱铁治疗,同时给予病人保肝、抑酸护胃、调节肠道菌群、止泻等对症治疗,并嘱病人糖尿病饮食、低铁饮食,定期复查肝功能、血清铁、铁蛋白、血糖等相关指标。
随访结果:病人出院2月后复查临床生化指标,结果较前变化不显著,但临床症状明显改善,血糖控制良好;病人5月后再次复查,肝功能较前明显改善,但铁蛋白变化不明显,目前继续规律随访中。
2 讨论血色病按病因可分为遗传性和继发性两大类[8-9]。欧洲肝病学会流行病学资料显示,HH在全世界18~70岁人群中发病率为1.5‰~3.0‰,北欧白人的发病率可达1/400~1/200[10]。但HH在我国发病率极低,目前尚无完整HH流行病学资料。研究显示,我国湖南西部及毗邻地区纯苗族人群的HH群体患病率高达0.48%[11],这提示我国HH有明显的家族聚集性和种族性。
近年来,铁代谢分子机制研究的快速发展,进一步阐明了HH的致病基因[12]。HH根据致病基因可分为4型:Ⅰ型为HFE基因突变所致的血色病,在欧美国家多见[13];Ⅱ型为HJV基因或HAMP基因突变所致的血色病,其中前者被称为ⅡA型,后者被称为ⅡB型[14-15];Ⅲ型为TFR2基因突变所致的血色病[16];Ⅳ型为SLC40A1基因突变所致的血色病[17]。其中Ⅰ、Ⅱ和Ⅲ型血色病为常染色体隐性遗传,而Ⅳ型血色病为常染色体显性遗传。除Ⅱ型血色病外,其余类型常在40~60岁出现症状。Ⅱ型血色病因发病时间早,又称为青少年型血色病,一般在30岁之前发病,该病对两性的影响相同,性腺功能减退和心肌病是较常见的症状[18],在没有治疗的情况下,心力衰竭和(或)严重心律失常通常是死亡的原因[19]。
HH基因突变在不同种族病人中存在较大差异,欧美国家以HFE型HH为主,主要突变类型包括C282Y、H63D、S65C[20]。而国内相关文献报道相对较少,HH以非HFE型为主[21]。本例病人为HJV基因突变相关血色病(ⅡA型),所携c.962_963delinsAA(p.Cys321*)变异为HJV基因编码区发生的无义变异。与参考序列相比较,第962、963位碱基缺失,同时缺失的碱基被AA取代,导致第321号遗传密码子半胱氨酸变成终止密码子,从而使蛋白质翻译提前终止,生成截短型蛋白。经计算所截短蛋白长度大于原蛋白长度的10%。
HJV基因位于第1号染色体长臂(1q21),负责编码铁代谢相关蛋白,全长4 265 bp,包含3个内含子和4个外显子[22-23]。HJV基因突变将导致hepcidin活性下调,影响机体铁稳态的核心(Hepcidin-FPN调节轴),使铁病理性沉积而致病[24-25]。
据统计,目前已发现79种HJV基因突变型,多集中于外显子3和4。其突变类型繁多且差异较大,包含移框、错义和无义突变等,例如81G缺失导致移框突变,G320V和Q116X的复合杂合子突变导致蛋白合成提前终止[26]。其中,超过60%的突变为错义突变,无义突变少见,约占1/7。一般来讲,相较于错义突变,无义突变对生物个体的危害更大,生成的截短型蛋白缺陷明显,常导致严重的疾病表型。G320V、E302K、L101P、G336*、D149fs、G99R和R176C是欧美国家较常见的变异,其中又以G320V突变最为常见。Q312*和D249H是日本较常见的突变,R385*和A310G是非洲人群最常见的变异,而C321X、Q6H则在我国ⅡA型HH病人中多见。
HJV基因突变不一定产生表型效应。例如北京的一项研究显示,HJV-E3D变异可能需要同时伴随其他位点变异才会出现表型,因此E3D变异被预测为良性变异[27]。而且HJV基因突变具有明显的性别差异,女性相比于男性,发病迟,病情相对较轻,不容易出现血色病表型,据推测这可能与女性青春期后生理性铁损失有关[28],但也因为女性早期症状不明显,干预不及时,常致疾病进展至晚期阶段。
美国的一项研究曾对某个亚裔家庭进行HJV基因筛查[29],先证者的父母均来自中国,彼此之间无血缘关系。先证者的母亲有2处变异的杂合子,1处无义突变(962G>A和963C>A;C321X),1处信号肽突变(18G>C;Q6H),在既往的研究中,Q6H变异被预测为良性变异;先证者的父亲铁生化相关水平异常升高,存在错义突变的杂合子(842T>C;I281T);先证者的突变为以上3种突变的复合杂合子。先证者病情危重,有严重的心脏并发症,射血分数仅为20%,而先证者的母亲身体健康,体格检查及相关生化检查均未发现异常。本文病人携带HJV等位基因(p.Cys321*)纯合突变,其父母近亲结婚,疾病已进展至肝硬化阶段,病情相对较重。携带p.C321X纯合突变或者复合杂合性突变的病人病情常较重,而仅携带1个异常等位基因(p.C321X)的病人可以不发病,铁参数也正常。曾有研究预测环境因素也会促进该疾病的发生[30],但相关证据不足。
目前中国仅在少量血色病家系中发现过HJV p.C321X突变,发生率极低,有研究预测该突变可能多集中于江苏、安徽一带[31]。而本文报道的这1例病人来自于日照市五莲县,距江苏、安徽位置较近,由此,我们推测鲁南、苏、皖可能是这一基因突变的高发区,这一地区地域较广、人口稠密,鉴于许多基层医师对该病的认识不足,且基因检测技术尚未普及,可能有更多的基因突变者未被筛出。
HJV基因突变相关血色病起病隐匿,不易察觉,确诊时疾病常已进展至肝硬化阶段。针对长期的肝功能异常和不明原因肝硬化,应尽早进行肝脏穿刺病理学检查,对于提示血色病的病人,在排除继发性血色病后,应积极进行基因检测,在有条件的情况下追溯家族病例,丰富HH数据库。由于该疾病罕见,这使其诊疗和管理更加具有挑战性。为应对这种挑战,应不断积累临床病例数据,以丰富HJV基因突变谱,为HJV基因突变相关血色病的诊疗及管理提供更好的指导。
| [1] |
SANTIAGO DE SOUSA AZULAY R, MAGALHÃES M, TAVARES M D G, et al. Novel mutation in the hemojuvelin gene (HJV) in a patient with juvenile hemochromatosis pre-senting with insulin-dependent diabetes mellitus, secondary hypothyroidism and hypogonadism[J]. The American Journal of Case Reports, 2020, 21: e923108. |
| [2] |
EUROPEAN ASSOCIATION FOR THE STUDY OF THE LIVER. EASL clinical practice guidelines on haemochromatosis[J]. Journal of Hepatology, 2022, 77(2): 479-502. DOI:10.1016/j.jhep.2022.03.033 |
| [3] |
BACON B R, ADAMS P C, KOWDLEY K V, et al. Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases[J]. Hepatology, 2011, 54(1): 328-343. DOI:10.1002/hep.24330 |
| [4] |
MORENO-RISCO M B, MÉNDEZ M, MORENO-CARRALERO M I, et al. Juvenile hemochromatosis due to a homozygous variant in the HJV gene[J]. Case Reports in Pedia-trics, 2022, 2022: 7743748. |
| [5] |
郝坤艳, 汪勇, 于乐成. 《2022年欧洲肝病学会血色病临床实践指南》摘译[J]. 临床肝胆病杂志, 2022, 38(9): 1999-2004. DOI:10.3969/j.issn.1001-5256.2022.09.011 |
| [6] |
亢必勃, 秦源, 张久聪. 铁调素调控与铁代谢相关疾病研究进展[J]. 生物技术通讯, 2018, 29(3): 442-445. DOI:10.3969/j.issn.1009-0002.2018.03.025 |
| [7] |
BARDOU-JACQUET E, PHILIP J, LORHO R, et al. Liver transplantation normalizes serum hepcidin level and cures iron metabolism alterations in HFE hemochromatosis[J]. Hepato-logy, 2014, 59(3): 839-847. |
| [8] |
李妹, 安薪宇, 胡灵溪, 等. 溶血性贫血导致肝紫癜病和继发性含铁血黄素沉积症1例及文献复习[J]. 实用肝脏病杂志, 2023, 26(5): 754-756. DOI:10.3969/j.issn.1672-5069.2023.05.038 |
| [9] |
姚承杰, 刘凌, 贾长库. SEC23B基因突变引起的罕见继发性血色病一例[J]. 肝胆胰外科杂志, 2023, 35(6): 377-379, 384. |
| [10] |
李丽, 贾继东, 王宝恩. 血色病的欧美诊断治疗规范[J]. 胃肠病学和肝病学杂志, 2008, 17(1): 1-3. DOI:10.3969/j.issn.1006-5709.2008.01.001 |
| [11] |
符辉明, 伍汉文, 祝有国, 等. 中国苗族人群原发性血色病的遗传流行病学调查及HLA研究[J]. 中华内科杂志, 2001, 40(10): 28-31. |
| [12] |
董松武. 遗传性血色病的遗传机制[J]. 安徽医药, 2013, 17(9): 1600-1601. DOI:10.3969/j.issn.1009-6469.2013.09.061 |
| [13] |
KATSAROU M S, PAPASAVVA M, LATSI R, et al. Hemochromatosis: hereditary hemochromatosis and HFE gene[J]. Vitamins and Hormones, 2019, 110: 201-222. |
| [14] |
SANTOS P C, DINARDO C L, CANCADO R D, et al. Non-HFE hemochromatosis[J]. Revista Brasileira De Hematologia e Hemoterapia, 2012, 34(4): 311-316. DOI:10.5581/1516-8484.20120079 |
| [15] |
TURSHUDZHYAN A, WU D C, WU G Y. Primary non-HFE hemochromatosis: a review[J]. Journal of Clinical and Translational Hepatology, 2023, 11(4): 925-931. |
| [16] |
TANG S, BAI L, GAO Y, et al. A novel mutation of transferrin receptor 2 in a Chinese pedigree with type 3 hemochromatosis: a case report[J]. Frontiers in Genetics, 2022, 13: 836431. DOI:10.3389/fgene.2022.836431 |
| [17] |
HU J, LI Y, ZHANG L, et al. Iron overload due to SLC40A1 mutation of type 4 hereditary hemochromatosis[J]. Medical Molecular Morphology, 2023, 56(3): 233-238. DOI:10.1007/s00795-023-00359-8 |
| [18] |
RAMZAN K, IMTIAZ F, AL-ASHGAR H I, et al. Juvenile hemochromatosis and hepatocellular carcinoma in a patient with a novel mutation in the HJV gene[J]. European Journal of Medical Genetics, 2017, 60(6): 308-311. DOI:10.1016/j.ejmg.2017.03.011 |
| [19] |
ALEXANDER J, KOWDLEY K V. Hereditary hemochromatosis: genetics, pathogenesis, and clinical management[J]. Annals of Hepatology, 2005, 4(4): 240-247. DOI:10.1016/S1665-2681(19)32046-0 |
| [20] |
LV T X, LI X J, ZHANG W, et al. Recent advance in the molecular genetics of Wilson disease and hereditary hemochromatosis[J]. European Journal of Medical Genetics, 2016, 59(10): 532-539. DOI:10.1016/j.ejmg.2016.08.011 |
| [21] |
吕婷霞, 张伟, 李潇瑾, 等. 我国人群遗传性血色病基因突变特点分析[J]. 临床肝胆病杂志, 2016, 32(8): 1571-1574. DOI:10.3969/j.issn.1001-5256.2016.08.028 |
| [22] |
KONG X M, XIE L D, ZHU H Q, et al. Genotypic and phenotypic spectra of hemojuvelin mutations in primary hemochromatosis patients: a systematic review[J]. Orphanet journal of rare diseases, 2019, 14(1): 171. DOI:10.1186/s13023-019-1097-2 |
| [23] |
CELEC P. Hemojuvelin: a supposed role in iron metabolism one year after its discovery[J]. Journal of Molecular Medicine, 2005, 83(7): 521-525. |
| [24] |
CAMASCHELLA C. Iron and hepcidin: a story of recycling and balance[J]. Hematology American Society of Hematology Education Program, 2013, 2013: 1-8. |
| [25] |
孙磊, 王鹏, 张亮, 等. 血色病肝脏铁沉积的病理特点分析[J]. 中华肝脏病杂志, 2015, 23(6): 443-448. |
| [26] |
张子彦, 徐志松. 血幼素研究进展[J]. 国际内科学杂志, 2007(5): 309-311. |
| [27] |
张伟, 吕婷霞, 李艳萌, 等. 3个携带HJV E3D变异的遗传性血色病家系临床表型分析[J]. 肝脏, 2017, 22(7): 585-589. |
| [28] |
范振平, 石红霞, 张文瑾, 等. 1991-2010年国内血色病荟萃分析[J]. 临床荟萃, 2011, 26(24): 2132-2136. |
| [29] |
HUANG F W, RUBIO-ALIAGA I, KUSHNER J P, et al. Identification of a novel mutation (C321X) in HJV[J]. Blood, 2004, 104(7): 2176-2177. |
| [30] |
LI S F, XUE J, CHEN B J, et al. Two middle-age-onset hemochromatosis patients with heterozygous mutations in the hemojuvelin gene in a Chinese family[J]. International Journal of Hematology, 2014, 99(4): 487-492. |
| [31] |
李元丰, 张红星, 张海涛, 等. 一个中国遗传性血色病家系致病基因的突变分析[J]. 遗传, 2014, 36(11): 1152-1158. |
 2024, Vol. 60
2024, Vol. 60

