2. 青岛市第三人民医院骨科;
3. 青岛大学基础医学院免疫学系
骨肉瘤(OS)是儿童和青少年最常见的原发性恶性骨肿瘤,占原发性恶性骨肿瘤的50%[1]。OS目前的治疗手段主要是手术联合化疗,尽管化疗极大地改善了OS病人的预后,但由于化疗耐药的出现,导致OS生存率有所下降,所以迫切需要寻找新的靶点以提高OS病人的生存率[3]。叉头盒M1(FOXM1)是FOX家族的重要成员之一,是一种与细胞增殖相关的转录因子[4]。有研究表明,FOXM1在OS中高表达并且与病人的生存率呈负相关,FOXM1可能是治疗OS的潜在靶点[5-6]。细胞凋亡和自噬是两种不同类型的程序性细胞死亡途径,通常作为肿瘤抑制机制发挥抗肿瘤作用[7]。研究表明,FOXM1与肿瘤细胞凋亡和自噬密切相关[8]。然而,在OS中FOXM1与凋亡和自噬的调控关系尚不清楚。透明质酸介导的运动受体(HMMR)是细胞外基质成分透明质酸的受体,是一种细胞内微管相关的纺锤体组装因子,参与了肿瘤细胞的增殖、侵袭、迁移、凋亡和自噬[9-11]。但在OS中,FOXM1与HMMR之间的调控关系仍不清楚。因此,本研究旨在探讨FOXM1靶向HMMR对OS细胞凋亡和自噬的影响。
1 材料与方法 1.1 细胞培养本实验所用OS细胞U-2OS和正常成骨细胞hFOB1.19购自武汉普诺赛生命科技有限公司。两种细胞均使用DMEM高糖培养液(BI,以色列)进行培养,并在培养液中添加体积分数0.10的胎牛血清(BI,以色列)和体积分数0.01的青-链霉素混合液(索莱宝,北京)。两种细胞置于含体积分数0.05 CO2、37 ℃恒温的湿润培养箱中培养。使用含已二酸四乙胺的胰蛋白酶消化液(赛维尔,武汉)消化贴壁细胞。
1.2 细胞转染将U-2OS细胞接种至24孔板中,每孔5×104个细胞,将孔板置于含CO2培养箱中培养12 h。按照感染复数=10计算每孔中所需的慢病毒体积,分别向孔板中加入相应的慢病毒(吉凯基因,上海)。将转染空载慢病毒的细胞作为对照组,转染sh-FOXM1慢病毒的细胞作为敲低FOXM1组,转染sh-FOXM1慢病毒和OE-HMMR慢病毒的细胞作为过表达HMMR组。将孔板置于培养箱中继续培养12 h后,更换新鲜培养液,每孔500 μL。继续培养72 h后,对细胞进行传代并采用Western blot方法检测蛋白表达水平。
1.3 Western blot检测蛋白表达取生长状态良好的U-2OS细胞,使用细胞刮刀将细胞从培养皿的底部刮下,收获细胞悬液。以2 000 r/min离心后弃上清,加入RIPA裂解液(索莱宝,北京)和蛋白酶抑制剂(酷莱搏,北京)冲悬沉淀,冰上裂解30 min。4 ℃下以12 000 r/min离心15 min,上清液即为总蛋白。向提取的蛋白中加入loading buffer(索莱宝,北京),沸水煮5 min。取50 μg蛋白在SDS-PAGE凝胶中进行电泳,然后将凝胶中的蛋白分子转移至聚偏二氟乙烯膜(Sigma,美国)上,再使用无蛋白快速封闭液(雅酶,上海)封闭15 min。在4 ℃下,与FOXM1(1∶1 000,CST,美国)、LC3 Ⅰ/Ⅱ(1∶1 000,CST,美国)、HMMR(1∶1 000,Abcolon,武汉)、Cleaved-Caspase3(1∶1 000,Affnity Biosciences,中国)、Bax(1∶2 000,华安生物,杭州)、β-actin(1∶2 000,赛维尔,武汉)一抗一起孵育过夜。然后加入二抗(1∶10 000,Absin,中国)在室温下孵育1.5 h。使用超敏型化学发光液(翌圣,上海)对条带进行显影。使用Iamge J软件分析条带的灰度值,计算目的蛋白的相对表达量。
1.4 流式细胞术检测细胞凋亡在流式细胞仪(ACEA Biosciences)上使用AnnexinⅤ-PE/7-AAD凋亡试剂盒(诺唯赞,南京)检测细胞凋亡,根据试剂盒的说明进行操作。
1.5 统计学分析采用Graphpad 8.0.2软件进行统计学分析。符合正态分布的计量资料以x±s形式表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果 2.1 FOXM1在OS细胞中的表达Western blot方法检测结果显示,U-2OS细胞FOXM1的表达明显高于hFOB1.19细胞,差异具有统计学意义(t=38.780,P<0.005)。与对照组相比,敲低FOXM1组U-2OS细胞中FOXM1蛋白表达明显降低,差异具有统计学意义(t=17.800,P<0.005)。见图 1。
 |
| A:hFOB1.19和U-2OS细胞中FOXM1蛋白表达检测;B:对照组和敲低FOXM1组U-2OS细胞中FOXM1蛋白表达检测。sh-NC为对照组,sh-FOXM1为敲低FOXM1组,n=3,***P<0.005。 图 1 FOXM1蛋白表达的Western blot检测 |
与对照组相比较,敲低FOXM1组细胞的凋亡率明显增加(t=3.517,P<0.05),凋亡相关蛋白Cleaved-Caspase3和Bax的表达水平明显升高(t=3.155、6.334,P<0.05)。表明敲低FOXM1可以促进OS细胞凋亡。见图 2、3。
 |
| sh-NC为对照组,sh-FOXM1为敲低FOXM1组,n=3,*P<0.05。 图 2 流式细胞术检测两组U-2OS细胞的凋亡率 |
 |
| sh-NC为对照组,sh-FOXM1为敲低FOXM1组,C-Caspase3为Cleaved-Caspase3,n=3,*P<0.05,**P<0.01。 图 3 Western blot检测两组U-2OS细胞中Cleaved-Caspase3和Bax蛋白的表达 |
Western blot检测结果显示,与对照组相比,敲低FOXM1组U-2OS细胞中LC3 Ⅰ/Ⅱ蛋白表达降低,差异具有统计学意义(t=5.032,P<0.01)。表明敲低FOXM1可以抑制OS细胞自噬。见图 4。
 |
| sh-NC为对照组,sh-FOXM1为敲低FOXM1组,n=3,**P<0.01。 图 4 Western blot检测两组U-2OS细胞中LC3 Ⅰ/Ⅱ蛋白的表达 |
与对照组相比,敲低FOXM1组中HMMR蛋白的表达降低,差异具有统计学意义(t=3.763,P<0.05)。表明FOXM1可以正向调控HMMR蛋白的表达。见图 5。
 |
| sh-NC为对照组,sh-FOXM1为敲低FOXM1组,n=3,*P<0.05。 图 5 Western blot检测两组U-2OS细胞中HMMR蛋白的表达 |
Western blot检测结果显示,与对照组相比,过表达HMMR组U-2OS细胞中FOXM1蛋白表达明显下降,HMMR蛋白表达明显升高,差异具有统计学意义(t=10.000、7.803,P<0.01)。见图 6。流式细胞术检测结果显示,与敲低FOXM1组相比,过表达HMMR组细胞凋亡率降低,差异具有统计学意义(F=31.00,P<0.05)。见图 7。Western blot检测结果显示,与敲低FOXM1组相比较,过表达HMMR组LC3 Ⅰ/Ⅱ蛋白表达增加,差异具有统计学意义(F=160.20,P<0.005)。见图 8。以上结果表明,FOXM1可以通过调控HMMR的表达进而影响OS细胞的凋亡和自噬。
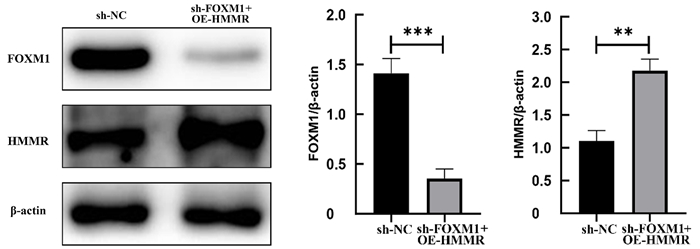 |
| sh-NC为对照组,sh-FOXM1+OE-HMMR为过表达HMMR组,n=3,**P<0.01,***P<0.005。 图 6 Western blot检测两组U-2OS细胞中FOXM1和HMMR蛋白的表达 |
 |
| sh-NC为对照组,sh-FOXM1为敲低FOXM1组,sh-FOXM1+OE-HMMR为过表达HMMR组,n=3,*P<0.05,***P<0.005。 图 7 流式细胞术检测各组U-2OS细胞的凋亡率 |
 |
| sh-NC为对照组,sh-FOXM1为敲低FOXM1组,sh-FOXM1+OE-HMMR为过表达HMMR组,n=3,***P<0.005。 图 8 Western blot检测各组U-2OS细胞中LC3Ⅰ/Ⅱ蛋白的表达 |
目前,辅助化疗加手术切除肿瘤的治疗方案提高了OS的生存率,但是转移、复发以及肿瘤耐药性的出现,导致OS病人预后不佳,严重影响病人的生存[12],所以迫切需要寻找新的治疗手段解决这些难题。分子靶向治疗已经在多种癌症中发挥出显著抗癌作用,这也为OS的治疗提供了方向[13]。OS为一种高度异质性的肿瘤,由于缺乏特定的肿瘤突变基因,所以目前开发OS靶向治疗面临着缺乏有效靶点的问题[14]。
研究表明,FOX家族的成员与肿瘤进展密切相关[15]。FOXM1在多种癌症中被检测到高表达,此外,泛癌分析也发现FOXM1是与癌症预后不良高度相关的基因[16-19]。最近研究表明,FOXM1被认为是癌症治疗有希望的治疗靶点[20]。在肝癌中,FOXM1影响肝癌细胞的增殖和细胞周期进程,并且这种作用与驱动蛋白家族成员4A(KIF4A)的表达有关[5]。在食管鳞状细胞癌中,FOXM1可通过调控细胞分裂蛋白6(CDC6)的表达影响癌细胞增殖[21]。在膀胱癌中,FOXM1通过与无名指蛋白26(RNF26)的启动子结合,激活RNF26的转录表达,从而增加膀胱癌细胞的增殖和侵袭能力[22]。在OS中,FOXM1已被证明可以促进OS细胞的增殖、迁移和侵袭[23]。但是,关于FOXM1是否对OS细胞凋亡和自噬具有调控作用以及调控机制尚不清楚。
细胞凋亡是细胞程序性死亡的形式之一,其目的是为了维持细胞稳态和去除有害的细胞[24]。在癌症中,细胞凋亡作为一种肿瘤抑制机制发挥着重要的抗癌作用[25]。细胞凋亡分为内在性和外源性死亡两种途径,在内源性死亡途径中最常见的是线粒体外膜通透化,线粒体在促凋亡Bcl-2家族成员如Bax的正向调节下释放细胞色素C,细胞色素C与凋亡蛋白酶激活因子1(APAF1)结合形成凋亡小体,最终激活Caspase3引发细胞凋亡[26]。有研究发现,敲低FOXM1可以通过激活Caspase3和促进Bax的表达导致细胞发生凋亡[27]。本研究结果显示,敲低FOXM1后,Cleaved-Caspase3和Bax蛋白的表达增加,OS细胞发生凋亡。
研究发现,FOXM1不仅可以调控肿瘤细胞发生凋亡,还可以调控肿瘤细胞发生自噬[28-29]。自噬与细胞凋亡不同,它通过降解和清除细胞内错误折叠的蛋白质和受损的细胞器来促进细胞死亡[30]。自噬小体形成是发生自噬的重要标志。在发生自噬过程中,LC3首先在胞质中生成LC3 Ⅰ,然后通过与脂质磷脂酰乙醇胺结合形成膜修饰蛋白LC3 Ⅱ, LC3 Ⅱ的存在被认为是自噬小体形成的标志[31]。本研究采用Western blot方法检测了自噬蛋白LC3 Ⅰ/Ⅱ的表达,结果显示,敲低FOXM1后,OS细胞中LC3 Ⅰ/Ⅱ蛋白的表达下降,自噬被抑制。
本文进一步的研究结果显示,敲低FOXM1后OS细胞中HMMR蛋白的表达下调。有研究表明,HMMR可以促进肿瘤的恶性进展[32]。有研究发现,HMMR过表达可以抑制肺癌细胞和乳癌细胞的凋亡[33]。RAHMAN等[34]研究发现,空泡蛋白分选相关蛋白35(VPS35)可以诱导神经母细胞瘤发生自噬,HMMR敲低则挽救了VPS35敲低导致的自噬抑制。本研究结果显示,过表达HMMR抑制了敲低FOXM1导致的细胞凋亡增加和自噬抑制,提示FOXM1可能通过调控HMMR蛋白的表达从而影响OS细胞的凋亡和自噬。
综上所述,FOXM1在OS细胞中高表达,敲低FOXM1通过降低HMMR蛋白的表达促进OS细胞的凋亡和抑制OS细胞自噬,但是FOXM1调控HMMR的具体机制还有待进一步研究。FOXM1可能成为治疗OS的新型治疗靶点。
| [1] |
DUONG L M, RICHARDSON L C. Descriptive epidemiology of malignant primary osteosarcoma using population-based registries, United States, 1999—2008[J]. Journal of Registry Management, 2013, 40(2): 59-64. |
| [2] |
BIERMANN J S, CHOW W, REED D R, et al. NCCN guidelines insights: bone cancer, version 2.2017[J]. Journal of the National Comprehensive Cancer Network, 2017, 15(2): 155-167. DOI:10.6004/jnccn.2017.0017 |
| [3] |
REED D R, HAYASHI M, WAGNER L, et al. Treatment pathway of bone sarcoma in children, adolescents, and young adults[J]. Cancer, 2017, 123(12): 2206-2218. DOI:10.1002/cncr.30589 |
| [4] |
LIAO G B, LI X Z, ZENG S, et al. Regulation of the master regulator FOXM1 in cancer[J]. Cell Communication and Signaling, 2018, 16(1): 57. DOI:10.1186/s12964-018-0266-6 |
| [5] |
HU G H, YAN Z W, ZHANG C, et al. FOXM1 promotes hepatocellular carcinoma progression by regulating KIF4A expression[J]. Journal of Experimental & Clinical Cancer Research, 2019, 38(1): 188. |
| [6] |
LIANG S K, HSU C C, SONG H L, et al. FOXM1 is required for small cell lung cancer tumorigenesis and associated with poor clinical prognosis[J]. Oncogene, 2021, 40(30): 4847-4858. DOI:10.1038/s41388-021-01895-2 |
| [7] |
D'ARCY M S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy[J]. Cell Biology International, 2019, 43(6): 582-592. DOI:10.1002/cbin.11137 |
| [8] |
YU W, CUI X F, WAN Z Y, et al. Silencing forkhead box M1 promotes apoptosis and autophagy through SIRT7/mTOR/IGF2 pathway in gastric cancer cells[J]. Journal of Cellular Biochemistry, 2018, 119(11): 9090-9098. DOI:10.1002/jcb.27168 |
| [9] |
HE Z C, MEI L, CONNELL M, et al. Hyaluronan mediated motility receptor (HMMR) encodes an evolutionarily conserved homeostasis, mitosis, and meiosis regulator rather than a hyaluronan receptor[J]. Cells, 2020, 9(4): 819. DOI:10.3390/cells9040819 |
| [10] |
MA X D, XIE M, XUE Z Q, et al. HMMR associates with immune infiltrates and acts as a prognostic biomaker in lung adenocarcinoma[J]. Computers in Biology and Medicine, 2022, 151(Pt A): 106213. |
| [11] |
WANG Q H, WU G M, FU L H, et al. Tumor-promoting roles of HMMR in lung adenocarcinoma[J]. Mutation Research, 2023, 826: 111811. DOI:10.1016/j.mrfmmm.2022.111811 |
| [12] |
SONG X J, BI M C, ZHU Q S, et al. The emerging role of lncRNAs in the regulation of osteosarcoma stem cells[J]. European Review for Medical and Pharmacological Sciences, 2022, 26(3): 966-974. |
| [13] |
SANKAR K, GADGEEL S M, QIN A. Molecular therapeutic targets in non-small cell lung cancer[J]. Expert Review of Anticancer Therapy, 2020, 20(8): 647-661. DOI:10.1080/14737140.2020.1787156 |
| [14] |
CORRE I, VERRECCHIA F, CRENN V, et al. The osteosarcoma microenvironment: a complex but targetable ecosystem[J]. Cells, 2020, 9(4): 976. DOI:10.3390/cells9040976 |
| [15] |
KATOH M, KATOH M. Human FOX gene family (Review)[J]. International Journal of Oncology, 2004, 25(5): 1495-1500. |
| [16] |
KOPANJA D, CHAND V, O'BRIEN E, et al. Transcriptional repression by FoxM1 suppresses tumor differentiation and promotes metastasis of breast cancer[J]. Cancer Research, 2022, 82(13): 2458-2471. DOI:10.1158/0008-5472.CAN-22-0410 |
| [17] |
GENTLES A J, NEWMAN A M, LIU C L, et al. The prognostic landscape of genes and infiltrating immune cells across human cancers[J]. Nature Medicine, 2015, 21(8): 938-945. DOI:10.1038/nm.3909 |
| [18] |
MADHI H, LEE J S, CHOI Y E, et al. FOXM1 inhibition enhances the therapeutic outcome of lung cancer immunotherapy by modulating PD-L1 expression and cell proliferation[J]. Advanced Science, 2022, 9(29): e2202702. DOI:10.1002/advs.202202702 |
| [19] |
HAMURCU Z, KAHRAMAN N, ASHOUR A, et al. FOXM1 transcriptionally regulates expression of integrin β1 in triple-negative breast cancer[J]. Breast Cancer Research and Treatment, 2017, 163(3): 485-493. DOI:10.1007/s10549-017-4207-7 |
| [20] |
KALINICHENKO V V, KALIN T V. Is there potential to target FOXM1 for 'undruggable' lung cancers?[J]. Expert Opinion on Therapeutic Targets, 2015, 19(7): 865-867. DOI:10.1517/14728222.2015.1042366 |
| [21] |
CHEN X F, CHEN J B, YU X B, et al. FOXM1 promotes malignant proliferation of esophageal squamous cell carcinoma through transcriptional activating CDC6[J]. DNA and Cell Biology, 2022, 41(7): 671-682. DOI:10.1089/dna.2022.0169 |
| [22] |
YI L, WANG H H, LI W, et al. The FOXM1/RNF26/p57 axis regulates the cell cycle to promote the aggressiveness of bladder cancer[J]. Cell Death & Disease, 2021, 12(10): 944. |
| [23] |
ZHU X, LU K Y, CAO L Y, et al. FoxM1 is upregulated in osteosarcoma and inhibition of FoxM1 decreases osteosarcoma cell proliferation, migration, and invasion[J]. Cancer Management and Research, 2020, 12: 9857-9867. DOI:10.2147/CMAR.S270825 |
| [24] |
MORANA O, WOOD W, GREGORY C D. The apoptosis paradox in cancer[J]. International Journal of Molecular Sciences, 2022, 23(3): 1328. DOI:10.3390/ijms23031328 |
| [25] |
SCHULZE-BERGKAMEN H, WEINMANN A, MOEHLER M, et al. Novel ways to sensitise gastrointestinal cancer to apoptosis[J]. Gut, 2009, 58(7): 1010-1024. DOI:10.1136/gut.2008.164350 |
| [26] |
CARNEIRO B A, EL-DEIRY W S. Targeting apoptosis in cancer therapy[J]. Nature Reviews Clinical Oncology, 2020, 17(7): 395-417. DOI:10.1038/s41571-020-0341-y |
| [27] |
QIN Q, CHEN H, XU H Z, et al. FoxM1 knockdown enhanced radiosensitivity of esophageal cancer by inducing apoptosis[J]. Journal of Cancer, 2023, 14(3): 454-463. DOI:10.7150/jca.76671 |
| [28] |
LYU X, ZENG L Z, SHI J, et al. Essential role for STAT3/FOXM1/ATG7 signaling-dependent autophagy in resistance to Icotinib[J]. Journal of Experimental & Clinical Cancer Research, 2022, 41(1): 200. |
| [29] |
LIN J Z, WANG W W, HU T T, et al. FOXM1 contributes to docetaxel resistance in castration-resistant prostate cancer by inducing AMPK/mTOR-mediated autophagy[J]. Cancer Letters, 2020, 469: 481-489. DOI:10.1016/j.canlet.2019.11.014 |
| [30] |
DAS S, SHUKLA N, SINGH S S, et al. Mechanism of interaction between autophagy and apoptosis in cancer[J]. Apoptosis, 2021, 26(9): 512-533. |
| [31] |
LI X H, HE S K, MA B Y. Autophagy and autophagy-related proteins in cancer[J]. Molecular Cancer, 2020, 19(1): 12. DOI:10.1186/s12943-020-1138-4 |
| [32] |
SHI J G, CHEN Y Q, WANG Z S, et al. Comprehensive bioinformatics analysis to identify the gene HMMR associated with lung adenocarcinoma prognosis and its mechanism of action in multiple cancers[J]. Frontiers in Oncology, 2021, 11: 712795. DOI:10.3389/fonc.2021.712795 |
| [33] |
PENG Y, CUI J H, MA K W, et al. Hsa_circ_0005273 acts as a sponge of miR-509-3p to promote the malignant behaviors of breast cancer by regulating HMMR expression[J]. Thoracic Cancer, 2023, 14(9): 794-804. DOI:10.1111/1759-7714.14809 |
| [34] |
RAHMAN A A, SOTO-AVELLANEDA A, YONG JIN H, et al. Enhanced hyaluronan signaling and autophagy dysfunction by VPS35 D620N[J]. Neuroscience, 2020, 441: 33-45. DOI:10.1016/j.neuroscience.2020.06.009 |
 2024, Vol. 60
2024, Vol. 60

