阿尔茨海默病(AD)是一种常见的神经退行性疾病,是痴呆症的主要原因。据世界卫生组织发布的报告,到2050年痴呆症的患病率将在全球范围内翻3倍,将成为本世纪最昂贵、最致命和负担最重的疾病之一[1]。AD的病理特征主要包括由异常过度磷酸化的Tau蛋白形成的细胞内神经原纤维缠结和以β-淀粉样蛋白(Aβ)为主要成分的细胞外神经炎性包块[2]。但是,迄今为止,该病的发病机制并未被完全阐明。目前已知内质网应激(ER)在AD发病的过程中起着至关重要的作用,而激活转录因子6(ATF-6)是ER的关键传感器[3]。既往研究表明,ATF-6蛋白表达增加可通过自噬诱导神经保护作用,利于AD小鼠记忆的恢复[4]。AA147是一种内质网蛋白稳态调节剂,可通过选择性激活未折叠蛋白反应ATF-6的臂对神经元细胞氧化损伤起到保护作用。目前尚未有研究揭示能否通过AA147激活ATF-6从而对AD起到保护作用。本研究通过构建Aβ1-42诱导的AD细胞模型,探讨激活ATF-6对AD的保护作用,从而为开发有效的AD治疗策略提供实验依据。
1 材料与方法 1.1 实验材料 1.1.1 实验动物孕17~19 d的健康成年雌性SD大鼠,由济南朋悦实验动物繁育有限公司提供,饲养于青岛大学医学部实验动物中心。本实验经青岛大学动物伦理委员会批准。
1.1.2 实验试剂AA147粉末购自美国MCE公司,将AA147粉末5 mg溶于1.9 mL的二甲基亚砜(DMSO)溶液中制备10 mmol/L的母液;ATF-6抗体、Neurobasl Medium培养液购自Abcam抗体公司;Akt与p-Akt抗体购自CST公司;Map2抗体、多聚赖氨酸(PDL)、DMSO、六氟异丙醇(HFIP)购自sigma公司;β-actin、兔二抗、鼠二抗购自武汉三鹰生物技术公司;羊抗鼠IgG-AlexaFluor-488、羊抗兔IgG-AlexaFluor-555、增强型CCK-8试剂盒购自北京博奥森生物技术有限公司;Aβ1-42购自上海吉尔生化有限公司;B-27 supplement(50×)、青霉素-链霉素(100×)、2.5 g/L胰蛋白酶溶液、胎牛血清、谷氨酰胺Glutamax均购自Gibico公司;磷酸盐缓冲液、D-Hanks溶液、DMEM高糖培养液均购自北京索莱宝科技有限公司;ECL发光液购自美国Milipore公司。
1.2 实验方法 1.2.1 原代神经元的培养选择1只孕17~19 d的SD大鼠,引颈处死,在无菌环境中取出胎鼠并将其置于提前准备好的无菌培养皿中,显微镜下剥离胎鼠大脑皮质,置于含DMEM高糖培养液的离心管中,全部剥离结束后,将离心管置于离心机中,以1 000 r/min离心5 min,取出离心管,弃掉上清,保留管底的脑组织,每管加入0.5 g/L的胰蛋白酶溶液1.5 mL,吹打均匀后置于37 ℃的细胞培养箱消化25 min,消化结束后,按照1∶1的比例加入含体积分数0.10胎牛血清的DMEM细胞培养液终止消化。混合液经0.2 μm的无菌过滤器过滤,置于离心管中,然后以1 000 r/min离心10 min,弃掉上清及未消化的团块,加入神经元培养液,反复吹打,待细胞均匀悬浮后进行计数。最后将细胞接种于提前6 h用稀释的PDL包被过的6孔板中培养,1 d后全换液,后每3 d半量换液1次,培养至第13天,用于后续实验。神经元培养液按照Neurobasl Me-dium∶B-27 supplement(50×)∶青霉素-链霉素双抗(100×)∶谷氨酰胺Glutamax(100×)=100∶2∶1∶1的比例配制。
1.2.2 AD细胞模型的制备① Aβ1-42寡聚体制备:取1 mg Aβ1-42单体粉末和六氟异丙醇(HFIP)置于冰上预冷,向装有1 mg Aβ1-42单体粉末的EP管中加入HFIP 222 μL,密封,涡旋混匀,室温孵育60 min,直到液体澄清,即可得到1 mmol/L的Aβ-HFIP溶液。再将Aβ-HFIP溶液放回冰上5 min。取4只无菌EP管,分装Aβ-HFIP溶液各55 μL,在通风橱中挥干HFIP,得到无色透明Aβ肽膜,置于-20 ℃冰箱保存。使用前取一支分装好的EP管,在冰盒上进行操作,加入DMSO 11 μL,水浴超声(300 W,35 Hz)处理10 min,然后加入PBS溶液539 μL,涡旋混匀,将其置于4 ℃冰箱孵育1 d。孵育结束之后,将EP管置于离心机中,在4 ℃条件下以1 000 r/min离心10 min,取上清液,即可得到100 μmol/L的Aβ寡聚体[5]。②AD细胞模型制备:将2 μmol/L的Aβ1-42寡聚体加入神经元培养液中诱导24 h,即可得到AD细胞模型。
1.2.3 实验分组及处理以培养至13 d的神经元作为实验对象,选取6孔板中神经元密度、状态相似的4个孔的神经元,随机分为对照组(A组)、Aβ1- 42处理组(B组)、Aβ1-42+DMSO组(C组)、Aβ1- 42+AA147组(D组)。对照组加入10 μmol/L的DMSO溶液处理神经元12 h;Aβ1-42组加入2 μmol/L Aβ1-42寡聚体诱导皮质神经元24 h;Aβ1-42+DMSO组先加入10 μmol/L的DMSO预处理神经元12 h,后继续加入2 μmol/L Aβ1-42寡聚体诱导皮质神经元24 h;Aβ1-42+AA147组先加入10 μmol/L的AA147预处理皮质神经元12 h,后继续加入2 μmol/L的Aβ1-42寡聚体诱导皮质神经元24 h。
1.2.4 CCK-8比色法检测皮质神经元存活率将各组神经元处理后,更换新的神经元培养液,加入CCK-8试剂(每100 μL神经元培养液加入CCK-8试剂10 μL),在37 ℃培养箱中避光孵育4 h,用酶标仪检测450 nm处的吸光度(A)值,计算细胞活力,以其表示神经元存活率。细胞活力(%)=(处理组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.2.5 免疫荧光染色检测神经元存活将装有爬片的24孔培养板中的神经元培养至13 d时,按照1.2.3方法分组及处理后,用PBS溶液在水平摇床上洗5 min;然后每孔加入40 g/L的组织固定液1 mL固定20 min,再用PBS洗3次,每次10 min;其后以含体积分数0.003的Triton-100溶液破膜10 min,以5 g/L牛血清清蛋白封闭液封闭1 h,加入神经元细胞骨架特异性标记蛋白Map-2抗体(1∶500)4 ℃孵育过夜;然后用PBS洗3次,每次10 min;加二抗山羊抗体IgG抗体(1∶500)在室温下避光孵育1 h;用PBS洗3次,每次10 min,最后用含DAPI染料的抗荧光衰减封片剂封片。荧光显微镜下采集图像,观察神经元的形态及数量,确定神经元的存活情况。
1.2.6 Western blot方法检测ATF-6、p-Akt蛋白的表达将4组细胞经相应处理后,弃掉每个孔中的细胞培养液,用PBS溶液清洗3次,每次5 min;然后加入蛋白提取裂解液,消化裂解10 min;应用200 μL的移液枪枪头均匀地将贴在孔板底部的细胞刮下来置于EP管中,4 ℃下以12 000 r/min离心15 min,取上清液置于另一EP管中。采用BCA法测定蛋白浓度,用裂解液和上样缓冲液配平,在100 ℃金属浴锅中变性10 min,冷却后分装-80 ℃保存。配制100 g/L的10孔SDS聚丙烯酰胺凝胶,每孔取15 μg蛋白样品上样,SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)以300 mA、90 min转印至硝酸纤维素(PVDF)膜上,膜用含有50 g/L脱脂奶粉的TBST溶液室温封闭2 h;加一抗ATF-6(1∶1 000)、Akt(1∶2 000)、p-Akt(1∶2 000)、β-actin(1∶4 000),4 ℃孵育过夜;次日以TBST溶液洗涤3次,每次10 min;再加入相应二抗室温孵育1 h,以TBST溶液重复洗涤3次;用ECL发光液显影。以β-actin为内参,Image J软件分析蛋白条带灰度值,以目的蛋白的灰度值/内参蛋白的灰度值表示目的蛋白相对表达量。
1.3 统计学处理应用GraphPad Prism 9.0软件进行统计学分析。计量资料数据以x ± s表示,多组数据比较采用单因素方差分析(ANOVA),两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组神经元存活率比较CCK-8检测显示,各组神经元存活率差异有统计学意义(F=47.42,P < 0.01),其中Aβ1-42组细胞存活率较对照组明显降低(t=9.42,P < 0.05),Aβ1-42+AA147组细胞存活率较Aβ1-42组升高(t=5.73,P < 0.05),Aβ1-42+DMSO组细胞存活率与Aβ1-42组比较差异无统计学意义(P>0.05)。见表 1。免疫荧光染色结果进一步证实,与对照组相比,Aβ1-42组神经元的存活数量降低,Aβ1-42+AA147组较Aβ1-42组神经元的存活数量显著增多,Aβ1-42+DMSO组神经元的数量与Aβ1-42组比较无明显差异(图 1)。AA147处理提高了Aβ1-42损伤后神经元存活数量。
| 表 1 各组神经元存活率、ATF-6及p-Akt蛋白表达比较(x ± s) |
|
|
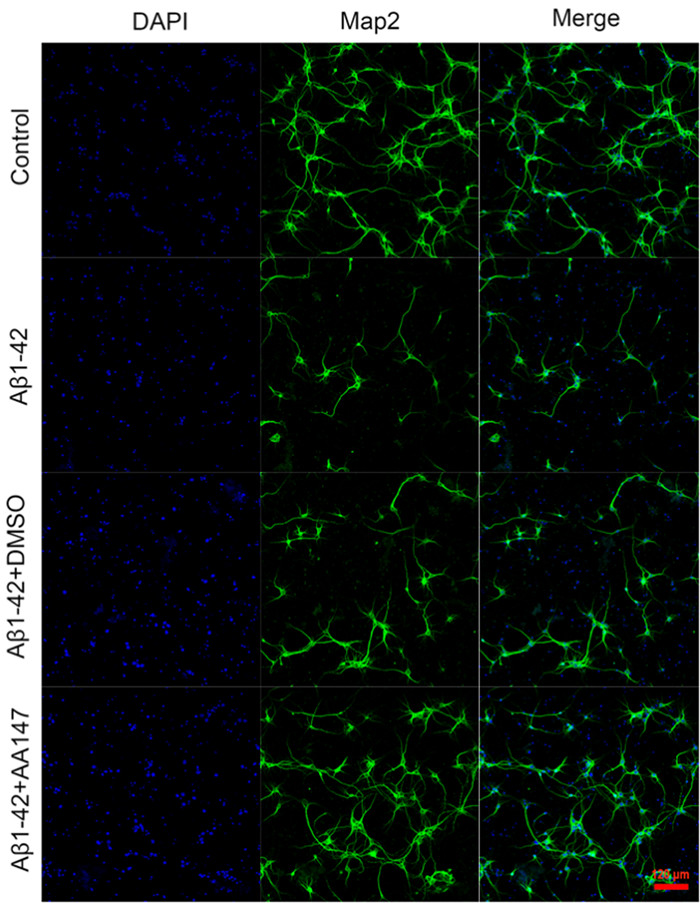 |
| DAPI:细胞核标记;Map2:神经元细胞骨架特异性标记物;Merge:细胞核与神经元细胞骨架合并。标尺为120 μm。 图 1 各组神经元免疫荧光染色观察 |
Western blot检测显示,各组ER相关通路蛋白ATF-6及其下游信号蛋白p-Akt表达差异有统计学意义(F=11.77、26.10,P < 0.05)。其中Aβ1-42组ATF-6及p-Akt蛋白表达明显低于对照组,Aβ1-42+AA147组高于Aβ1-42组,差异有统计学意义(P < 0.05);Aβ1-42+DMSO组ATF-6及p-Akt蛋白表达与Aβ1-42组比较差异无显著性(P>0.05)。见图 2、表 1。
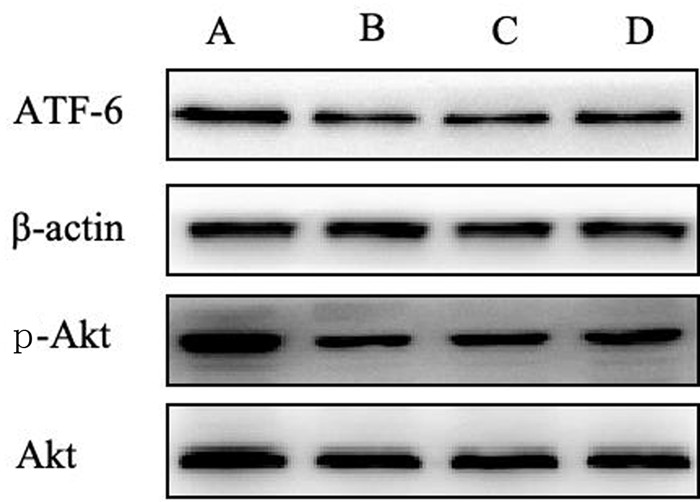 |
| A:对照组;B:Aβ1-42组;C:Aβ1-42+DMSO组;D:Aβ1-42+AA147组。 图 2 各组神经元中ATF-6及p-Akt表达的Western blot检测 |
控制神经元功能和存活的信号通路异常是引起包括AD和帕金森病(PD)在内的神经退行性疾病的重要机制[6-7]。从理论上讲,人类大脑神经元可以存活100年并且能够执行正常的生理功能,但是在实际中代谢缺陷、氧化应激、大脑损伤等原因会诱导大脑中神经元损伤、退化和丢失。AD是一种进行性神经退行性疾病,在老年人口中的患病率不断上升,其主要症状为不可逆性的近期记忆丧失、认知功能障碍和行为功能的逐渐下降。由Aβ异常沉积形成的细胞外神经炎性斑块是AD重要的病理机制之一[8-10]。相关研究结果表明,在AD病人中,当Aβ的转运与清除发生障碍时,会诱发ER反应,引起神经元的凋亡; 而适应性上调未折叠蛋白反应(UPR)信号可以逆转ER的应激并且恢复ER稳态,从而防止AD中神经细胞的丢失[3]。因此,激活UPR信号通路可能对减轻AD病人的神经元丢失具有重要的意义。
UPR信号主要由IRE1、ATF-6和PERK为主导的3个信号通路组成,当其中任一通路被激活,这些蛋白质就会启动转录和翻译信号以减轻ER的压力、减少细胞的死亡[6]。有研究表明,当UPR信号中ATF-6蛋白表达下降时,将导致神经退行性疾病、蛋白质错误折叠疾病、糖尿病、缺血性疾病和癌症[12-18],提示建立选择性调节ATF-6信号可能改善与该信号失衡相关的疾病。此外,在缺血性脑卒中,在脑缺血发生前激活ATF-6信号可能对脑缺血再灌注损伤具有一定的保护作用[19]。有研究表明,与正常人相比,AD病人的大脑中ATF-6蛋白表达水平明显降低[4]。提示激活UPR信号通路中ATF-6信号可能会对AD起到神经保护作用。AA147为一种小分子化合物,为ATF-6的靶向药物激活剂,其可通过选择性激活UPR信号中ATF-6信号来增强内质网蛋白稳态,减少不稳定且易于聚集的蛋白质的分泌[20]。有研究表明,AA147可以通过上调ATF-6蛋白表达对心肌梗死、心脏骤停起到一定的保护作用[19, 21-22];在心肌缺血再灌注损伤中,ATF-6/p-Akt信号通路的激活对神经细胞起着关键的保护作用[23-24]。推测AA147可能通过激活ATF-6/p-Akt信号通路对AD起到神经保护作用。本文研究结果显示,在Aβ1-42诱导的AD细胞模型中神经元的存活率降低,ATF-6及p-Akt蛋白表达均显著降低; 而AD细胞模型给予AA147处理后,神经元的存活率显著升高,同时ATF-6和p-Akt蛋白的表达上调,提示AA147处理能够对AD细胞模型中神经元的存活起到保护作用。
综上所述,AA147对Aβ1-42诱导的AD细胞模型具有保护作用,AA147通过上调ATF-6蛋白表达激活Akt信号通路起到神经保护作用。本文结果可为开发有效的AD治疗策略提供实验依据。但p-Akt如何通过下游信号发挥神经保护作用仍然未知,需要进一步研究。
| [1] |
SCHELTENS P, DE STROOPER B, KIVIPELTO M, et al. Alzheimer's disease[J]. Lancet, 2021, 397(10284): 1577-1590. DOI:10.1016/S0140-6736(20)32205-4 |
| [2] |
WANG Q Q, DUAN L Y, LI X F, et al. Glucose metabolism, neural cell senescence and Alzheimer's disease[J]. International Journal of Molecular Sciences, 2022, 23(8): 4351. DOI:10.3390/ijms23084351 |
| [3] |
AJOOLABADY A, LINDHOLM D, REN J, et al. ER stress and UPR in Alzheimer's disease: mechanisms, pathogenesis, treatments[J]. Cell Death & Disease, 2022, 13(8): 706. |
| [4] |
ZHANG J Y, MA S, LIU X L, et al. Activating transcription factor 6 regulates cystathionine to increase autophagy and restore memory in Alzheimer's disease model mice[J]. Bioche-mical and Biophysical Research Communications, 2022, 615: 109-115. DOI:10.1016/j.bbrc.2022.05.053 |
| [5] |
LIU Q, XIE X T, EMADI S, et al. A novel nicotinic mechanism underlies β-amyloid-induced neurotoxicity[J]. Neuropharmacology, 2015, 97: 457-463. DOI:10.1016/j.neuropharm.2015.04.025 |
| [6] |
YANG L Y, WANG H Y, LIU L J, et al. The role of insulin/IGF-1/PI3K/akt/GSK3β signaling in Parkinson's disease dementia[J]. Frontiersin Neuroscience, 2018, 12: 73. DOI:10.3389/fnins.2018.00073 |
| [7] |
GABBOUJ S, RYHĀNEN S, MARTTINEN M, et al. Altered insulin signaling in Alzheimer's disease brain-special emphasis on PI3K-akt pathway[J]. Frontiersin Neuroscience, 2019, 13: 629. DOI:10.3389/fnins.2019.00629 |
| [8] |
STANLEY M, MACAULEY S L, HOLTZMAN D M. Changes in insulin and insulin signaling in Alzheimer's disease: cause or consequence?[J]. TheJournalof Experimental Medicine, 2016, 213(8): 1375-1385. DOI:10.1084/jem.20160493 |
| [9] |
ARNOLD S E, ARVANITAKIS Z, MACAULEY-RAMBACH S L, et al. Brain insulin resistance in type 2 diabetes and Alzheimer disease: concepts and conundrums[J]. Nature Reviews Neurology, 2018, 14(3): 168-181. DOI:10.1038/nrneurol.2017.185 |
| [10] |
STANCIU G D, BILD V, ABABEI D C, et al. Link between diabetes and Alzheimer's disease due to the shared amyloid aggregation and deposition involving both neurodegenerative changes and neurovascular damages[J]. Journal of Clinical Medicine, 2020, 9(6): 1713. DOI:10.3390/jcm9061713 |
| [11] |
TAM A B, ROBERTS L S, CHANDRA V, et al. The UPR activator ATF6 responds to proteotoxic and lipotoxic stress by distinct mechanisms[J]. Developmental Cell, 2018, 46(3): 327-343. e7. DOI:10.1016/j.devcel.2018.04.023 |
| [12] |
WANG S Y, KAUFMAN R J. The impact of the unfolded protein response on human disease[J]. The Journal of Cell Biology, 2012, 197(7): 857-867. DOI:10.1083/jcb.201110131 |
| [13] |
CNOP M, FOUFELLE F, VELLOSO L A. Endoplasmic reticulum stress, obesity and diabetes[J]. Trends in Molecular Medicine, 2012, 18(1): 59-68. DOI:10.1016/j.molmed.2011.07.010 |
| [14] |
CHEN J J, GENEREUX J C, WISEMAN R L. Endoplasmic reticulum quality control and systemic amyloid disease: Impacting protein stability from the inside out[J]. IUBMB Life, 2015, 67(6): 404-413. DOI:10.1002/iub.1386 |
| [15] |
PLATE L, WISEMAN R L. Regulating secretory proteostasis through the unfolded protein response: from function to therapy[J]. Trends in Cell Biology, 2017, 27(10): 722-737. DOI:10.1016/j.tcb.2017.05.006 |
| [16] |
HETZ C, PAPA F R. The unfolded protein response and cell fate control[J]. Molecular Cell, 2018, 69(2): 169-181. DOI:10.1016/j.molcel.2017.06.017 |
| [17] |
HETZ C, SAXENA S. ER stress and the unfolded protein response in neurodegeneration[J]. Nature Reviews Neurology, 2017, 13(8): 477-491. DOI:10.1038/nrneurol.2017.99 |
| [18] |
THIEBAUT A M, HEDOU E, MARCINIAK S J, et al. Proteostasis during cerebral ischemia[J]. Frontiers in Neuroscience, 2019, 13: 637. DOI:10.3389/fnins.2019.00637 |
| [19] |
BLACKWOOD E A, AZIZI K, THUERAUF D J, et al. Pharmacologic ATF6 activation confers global protection in widespread disease models by reprograming cellular proteostasis[J]. Nature Communications, 2019, 10(1): 187. DOI:10.1038/s41467-018-08129-2 |
| [20] |
PLATE L, COOLEY C B, CHEN J J, et al. Small molecule proteostasis regulators that reprogram the ER to reduce extracellular protein aggregation[J]. eLife, 2016, 5: e15550. DOI:10.7554/eLife.15550 |
| [21] |
KROEGER H, GRIMSEY N, PAXMAN R, et al. The unfolded protein response regulator ATF6 promotes mesodermal differentiation[J]. Science Signaling, 2018, 11(517): eaan5785. DOI:10.1126/scisignal.aan5785 |
| [22] |
PAXMAN R, PLATE L, BLACKWOOD E A, et al. Pharmacologic ATF6 activating compounds are metabolically activated to selectively modify endoplasmic reticulum proteins[J]. eLife, 2018, 7: e37168. DOI:10.7554/eLife.37168 |
| [23] |
CHENG N, SHI J H, JIN Y, et al. Pharmacological activating transcription factor 6 activation is beneficial for liver retrieval with ex vivo normothermic mechanical perfusion from cardiac dead donor rats[J]. Frontiers in Surgery, 2021, 8: 665260. DOI:10.3389/fsurg.2021.665260 |
| [24] |
JIA W K, JIAN Z, LI J W, et al. Upregulated ATF6 contri-butes to chronic intermittent hypoxia-afforded protection against myocardial ischemia/reperfusion injury[J]. International Journal of Molecular Medicine, 2016, 37(5): 1199-1208. DOI:10.3892/ijmm.2016.2535 |
 2024, Vol. 60
2024, Vol. 60

