肺癌死亡人数约占癌症总死亡人数的20%[1]。肺癌恶性程度和预后与肿瘤细胞的增殖方式和速度有关[2]。肿瘤增殖抗原Ki-67是一种细胞增殖相关的核抗原,可以准确反映细胞的增殖活性[3]。目前,肺癌Ki-67的表达情况需要活检或手术组织病理学检查确定,但活检样本一般只能取得肿瘤组织的一小部分,由于肿瘤内存在异质性表达,可能导致经穿刺活检样本得出的Ki-67指数不能准确代表整个肿瘤的Ki-67水平,导致结果出现偏差甚至误诊等非最佳临床决策[4]。影像组学可以发现和分析肿瘤不同的细胞表型,在评估肿瘤异质性方面有明显的优势[5-6]。本研究建立基于CT增强图像特征的影像组学标签,并联合临床参数建立预测肺癌病人Ki-67表达水平的列线图预测模型,探讨其预测效果。
1 资料与方法 1.1 研究对象及其分组回顾性分析2014年1月—2018年12月在我院就诊的经病理证实的2 286例肺癌病人。纳入标准:①经病理证实为肺癌并行免疫组织化学Ki-67检查;②手术前行胸部双期CT动态增强检查。排除标准:①同时合并其他原发恶性肿瘤者;②CT检查前经抗肿瘤治疗(放射治疗、化学药物治疗或其他治疗等);③临床资料不全病人;④肿瘤长径<1 cm的病人。根据纳入和排除标准,本研究共纳入282例病人,其中腺癌158例,鳞癌69例,神经内分泌癌55例(包括小细胞肺癌38例、大细胞肺癌13例、类癌4例)。按7∶3的比例将病人随机分为训练组与验证组,训练组197例,验证组85例。
1.2 临床相关因素的资料收集临床相关因素包括病人年龄、性别、是否吸烟、肿瘤最大径、病理类型以及血清肿瘤标志物,其中血清肿瘤标志物包括胃泌素释放肽前体(ProGRP)、鳞状细胞癌相关抗原(SCCA)、癌胚抗原(CEA)、神经特异性烯醇化酶(NSE)以及细胞角蛋白19片段(cYFRA21-1)。
1.3 CT检查所有病人均采用相同的CT扫描方案。病人取仰卧体位,扫描范围自肺尖以下至膈肌水平以上,采用双筒高压注射器经右肘静脉注射造影剂碘海醇(300 g/L),剂量为1.3~1.5 mL/kg,以3 mL/s的流量进行注射,扫描层厚5.00 mm,管电压120 kV,管电流200 mA。注射造影剂后延迟25、70 s扫描分别获取病人的动脉期、静脉期图像。扫描完成后对所获得的图像进行重建处理,重建层厚为1 mm,层间距为1 mm。
1.4 Ki-67表达测量由两名分别有15年和11年诊断经验的病理科医生浏览全标本,在5个阳性密度最高的区域计数阳性细胞;每个区域在高倍镜下随机计数100个细胞,Ki-67指数以阳性细胞的百分比计算。分别计算5个区域的Ki-67指数,取平均值。根据文献的标准[7],≤40%的阳性染色定义为Ki-67低表达,>40%阳性染色为Ki-67高表达。当出现意见分歧时,请教另一位具有19年诊断肺癌经验的病理科医生并通过讨论达成共识。
1.5 基于影像组学标签列线图模型的构建 1.5.1 肿瘤兴趣区标记从影像归档和通信系统中检索病灶最大横截面的增强CT图像用于图像特征提取。使用图像软件ITK-SNAP 3.8.0 (http://www.itksnap.org)手动勾画感兴趣区(ROI)。所有ROI的放置均由两名具有10年以上胸部CT诊断经验的放射科医生完成。第1位医生对ROI进行勾画并执行一次特征提取;1周后,进行第2次ROI勾画和特征提取,以评估测量者内的一致性。第2位医生只进行一次ROI放置和特征提取,用于评估与另一位医生的测试者间一致性。
1.5.2 影像组学特征的提取、选择和标签的建立应用影像组学与人工智能整体解决方案应用平台A.K软件对CT图像的ROI进行特征提取,共提取396个影像组学参数,包括直方图特征、几何形态特征和纹理特征三大类。采用Lasso回归降维处理,选择与预测显著相关的关键特征。在提取影像特征前,对原始图像进行标准化处理。通过选取的特征与对应加权系数乘积的线性组合依次生成每位病人的影像组学分数。
1.5.3 预测肺癌病人Ki-67表达水平列线图模型的建立纳入影像组学分数以及临床参数,通过后退法logistic回归建立预测肺癌病人低和高Ki-67表达的鉴别模型。采用受试者工作特征(ROC)曲线下面积(AUC)来评价影像组学标签对肺癌Ki-67指数的预测效能。绘制校准曲线对比实际观察的预测能力与列线图预测能力之间的吻合度。采用决策曲线分析验证不同阈值概率下的净收益以确定列线图的临床有用性。
1.6 统计学分析采用R3.4.4软件进行统计分析。使用“glmnet”包进行Lasso-logistic回归,使用“proc”包绘制ROC曲线,使用“rms”包完成logistic回归、列线图构建、决策曲线和校准曲线绘制。计数资料以例数和百分数表示,使用卡方检验进行差异性分析。计量资料以x±s表示,使用t 检验或秩和检验进行比较。P<0.05认为差异有统计学意义。
2 结果 2.1 训练组和验证组临床资料的比较训练组和验证组的年龄、性别、肿瘤最大径、吸烟情况以及病理类型差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两组病人临床资料比较(例(χ/%)) |
|
|
与Ki-67低表达比较,Ki-67高表达更常见于男性、吸烟、肿瘤较大、鳞癌及神经内分泌癌病人,差异具有统计学意义(χ2=19.73~89.77,t=3.46,P<0.01)。见表 2。
| 表 2 Ki-67低表达与高表达病人临床资料比较(例(χ/%)) |
|
|
Ki-67高表达肺癌病人的ProGRP、SCCA、NSE水平高于Ki-67低表达病人(Z=3.82~4.42,P<0.05),cYFRA21-1水平低于Ki-67低表达的病人(Z=2.37,P<0.05)。见表 3。
| 表 3 Ki-67低表达与高表达病人血清肿瘤标志物比较(x±s) |
|
|
本研究从图像中共提取了396个影像组学特征,采用Lasso-logistic回归降维,筛选出16个具有显著预测价值的影像特征。见图 1。这16个影像特征被纳入预测模型中构建影像组学标签。
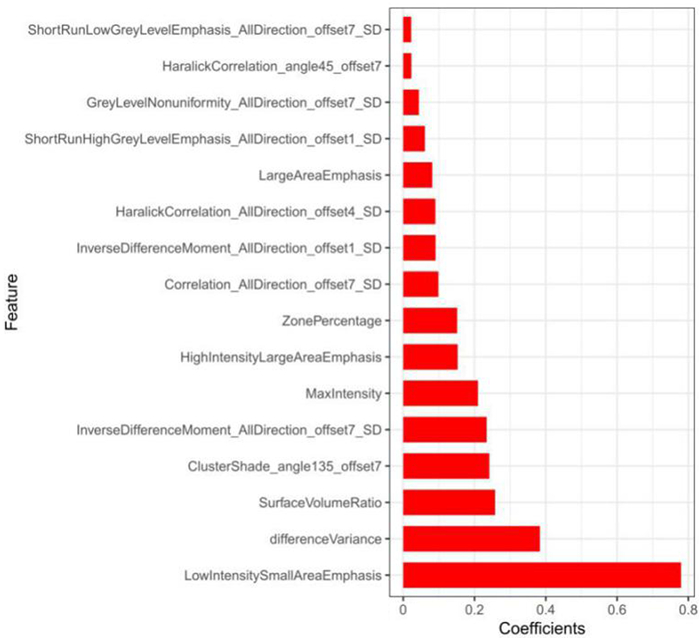 |
| 图 1 Lasso-logistic选择出的16个具有显著预测价值的特征 |
以性别、年龄、吸烟、肿瘤最大径、病理类型、血清肿瘤标志物及影像组学标签分数为自变量,以Ki-67表达为因变量(高表达=1,低表达=0)进行多因素logistic回归分析,结果显示,对Ki-67高、低表达有显著影响的指标为吸烟、NSE和影像组学标签。以影像组学标签分数、吸烟和NSE为预测因子建立预测肺癌病人Ki-67高、低表达的列线图模型。见图 2。
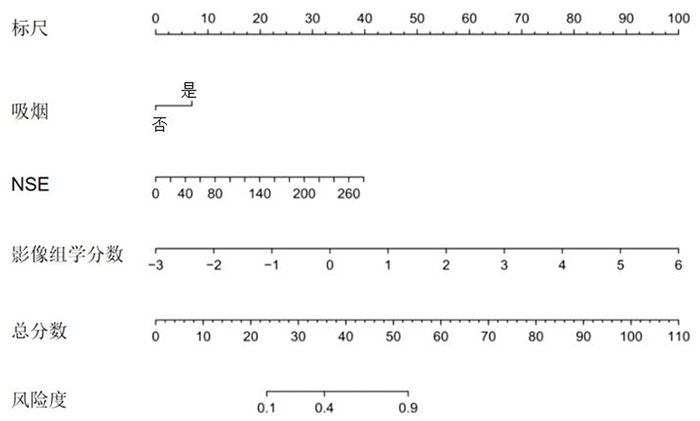 |
| 图 2 预测肺癌病人Ki-67表达的列线图模型 |
列线图模型在训练组和验证组中的AUC分别为0.89和0.87,预测效能较好。见表 4和图 3。
| 表 4 列线图模型与影像组学模型、临床参数模型的预测效能 |
|
|
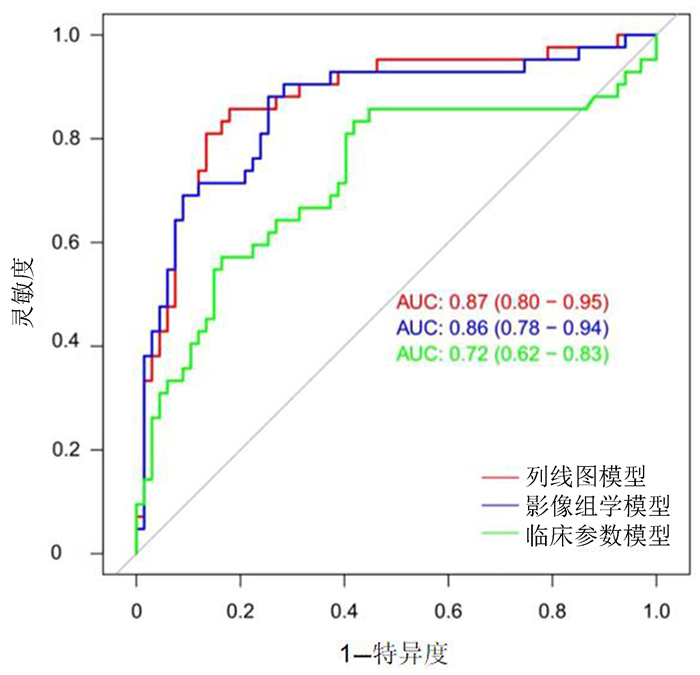 |
| 图 3 影像组学、临床参数与列线图模型的ROC曲线 |
校准曲线显示列线图模型预测概率与理想概率之间具有很好的吻合度。见图 4。
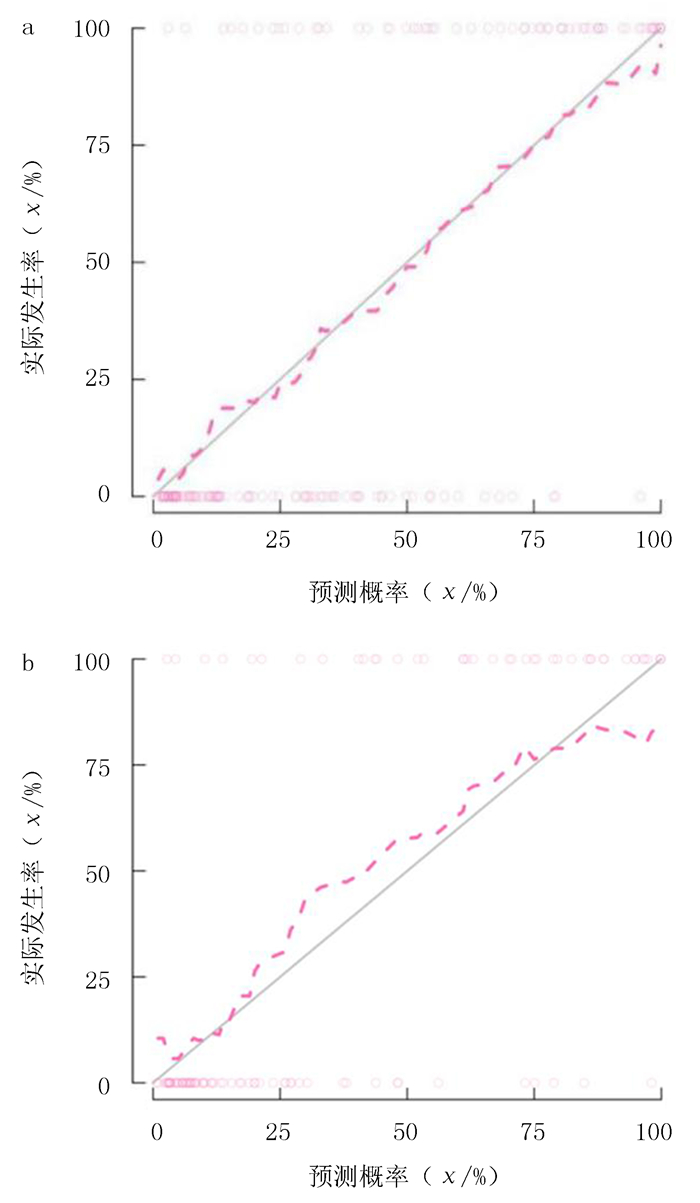 |
| a:训练组列线图的校准曲线;b:验证组列线图的校准曲线。对角线实线表示理想模型的完美预测,粉色虚线代表模型的性能,虚线越接近理想线,列线图的预测准确度越好。 图 4 两组列线图的校准曲线 |
在整个阈值范围内,列线图模型预测效能都较好,表明列线图模型具有较好的临床适用性。见图 5。
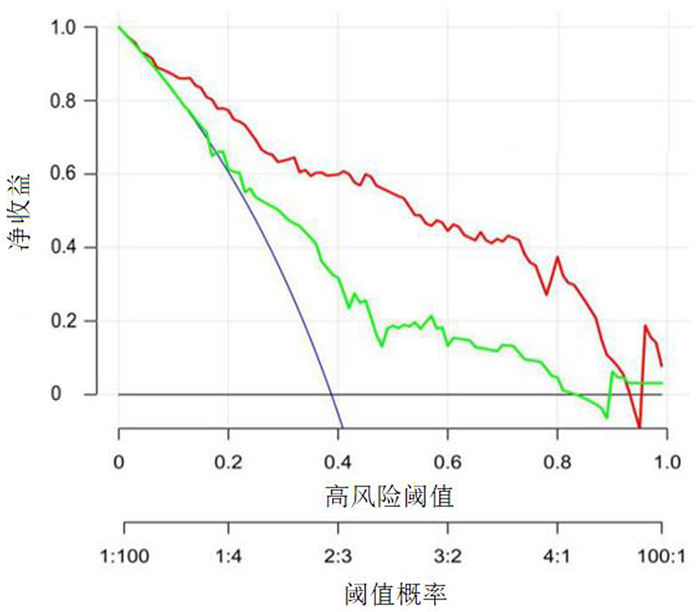 |
| 红线表示影像组学特征和临床特征结合的决策曲线,绿线表示临床参数模型决策曲线,蓝线表示所有病人都为Ki-67高表达的假设,黑线表示所有病人都为Ki-67低表达的假设。 图 5 列线图预测模型的决策曲线 |
Ki-67核蛋白是细胞周期和增殖的标志物[8],通常用于估计细胞的群体增殖,在恶性肿瘤中,Ki-67阳性细胞的百分比与肿瘤的侵袭性或肿瘤的进展有关。临床认为Ki-67是一种对肿瘤诊断、治疗和预后都非常有价值的生物标志物[9-11]。对于非小细胞肺癌的CT纹理特征的研究表明,肿瘤由于不同的生物学行为和代谢水平而存在内部异质性,CT纹理分析可以量化肿瘤的异质性[4, 12]。肺癌是一种高度异质性的肿瘤,Ki-67表达异质性同样存在于肺癌中,不同瘤内区域的Ki-67指数可为1%~90%不等[13]。Ki-67高表达和低表达在肿瘤细胞增殖率、细胞分化和亚克隆区组成上存在异质性,CT纹理分析可以捕捉到这些异质性并以特征的形式表现出来[14-15]。肺癌CT图像的解析对预测肿瘤分子标志物Ki-67的表达具有重要的临床意义。
本研究结果显示,训练组和验证组的性别、肿瘤最大径、吸烟情况以及病理类型存在显著差异,Ki-67高表达常见于男性、吸烟、肿瘤较大、鳞癌、小细胞肺癌病人,与以往研究报道一致[16-17]。本研究中临床参数模型预测Ki-67指数的AUC值仅为0.72,而影像组学标签预测的AUC值为0.86,预测效力远高于临床参数模型,说明影像组学标签在预测肺癌Ki-67指数方面明显优于单纯的临床参数模型。本研究联合影像组学分数和临床相关因素建立了列线图预测模型,结果显示验证组中列线图模型预测的AUC值为0.87,略高于单独影像组学标签的预测效能(AUC=0.86),但明显高于临床参数模型的预测效能(AUC=0.72),并且列线图的预测准确度、特异度都有所提高,说明列线图的预测效能优于单纯临床参数模型或影像组学标签模型。
本研究还有一定的局限性。本研究为单中心研究,可能会存在选择性偏倚,虽然包含了不同病理类型的肺癌病人,但没有具体分析影像组学对某一特定病理类型肺癌Ki-67指数的预测,而临床可能需要为不同病理类型的肺癌设置不同的Ki-67指数阈值来评价。
综上所述,本研究建立了基于增强CT图像的影像组学标签与临床因素结合的列线图模型,该模型可用于预测肺癌病人Ki-67的表达水平。通过扩大样本量、融合更多的临床信息来提高影像组学模型预测肺癌病人Ki-67表达水平的效能是我们下一步的研究方向。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
TABATA K, TANAKA T, HAYASHI T, et al. Ki-67 is a strong prognostic marker of non-small cell lung cancer when tissue heterogeneity is considered[J]. BMC Clinical Pathology, 2014, 14: 23. DOI:10.1186/1472-6890-14-23 |
| [3] |
GRAEFE C, EICHHORN L, WURST P, et al. Optimized Ki-67 staining in murine cells: a tool to determine cell proliferation[J]. Molecular Biology Reports, 2019, 46(4): 4631-4643. DOI:10.1007/s11033-019-04851-2 |
| [4] |
GANESHAN B, ABALEKE S, YOUNG R C, et al. Texture analysis of non-small cell lung cancer on unenhanced computed tomography: initial evidence for a relationship with tumour glucose metabolism and stage[J]. Cancer Imaging: the Official Publication of the International Cancer Imaging Society, 2010, 10(1): 137-143. |
| [5] |
GANESHAN B, GOH V, MANDEVILLE H C, et al. Non-small cell lung cancer: histopathologic correlates for texture parameters at CT[J]. Radiology, 2013, 266(1): 326-336. DOI:10.1148/radiol.12112428 |
| [6] |
GROSSMANN P, STRINGFIELD O, EL-HACHEM N, et al. Defining the biological basis of radiomic phenotypes in lung cancer[J]. eLife, 2017, 6: e23421. DOI:10.7554/eLife.23421 |
| [7] |
AHN H K, JUNG M, HA S Y, et al. Clinical significance of Ki-67 and p53 expression in curatively resected non-small cell lung cancer[J]. Tumour Biology, 2014, 35(6): 5735-5740. DOI:10.1007/s13277-014-1760-0 |
| [8] |
ANTONARAKIS E S, KEIZMAN D, ZHANG Z, et al. An immunohistochemical signature comprising PTEN, MYC, and Ki67 predicts progression in prostate cancer patients receiving adjuvant docetaxel after prostatectomy[J]. Cancer, 2012, 118(24): 6063-6071. DOI:10.1002/cncr.27689 |
| [9] |
JAKOBSEN J N, SØRENSEN J B. Clinical impact of ki-67 labeling index in non-small cell lung cancer[J]. Lung Cancer, 2013, 79(1): 1-7. DOI:10.1016/j.lungcan.2012.10.008 |
| [10] |
李中林, 钱国伟, 徐为, 等. Ki-67启动子转录调控结构与功能研究[J]. 中华实验外科杂志, 2010, 27(9): 1296-1298. DOI:10.3760/cma.j.issn.1001-9030.2010.09.043 |
| [11] |
WEN S, ZHOU W, LI C M, et al. Ki-67 as a prognostic marker in early-stage non-small cell lung cancer in Asian patients: a meta-analysis of published studies involving 32 studies[J]. BMC Cancer, 2015, 15: 520. DOI:10.1186/s12885-015-1524-2 |
| [12] |
YIP S S F, AERTS H J W L. Applications and limitations of radiomics[J]. Physics in Medicine and Biology, 2016, 61(13): R150-R166. DOI:10.1088/0031-9155/61/13/R150 |
| [13] |
HISTED S N, LINDENBERG M L, MENA E, et al. Review of functional/anatomical imaging in oncology[J]. Nuclear Medicine Communications, 2012, 33(4): 349-361. DOI:10.1097/MNM.0b013e32834ec8a5 |
| [14] |
GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563-577. DOI:10.1148/radiol.2015151169 |
| [15] |
AVANZO M, STANCANELLO J, NAQA I E. Beyond imaging: the promise of radiomics[J]. Physica Medica: PM: an International Journal Devoted to the Applications of Physics to Medicine and Biology: Official Journal of the Italian Association of Biomedical Physics (AIFB), 2017, 38: 122-139. |
| [16] |
WERYNSKA B, PULA B, MUSZCZYNSKA-BERNHARD B, et al. Correlation between expression of metallothionein and expression of Ki-67 and MCM-2 proliferation markers in non-small cell lung cancer[J]. Anticancer Research, 2011, 31(9): 2833-2839. |
| [17] |
李英杰, 于长海, 李捷, 等. PCNA和Ki-67在非小细胞肺癌组织中的表达及其临床意义[J]. 临床军医杂志, 2011, 39(2): 261-263. DOI:10.3969/j.issn.1671-3826.2011.02.21 |
 2024, Vol. 60
2024, Vol. 60

