慢性肾脏病(CKD)发展到终末阶段又称尿毒症,需替代治疗维持生命,且患心血管疾病的风险较正常人群增加[1-4]。维持性血液透析(MHD)在临床广泛应用,是尿毒症病人主要治疗方式之一。研究显示,透析时间及方式对病人心功能及心血管事件的发生率有影响[5-6]。因此,对未行透析及透析不同时间尿毒症病人心功能变化的研究至关重要。目前,关于超声心动图对不同时长MHD病人左心功能的研究较少。本研究应用实时三维斑点追踪成像技术(RT3D-STI)评估不同血液透析时间尿毒症病人左心室的功能,探讨RT3D-STI在MHD前后左心室整体及局部功能变化中的应用价值。
1 资料与方法 1.1 研究对象及分组选取2019年2月—2020年4月就诊于我院确诊为尿毒症的病人118例,男86例,女32例,年龄20~73岁,平均(45.36±12.33)岁。原发病变为慢性肾小球肾炎21例,慢性肾间质性肾炎5例,多囊肾9例,高血压肾病33例,糖尿病肾病36例,原因不明14例。所有病人均符合美国肾脏病基金会发布的指南的诊断标准,肾小球滤过率<10 mL/min,血肌酐>707 μmol/L。纳入标准:①左心室射血分数(LVEF)≥50%;②行血液透析;③窦性心律。排除标准:心脏瓣膜病、严重心律失常、肺心病、先天性心脏病等疾病,以及安装人工起搏器或接受过肾移植的病人。MHD频率均为每周3次,以高通量透析为主。尿毒症病人根据是否接受MHD治疗分为透析组(97例)和未透析组(21例),透析组根据透析时间长短进一步分为A组(45例,透析时间<1年)、B组(28例,1年≤透析时间≤3年)和C组(24例,3年<透析时间≤5年)。另选取同期健康志愿者30例为对照组,男22例,女8例。本研究所有受检者均知情同意。
1.2 仪器与方法采用Philips iE 33彩色多普勒超声诊断仪,配备Tomtec工作站、S5-1探头及X5-1探头,探头频率1.0~5.0 MHz。图像由同一名医师进行采集,受检者平静呼吸、取左侧卧位,同时连接心电图,常规测量二维超声参数,然后将探头切换至X5-1,于心尖四腔心切面且心内膜及心外膜显示完整、清晰时,采集连续4个心动周期的三维斑点追踪图像,将其存储于硬盘中供脱机分析。
1.2.1 二维超声参数测量测量左心室舒张末期内径(LVEDd)、左心室收缩末期内径(LVESd)、室间隔舒张期厚度(IVSd)、左心室后壁舒张期厚度(LVPWd)、左心室舒张末期容积(EDV),脉冲多普勒测量二尖瓣舒张早期峰值流速(E)、二尖瓣舒张晚期峰值流速(A)、二尖瓣环舒张早期心肌运动速度(e′),计算二尖瓣舒张早期血流峰值与运动速度之比(E/e′)、二尖瓣舒张早期与舒张晚期峰值流速之比(E/A),评估肺动脉压力(PASP)。应用Bi-plane Simpson法测量病人LVEF。计算左心室心肌质量(LVM),LVM=1.04×[(LVEDd+IVSd+LVPWd)3-LVEDd3]-13.6;计算相对室壁厚度(RWT),RWT=(IVSd+LVPWd)/LVEDd;并用体表面积标准化获得病人左心室心肌质量指数(LVMI),LVMI=LVM/体表面积(BSA)。
1.2.2 三维超声参数测量将储存的三维图像导入Tomtec工作站,启动4D Auto LVQ软件,系统自动追踪心肌斑点运动轨迹及心外膜,必要时手动调整,获得左心室整体纵向、径向、圆周应变(GLS、GRS、GCS)曲线,左心室整体纵向、径向、圆周应变心肌运动达峰时间(TLS、TRS、TCS),分析参数的差异及相关性。
1.2.3 临床资料收集记录年龄、身高、体质量,监测血压;于清晨空腹采集静脉血,测量并记录血钙(Ca)、血磷(P)、血肌酐(SCr)、尿素氮(BUN)及甲状旁腺激素(PTH)水平。
1.3 统计学分析采用SPSS 22.0软件进行统计分析。正态分布的计量资料以x±s表示,多组比较采用单因素方差分析,方差齐时,使用LSD法进行组间两两比较;方差不齐时采用Welch校正,组间两两比较采用Dunnett T3法。相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果 2.1 各组临床资料比较各组病人年龄、性别、体表面积差异无统计学意义(P>0.05),其他指标差异均有统计学意义(F=6.213~80.393,P<0.05)。与对照组比较,未透析组和透析组病人收缩压、舒张压、LVMI、PTH、P、SCr及BUN显著增高,Ca显著减低(P<0.05);与未透析组相比,透析组P、SCr及BUN显著降低,B组Ca显著升高(P<0.05);与A组比较,B组PTH显著增高(P<0.05)。见表 1。
| 表 1 各组临床及生化相关参数比较(x±s) |
|
|
各组病人的LVEF差异无统计学意义(P>0.05),其他指标差异均有统计学意义(F=10.232~25.654,P<0.05)。与对照组相比较,未透析组及透析组的LVEDd、LVESd、EDV、E/e′、RWT、PASP显著增大(P<0.05);与未透析组相比较,透析组的LVEDd、LVESd、EDV、RWT、PASP均显著降低(P<0.05);与A组相比较,B组PASP减低,C组E/A减低,差异均具有统计学意义(P<0.05)。见表 2。
| 表 2 各组病人常规超声参数比较(x±s) |
|
|
各组病人GCS、TCS差异无统计学意义(P>0.05),其他指标差异均有统计学意义(F=9.234~21.592,P<0.05)。与对照组相比,未透析组及透析组GLS、GRS明显减低,TLS、TRS显著延长(P<0.05);与未透析组相比较,透析组GLS显著升高,TLS显著降低(P<0.05);与A组相比较,B、C组的GLS显著减低,TLS显著延长(P<0.05)。见表 3、图 1。
| 表 3 各组三维超声参数比较(x±s) |
|
|
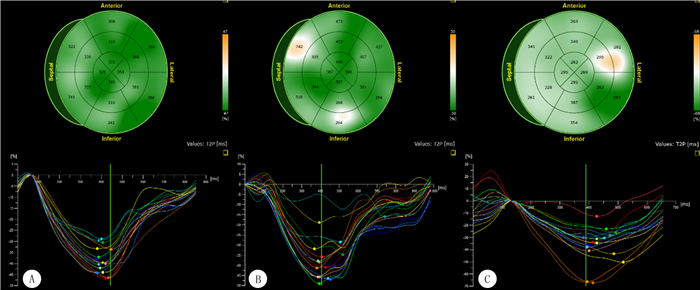 |
| A:对照组左心室心肌应变及各节段同步性;B:未透析组尿毒症病人左心室心肌应变及各节段同步性;C:透析组尿毒症病人左心室心肌应变及各节段同步性。 图 1 尿毒症病人左心室RT3D-STI心肌应变及同步性分析图 |
尿毒症病人GLS、GRS与LVMI、EDV呈负相关(r=-0.609~-0.446,P<0.01),与LVEF呈正相关(r=0.553、0.513,P<0.01)。见图 2。
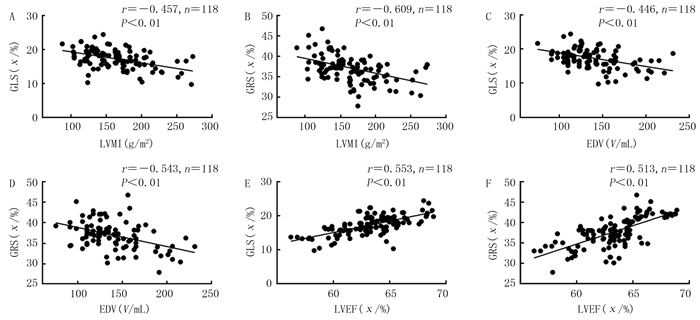 |
| A:尿毒症病人GLS与LVMI的相关性;B:尿毒症病人GRS与LVMI的相关性;C:尿毒症病人GLS与EDV的相关性;D:尿毒症病人GRS与EDV的相关性;E:尿毒症病人GLS与LVEF的相关性;F:尿毒症病人GRS与LVEF的相关性。 图 2 尿毒症病人心肌应变参数与LVMI和常规超声参数的相关性 |
早期尿毒症病人心肌局部收缩功能已经发生变化[8-9],MHD病人死亡的主要原因之一为心血管疾病[10-15]。尿毒症病人的内部环境变化非常复杂,包括体液波动、电解质紊乱和尿毒症毒素[16-17]。MHD虽然可以清除部分尿毒症毒素及减轻水钠潴留,但由于长期炎症刺激、心肌代偿性肥厚、微血管灌注障碍及动脉粥样硬化,病人仍可存在心肌缺血[18-20]。矿物质和骨代谢的改变,可影响左心室的结构和功能[2]。大量钙的沉积引起心脏纤维化,低血清钙浓度使心电传导时间延长,PTH可抑制心肌细胞对能量底物的利用,从而影响心脏收缩和舒张功能[21-25]。研究显示,SCr和BUN水平是左心室整体收缩功能的独立预测因子[26]。此外,尿毒症病人并发的肾性贫血、低蛋白血症、高脂血症和糖代谢异常等亦可加重损伤。由此可见,尿毒症病人左心室功能受损机制很复杂,上述原因均可导致LVEF保留的尿毒症病人左心室功能障碍。
心肌运动与心肌纤维走行相关[27]。正常人心肌纤维分三层,内、中、外层分别为纵行、环形、斜行纤维。HENSEN等[28]的研究表明,尽管在透析前和透析中LVEF仍能维持在正常范围,但左心室GLS已经存在较明显的受损。此外,LVMI与左心室GLS受损独立相关。本研究中未透析组和透析组病人GLS明显受损,这与心内膜心肌纤维主要为纵向纤维有关。心内膜位于心脏供血的末端,收缩期血管外压迫引起的平均有效灌注压力降低,心内膜增厚需氧量增加[29],导致对缺血、低氧最为敏感。研究表明,血液透析对心脏的结构和功能有害,在长期血液透析期间,心室会扩张,并且收缩和舒张功能都会恶化[30-31]。两次治疗之间心腔的反复拉伸会导致长期的心脏重塑[32-33]。值得注意的是,也有研究显示,血液透析会立即改善左心室应变[34],增加血液透析的频率和延长单次透析时间与左心形态和收缩功能改善有关[35]。本研究中,与未透析组相比,透析组GLS明显改善,表明MHD对心脏局部收缩功能的恢复具有积极作用。在透析组病人中B组及C组GLS较A组减低,B组及C组之间无明显差异,提示在透析时间进一步增加的情况下,GLS未发生恶化。本研究尿毒症病人GRS减低,尿毒症病人之间GRS无明显差异,与环形纤维位于中层相关, 不及内层心肌纤维位于供血末端对缺血低氧敏感。尿毒症病人TLS、TRS较对照组显著延长,未透析组较透析组TLS也显著延长,提示左心室同步性运动存在一定程度受损。总之,上述研究结果表明,三层心肌在不同水平上的损伤进展不是同时发生的。相关性分析显示,尿毒症病人GLS、GRS与LVMI、EDV呈负相关,与LVEF呈正相关,表明尿毒症病人心脏的结构和功能均发生了改变,GLS、GRS可准确反映局部收缩功能变化。
本研究的局限性:①为横断面研究,未获取透析前后左心室参数进行比较;②样本数量较少;③行RT3D-STI检测,3D数据的收集和获取受到操作员的限制。
综上所述,RT3D-STI可通过检测射血分数保留的尿毒症病人左心室整体应变及整体运动达峰时间,追踪其心肌运动,对病人左心室心肌运动变化情况进行准确评价。在本研究中,尿毒症病人左心室结构和功能均受损,MHD病人较未透析病人左心室功能明显改善,MHD对尿毒症病人的长期生存具有重要的意义。此外,本研究对尿毒症病人肾移植前血液透析的选择及透析过程中移植时间的把握具有一定的临床意义。
| [1] |
MATHEW R O, ROSENSON R S, LYUBAROVA R, et al. Concepts and controversies: lipid management in patients with chronic kidney disease[J]. Cardiovascular Drugs and Therapy, 2021, 35(3): 479-489. DOI:10.1007/s10557-020-07020-x |
| [2] |
REIMER K C, NADAL J, MEISELBACH H, et al. Association of mineral and bone biomarkers with adverse cardiovascular outcomes and mortality in the German Chronic Kidney Di-sease (GCKD) cohort[J]. Bone Research, 2023, 11(1): 52. DOI:10.1038/s41413-023-00291-8 |
| [3] |
马雨琴, 张波. 三维斑点追踪技术评估慢性肾脏病患者左心收缩功能的进展[J]. 中国医学影像技术, 2018, 34(5): 791-795. |
| [4] |
ISMAIL S, FUNK M J, FLYTHE J E. Ondansetron and the risk of sudden cardiac death among individuals receiving maintenance hemodialysis[J]. Journal of the American Society of Nephrology, 2024. DOI:10.1681/ASN.0000000000000336 |
| [5] |
SARAN R, ROBINSON B, ABBOTT K C, et al. US renal data system 2019 annual data report: epidemiology of kidney disease in the United States[J]. American Journal of Kidney Diseases: the Official Journal of the National Kidney Foundation, 2020, 75(1 Suppl 1): A6-A7. |
| [6] |
WANG F, YANG C, LONG J Y, et al. Executive summary for the 2015 annual data report of the China kidney disease network (CK-NET)[J]. Kidney International, 2019, 95(3): 501-505. DOI:10.1016/j.kint.2018.11.011 |
| [7] |
INKER L A, ASTOR B C, FOX C H, et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for the evaluation and management of CKD[J]. American Journal of Kidney Diseases: the Official Journal of the National Kidney Foundation, 2014, 63(5): 713-735. DOI:10.1053/j.ajkd.2014.01.416 |
| [8] |
REDDY Y N V, OBOKATA M, DEAN P G, et al. Long-term cardiovascular changes following creation of arteriovenous fistula in patients with end stage renal disease[J]. European Heart Journal, 2017, 38(24): 1913-1923. DOI:10.1093/eurheartj/ehx045 |
| [9] |
李卡娜, 郑哲岚, 王江涛. 峰值应变离散度和纵向心肌应变评价不同替代疗法的尿毒症患者左心室收缩功能[J]. 中华医学超声杂志(电子版), 2021, 18(3): 258-265. DOI:10.3877/cma.j.issn.1672-6448.2021.03.004 |
| [10] |
MCCULLOUGH P A, CHAN C T, WEINHANDL E D, et al. Intensive hemodialysis, left ventricular hypertrophy, and cardiovascular disease[J]. American Journal of Kidney Diseases: the Official Journal of the National Kidney Foundation, 2016, 68(5S1): S5-S14. |
| [11] |
DUNI A, GRECO M, PRESTA P, et al. Circulating miRNA 122-5p expression predicts mortality and cardiovascular events in chronic hemodialysis patients: a multicentric, pilot, prospective study[J]. Biomolecules, 2023, 13(11): 1663. DOI:10.3390/biom13111663 |
| [12] |
吴晓力, 倪珏民, 陈建娥, 等. 维持性血液透析患者脑梗死发生状况及危险因素分析[J]. 中华全科医学, 2022, 20(3): 511-513, 534. |
| [13] |
余福海, 沈才杰, 陆曹杰, 等. 慢性肾脏病患者心率变异性相关影响因素及预防对策[J]. 中华全科医学, 2021, 19(5): 798-800, 855. |
| [14] |
PELLA E, BOULMPOU A, BOUTOU A, et al. Different interdialytic intervals and cardiorespiratory fitness in patients undergoing hemodialysis[J]. Clinical Journal of the American Society of Nephrology, 2024. DOI:10.2215/CJN.0000000000-000435 |
| [15] |
WU J C, LI X H, ZHANG H, et al. Development and validation of a prediction model for all-cause mortality in maintenance dialysis patients: a multicenter retrospective cohort study[J]. Renal Failure, 2024, 46(1): 2322039. DOI:10.1080/0886022X.2024.2322039 |
| [16] |
NIGAM S K, BUSH K T. Uraemic syndrome of chronic kidney disease: altered remote sensing and signalling[J]. Nature Reviews Nephrology, 2019, 15(5): 301-316. DOI:10.1038/s41581-019-0111-1 |
| [17] |
李会宁, 黄智敏. 高通量血液透析对老年终末期肾病患者氧化应激及微炎症状态的影响[J]. 新乡医学院学报, 2023, 40(11): 1069-1073. |
| [18] |
RECIO-MAYORAL A, BANERJEE D, STREATHER C, et al. Endothelial dysfunction, inflammation and atherosclerosis in chronic kidney disease: a cross-sectional study of predialy-sis, dialysis and kidney-transplantation patients[J]. Atherosclerosis, 2011, 216(2): 446-451. DOI:10.1016/j.atherosclerosis.2011.02.017 |
| [19] |
ZHAO H F, WU D S, GYAMFI M A, et al. Expanded Hemodialysis ameliorates uremia-induced impairment of vasculoprotective KLF2 and concomitant proinflammatory priming of endothelial cells through an ERK/AP1/cFOS-dependent me-chanism[J]. Frontiers in Immunology, 2023, 14: 1209464. DOI:10.3389/fimmu.2023.1209464 |
| [20] |
赵蕊, 张东亮, 贾建文, 等. 彩色多普勒超声评价血液透析患者自体动静脉内瘘的应用价值[J]. 中国超声医学杂志, 2017, 33(10): 930-932. DOI:10.3969/j.issn.1002-0101.2017.10.022 |
| [21] |
ISAKOVA T, NICKOLAS T L, DENBURG M, et al. KDOQI US commentary on the 2017 KDIGO clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD)[J]. American Journal of Kidney Diseases: the Official Journal of the National Kidney Foundation, 2017, 70(6): 737-751. DOI:10.1053/j.ajkd.2017.07.019 |
| [22] |
何然, 任洁, 印霞, 等. 维持性血液透析患者血压波动影响因素分析及其与慢性肾脏病-矿物质和骨异常的相关性研究[J]. 中国血液净化, 2021, 20(4): 254-257, 272. DOI:10.3969/j.issn.1671-4091.2021.04.009 |
| [23] |
贾凤玉, 徐斌, 任红旗, 等. 维持性血液透析患者血清成纤维细胞生长因子23与血管钙化和左心室肥厚的关系[J]. 肾脏病与透析肾移植杂志, 2015, 24(2): 101-106. |
| [24] |
李明, 李灿明, 叶增纯, 等. 维持性血液透析患者死亡及其危险因素的单中心分析[J]. 中山大学学报(医学科学版), 2020, 41(4): 620-626. |
| [25] |
郑淑蓓, 金领微, 郑育, 等. 维持性血液透析患者磷代谢紊乱与左心室肥厚的关系[J]. 中华肾脏病杂志, 2015, 31(7): 534-536. DOI:10.3760/cma.j.issn.1001-7097.2015.07.010 |
| [26] |
CHEN R, WU X, SHEN L J, et al. Left ventricular myocardial function in hemodialysis and nondialysis uremia patients: a three-dimensional speckle-tracking echocardiography study[J]. PLoS One, 2014, 9(6): e100265. DOI:10.1371/journal.pone.0100265 |
| [27] |
MURARU D, NIERO A, RODRIGUEZ-ZANELLA H, et al. Three-dimensional speckle-tracking echocardiography: benefits and limitations of integrating myocardial mechanics with three-dimensional imaging[J]. Cardiovascular Diagnosis and Therapy, 2018, 8(1): 101-117. DOI:10.21037/cdt.2017.06.01 |
| [28] |
HENSEN L C R, GOOSSENS K, DELGADO V, et al. Pre-valence of left ventricular systolic dysfunction in pre-dialysis and dialysis patients with preserved left ventricular ejection fraction[J]. European Journal of Heart Failure, 2018, 20(3): 560-568. DOI:10.1002/ejhf.1077 |
| [29] |
ALGRANATI D, KASSAB G S, LANIR Y. Why is the su-bendocardium more vulnerable to ischemia? A new paradigm[J]. American Journal of Physiology Heart and Circulatory Physiology, 2011, 300(3): H1090-H1100. DOI:10.1152/ajpheart.00473.2010 |
| [30] |
KEVEN K, CALAYOGLU R, SENGUL S, et al. Comparative effects of renal transplantation and maintenance dialysis on arterial stiffness and left ventricular mass index[J]. Clinical Transplantation, 2008, 22(3): 360-365. DOI:10.1111/j.1399-0012.2008.00794.x |
| [31] |
SUN M M, CAO X S, GUO Y, et al. Long-term impacts of hemodialysis on the right ventricle: assessment via 3-dimensional speckle-tracking echocardiography[J]. Clinical Cardiology, 2018, 41(1): 87-95. DOI:10.1002/clc.22857 |
| [32] |
LOUTRADIS C, SARAFIDIS P A, FERRO C J, et al. Vo-lume overload in hemodialysis: diagnosis, cardiovascular consequences, and management[J]. Nephrology, Dialysis, Transplantation: Official Publication of the European Dialysis and Transplant Association-European Renal Association, 2021, 36(12): 2182-2193. |
| [33] |
OZDOGAN O, KAYIKCIOGLU M, ASCI G, et al. Left at-rial volume predicts mortality in low-risk dialysis population on long-term low-salt diet[J]. American Heart Journal, 2010, 159(6): 1089-1094. |
| [34] |
KOVÁCS A, TAPOLYAI M, CELENG C, et al. Impact of hemodialysis, left ventricular mass and FGF-23 on myocardial mechanics in end-stage renal disease: a three-dimensional speckle tracking study[J]. The International Journal of Cardiovascular Imaging, 2014, 30(7): 1331-1337. |
| [35] |
SUSANTITAPHONG P, KOULOURIDIS I, BALK E M, et al. Effect of frequent or extended hemodialysis on cardiovascular parameters: a meta-analysis[J]. American Journal of Kidney Diseases: the Official Journal of the National Kidney Foundation, 2012, 59(5): 689-699. |
 2024, Vol. 60
2024, Vol. 60

