2. 青岛大学附属青岛市中心医院血液科,山东 青岛 266042
异基因造血干细胞移植(allo-HSCT)技术日益成熟,已经成为血液病病人治愈疾病的曙光[1]。但仍有很多因素会影响移植后病人的恢复。研究显示,allo-HSCT后病人造血功能多在移植后2~3周即可恢复,但包括T淋巴细胞和B淋巴细胞在内的特异性免疫系统的移植后重建非常缓慢[2-3]。移植后免疫功能持续低下的状态给各种病原微生物入侵提供了可趁之机;病原微生物感染和移植物抗宿主病(GVHD)的发生会严重影响疾病的预后[4];为预防和治疗GVHD而使用免疫抑制剂,反过来会对免疫细胞的重建产生不良影响。有研究表明,淋巴细胞亚群在allo-HSCT后病人预防复发、GVHD、感染等方面有重要作用[5]。本文通过动态监测allo-HSCT后病人2年间淋巴细胞亚群水平的变化,探讨移植后免疫重建的规律及其与GVHD及病原微生物感染的关系,为临床减少移植相关并发症的发生、提高allo-HSCT的成功率和延长病人生存期提供依据。
1 对象和方法 1.1 研究对象选取2018年2月—2020年1月于青岛大学附属青岛市中心医院行allo-HSCT的成年血液病病人32例,其中男22例,女10例,中位年龄39(20~61)岁;其中急性白血病19例,骨髓增生异常综合征(MDS)8例,慢性髓细胞白血病2例,重型再生障碍性贫血3例;同胞供者移植27例,无血缘供者移植5例;供受者组织相容性白细胞抗原(HLA)全相合8例,半相合24例,其中28例病人移植前预处理方案中应用了抗胸腺细胞球蛋白(ATG);急性移植物抗宿主病(aGVHD)预防方案为:环孢素+甲氨蝶呤(MTX)+霉酚酸酯(MMF)29例,他克莫司+雷帕霉素+吗替麦考酚酯3例。移植后选择口服氟康唑或者泊沙康唑预防真菌感染,使用阿昔洛韦或更昔洛韦预防巨细胞病毒(CMV)感染,口服磺胺甲唑预防卡氏肺囊虫感染。
1.2 淋巴细胞亚群检测分别于清髓处理前3 d及allo-HSCT后14、30、90、180、365、730 d,采集病人外周静脉血2 mL于含有乙二胺四乙酸二钾(EDTA-K2)抗凝的采血管中,2 h内检测外周血淋巴细胞各亚群CD3+T细胞、CD4+T细胞、CD8+T细胞、CD16+CD56+ NK细胞、CD19+B细胞的计数。淋巴细胞亚群检测试剂CD3-FITC、CD4-APC、CD8-PE、CD19-APC、CD(16+56)-PE、CD45-Percp购自美国Becton Dickinson公司,Bricyte E6流式细胞仪购自迈瑞(mindray)公司。
1.3 病原微生物感染类型确定病毒感染确诊主要通过荧光定量PCR方法,细菌及真菌感染确诊主要通过病原菌培养鉴定,另有少部分病人感染病原体类型的确定根据二代测序技术完成。
1.4 统计学分析采用Excel及GraphPad Prism 6科研绘图工具绘图,采用SPSS 18.0软件进行统计分析。正态分布计量资料结果以x±s表示,组间比较采用t检验或t’检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 allo-HSCT后病人GVHD及感染发生情况纳入本研究的32例病人allo-HSCT后全部获造血重建。allo-HSCT后病人出现aGVHD 5例,慢性GVHD(cGVHD)17例;移植后180 d出现单纯病毒感染6例,单纯细菌感染8例,单纯真菌感染4例,混合感染9例,未出现感染5例。所有病人中因重度肺部感染死亡1例,其余随访至2023年1月仍存活。
2.2 allo-HSCT后病人淋巴细胞亚群重建情况与移植前相比,移植后14 d,病人淋巴细胞、CD3+T细胞、CD4+T细胞、CD8+T细胞、NK细胞以及B细胞水平均为最低值,淋巴细胞总数在移植后180 d接近移植前水平(P>0.05)。各淋巴细胞亚群中,NK细胞恢复最快,移植后不到30 d就恢复到移植前水平,30 d后明显超过移植前水平;CD3+T细胞在移植后90 d基本可以达到移植前水平;CD8+T细胞恢复速度仅次于NK细胞,移植后30 d基本恢复至移植前水平,90 d已超过移植前水平。与CD8+T细胞相比,CD4+T细胞恢复表现出明显延迟,到移植后730 d尚未恢复到移植前水平(t=10.476,P < 0.05),与之对应CD4+/CD8+比值到移植后730 d仍倒置。CD19+B细胞恢复速度也较慢,在移植后365 d超过移植前水平。其余时间各淋巴细胞亚群与移植前比较差异有显著性(t=2.185~73.002, P < 0.05)。见表 1。
| 表 1 病人移植前后外周血淋巴细胞亚群计数比较(n=32,ccell/106·L-1, x±s) |
|
|
移植后第90天,aGVHD组(n=5)CD3+T细胞(t’=3.334,P < 0.05)、CD4+T细胞(t=3.836,P < 0.05)和NK细胞(t=3.300,P < 0.05)绝对计数均低于non-aGVHD组(n=10);移植后第365天,cGVHD组(n=17)病人仅CD4+T细胞计数低于non-cGVHD组(n=10)(t=2.918,P < 0.05)。见图 1。
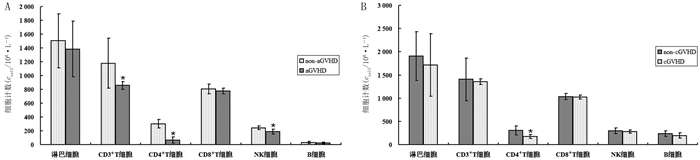 |
| A:移植后第90天aGVHD组(n=5)和non-aGVHD组(n=10)淋巴细胞亚群计数比较;B:移植后第365天cGVHD组(n=17)和non-cGVHD组(n=10)淋巴细胞亚群计数比较。*P < 0.05。 图 1 GVHD组和non-GVHD组淋巴细胞亚群计数比较 |
由于除CD4+T细胞外的其他淋巴细胞亚群在移植后第180天均恢复到移植前水平,故本研究选择移植后第180天分析32例病人淋巴细胞亚群与病原微生物感染的相关性。与无感染组(n=5)相比较,病毒感染组(n=6)淋巴细胞(t=2.441,P < 0.05)、CD4+T细胞(t=3.513,P < 0.05)、NK细胞(t=3.728,P < 0.05)、B细胞(t=2.937,P < 0.05)绝对计数降低;细菌感染组(n=8)淋巴细胞(t=2.535,P < 0.05)、CD4+T细胞(t’=6.726,P < 0.05)绝对计数降低,CD8+T细胞绝对计数值升高(t’=-2.945,P < 0.05);真菌感染组(n=4)CD4+T细胞绝对计数降低(t=2.579,P < 0.05),CD8+T细胞绝对计数值升高(t=2.423,P < 0.05);混合感染组(n=9)淋巴细胞(t=2.195,P < 0.05)、CD3+T细胞(t=2.649,P < 0.05)、CD4+T细胞(t=3.728,P < 0.05)、CD8+T细胞(t=2.579,P < 0.05)、B细胞(t=3.045,P < 0.05)和NK细胞(t=2.207,P < 0.05)绝对计数降低,差异均具有统计学意义。见图 2。
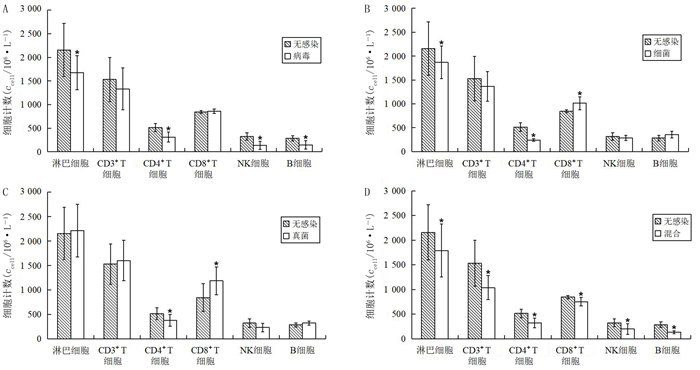 |
| A:病毒感染组与未感染组比较;B:细菌感染组与未感染组比较;C:真菌感染组与未感染组比较;D:混合感染组与未感染组比较。与未感染组相比,*P < 0.05。 图 2 不同类型病原体感染组与未感染组淋巴细胞亚群计数比较 |
相较于骨髓样本,外周血样本更简单易得,因此本研究探讨了接受allo-HSCT病人外周血中淋巴细胞及其主要亚群CD3+T细胞、CD4+T细胞、CD8+T淋巴细胞、NK细胞、B细胞重建规律以及淋巴细胞亚群与aGVHD以及感染之间的相关性。结果显示,最先恢复到移植前水平的是NK细胞,这可能是因为NK细胞是固有免疫系统中的一员,其发育成熟主要依赖骨髓微环境而不是胸腺[6]。此外,本研究结果显示,CD8+T细胞恢复速度明显快于CD4+T细胞,原因可能是allo-HSCT后CD8+T细胞主要依赖非胸腺依赖的来自供者移植物中的外周淋巴细胞扩增,而CD4+T淋巴细胞的重建主要依赖来自供者造血细胞增殖、分化并经受者胸腺培育产生。但是由于移植前后受者胸腺受损,导致移植后CD4+T细胞持续缺乏,CD4+T淋巴细胞的重建过程十分缓慢[7]。另外,有研究表明,预处理方案中使用ATG的病人移植后CD4+T细胞重建延迟[8]。本研究中有28例病人(87.5%)移植前预处理方案中使用了ATG,移植后B淋巴细胞恢复较慢,这可能是由于供者的记忆B细胞在移植后1年内的再激活潜力降低导致[9]。但是,移植后免疫细胞的重建受到诸如受者骨髓造血微环境、供者干细胞成分等多重因素的影响,因此还需更大样本量、更长时间的研究来完善结果[10]。
GVHD是allo-HSCT后的严重并发症之一,其诊断仍主要依赖临床表现,因此,找到一种能够早期诊断或者预测GVHD发生的指标,以便临床及时采取相应的防治措施十分重要。本文研究结果显示,aGVHD组CD3+T淋巴细胞、CD4+T细胞和NK细胞计数均低于non-aGVHD组,说明这几类细胞恢复的延迟可能与aGVHD发生密切相关。KIMD等[11]研究表明,CD4+T细胞重建的快慢与GVHD发生率相关,重建的速度越快,GVHD发生率越低。这是因为供者的CD4+T细胞对受者自身组织耐受,从而降低发生GVHD的风险[12]。另外,allo-HSCT后发生aGVHD病人的NK细胞数量较低,可能是因为NK细胞主要作用是增强干细胞植入的稳定性,从而减少GVHD的发生[13]。此外,NK细胞水平还与GVHD的严重程度相关。
本研究结果还显示,allo-HSCT后感染不同类型病原微生物病人外周血淋巴细胞亚群的变化不同,但所有感染病人的CD4+T淋巴细胞均低于未感染的病人。CD4+T细胞在抗感染免疫中发挥重要作用,其主要功能是分化为不同的Th亚群,通过分泌细胞因子引起炎症或者抑炎反应[14-15]。本文结果还显示,CD4+T淋巴细胞在allo-HSCT术后恢复的速度最慢,因此CD4+T细胞的缺乏可能是导致病人对病原微生物易感的主要原因之一;细菌感染以及真菌感染病人CD8+T细胞数目升高,可能是因为CD8+T细胞在移植早期即可恢复到正常水平,且这些来自供者的CD8+T细胞在受者体内迅速活化,从而发挥特异性免疫作用[16]。allo-HSCT后病人CD8+T细胞快速而良好的重建和感染发生率呈反比[17-18]。此外,NK细胞具有早期识别并清除病毒感染细胞的功能,同时体液免疫的主力军B淋巴细胞的延迟恢复也会影响其自身产生抗体的能力,从而导致病人抗击病毒的能力下降。因此,病毒感染的病人往往NK细胞和B细胞的数量降低[18]。因此,不同病原微生物感染对应不同淋巴细胞亚群的变化,这或许会为临床判断病原微生物感染的类型及预后提供有效依据。
综上所述,allo-HSCT后病人淋巴细胞亚群中,NK细胞最早恢复移植前水平,CD8+T细胞恢复速度明显快于CD4+T细胞;这几类细胞恢复重建的延迟可能与aGVHD的发生密切相关,CD4+T细胞在抗感染免疫中发挥重要作用。其具体的作用机制,以及如何通过改变移植后病人的淋巴细胞亚群以提高病人移植的成功率及生存质量,将是我们下一步的研究重点。
| [1] |
PATELS S, RYBICKI L A, CORRIGAN D, et al. Effect of bone marrow CD34+ cells and T-cell subsets on clinical outcomes after myeloablative allogeneic hematopoietic cell transplantation[J]. Bone Marrow Transplantation, 2019, 54(5): 775-781. DOI:10.1038/s41409-018-0380-5 |
| [2] |
万露露, 陈健琳, 徐诚, 等. 异基因造血干细胞移植后NK细胞重建与急性移植物抗宿主病相关性的研究[J]. 中国实验血液学杂志, 2017, 25(2): 530-534. |
| [3] |
URI A, LVHDER F, KERKAU T, et al. During acute graft versus host disease CD28 deletion in donor CD8+, but not CD4+, T cells maintain antileukemia responses in mice[J]. EuropeanJournal of Immunology, 2018, 48(12): 2055-2067. |
| [4] |
CHANGY J, ZHAOX Y, HUANGX J. Strategies for enhancing and preserving anti-leukemia effects without aggravating graft-versus-host disease[J]. Frontiers in Immunology, 2018, 9: 3041. DOI:10.3389/fimmu.2018.03041 |
| [5] |
HOLTICK U, FRENZEL L P, SHIMABUKURO-VORNHAGEN A, et al. CD4+ T cell counts reflect the immunosuppressive state of CD4 helper cells in patients after allogeneic stem cell transplantation[J]. Annalsof Hematology, 2015, 94(1): 129-137. DOI:10.1007/s00277-014-2166-1 |
| [6] |
ULLAHM A, HILLG R, TEYS K. Functional reconstitution of natural killer cells in allogeneic hematopoietic stem cell transplantation[J]. Frontiersin Immunology, 2016, 7: 144. |
| [7] |
PENG X G, DONG Y, ZHANG T T, et al. Immune reconstitution of CD4+T cells after allogeneic hematopoietic stem cell transplantation and its correlation with invasive fungal infection in patients with hematological malignancies[J]. Asian PacificJournal of Cancer Prevention: APJCP, 2015, 16(8): 3137-3140. DOI:10.7314/APJCP.2015.16.8.3137 |
| [8] |
BOSCH M, DHADDA M, HOEGH-PETERSEN M, et al. Immune reconstitution after anti-thymocyte globulin-conditioned hematopoietic cell transplantation[J]. Cytotherapy, 2012, 14(10): 1258-1275. DOI:10.3109/14653249.2012.715243 |
| [9] |
BOSCH M, KHANF M, STOREK J. Immune reconstitution after hematopoietic cell transplantation[J]. CurrentOpinionin Hematology, 2012, 19(4): 324-335. |
| [10] |
PEIX Y, ZHAOX Y, XUL P, et al. Immune reconstitution in patients with acquired severe aplastic anemia after haploidentical stem cell transplantation[J]. Bone Marrow Transplantation, 2017, 52(11): 1556-1562. DOI:10.1038/bmt.2017.174 |
| [11] |
KIMD H, SOHN S K, WON D I, et al. Rapid helper T-cell recovery above 200×106/L at 3 months correlates to successful transplant outcomes after allogeneic stem cell transplantation[J]. Bone Marrow Transplantation, 2006, 37(12): 1119-1128. DOI:10.1038/sj.bmt.1705381 |
| [12] |
CHAUDHRYM S, VELARDI E, MALARD F, et al. Immune reconstitution after allogeneic hematopoietic stem cell transplantation: time to T up the Thymus[J]. Journalof Immunology, 2017, 198(1): 40-46. |
| [13] |
GAO F, YE Y S, GAO Y, et al. Influence of KIR and NK cell reconstitution in the outcomes of hematopoietic stem cell transplantation[J]. Frontiersin Immunology, 2020, 11: 2022. DOI:10.3389/fimmu.2020.02022 |
| [14] |
MELENHORSTJ J, TIAN X, XU D H, et al. Cytopenia and leukocyte recovery shape cytokine fluctuations after myeloablative allogeneic hematopoietic stem cell transplantation[J]. Haematologica, 2012, 97(6): 867-873. DOI:10.3324/haematol.2011.053363 |
| [15] |
GUO H F, QIAO Z H, ZHU L, et al. Th1/Th2 cytokine profiles and their relationship to clinical features in patients following nonmyeloablative allogeneic stem cell transplantation[J]. AmericanJournalof Hematology, 2004, 75(2): 78-83. |
| [16] |
FREDERIKFALKENBURG J H, JEDEMA I. Graft versus tumor effects and why people relapse[J]. Hematology, 2017, 2017(1): 693-698. DOI:10.1182/asheducation-2017.1.693 |
| [17] |
CARVALHOA, LUCA A D, BOZZA S, et al. TLR3 essentially promotes protective class Ⅰ-restricted memory CD8+ T-cell responses to Aspergillus fumigatus in hematopoietic transplanted patients[J]. Blood, 2012, 119(4): 967-977. DOI:10.1182/blood-2011-06-362582 |
| [18] |
TIAND M, WANG Y, ZHANG X H, et al. Rapid recovery of CD3+CD8+ T cells on day 90 predicts superior survival after unmanipulated haploidentical blood and marrow transplantation[J]. PLoS One, 2016, 11(6): e0156777. |
 2024, Vol. 60
2024, Vol. 60

