2. 新乡医学院第一附属医院感染控制管理部,河南 新乡 453100
急性淋巴细胞白血病(ALL)在儿童肿瘤性疾病中占比约为1/3[1]。随着医疗水平的不断进步,ALL病儿的5年生存率已接近90%[2]。目前公认首选的ALL治疗方法为化疗,其疗效确切,但是化疗药物种类的增加和剂量的加大容易导致病儿出现相关器官受损,发生药物性肝损伤(DILI)等不良反应[3]。细胞角蛋白18-M30(CK18-M30)是一种肝脏中间丝蛋白,其表达与细胞形态学变化具有相关性[4]。CK18-M65也是CK-18的一个片段,其与肝细胞的坏死相关,对肝脏的炎性损伤有提示作用[5]。目前临床上对ALL病儿化疗引起的肝损伤的研究较少,国内鲜见对ALL病儿化疗后发生DILI的预测指标研究。因此,本研究探究血清CK18-M30、CK18-M65表达与ALL病儿化疗后发生DILI之间的关系,为降低ALL病儿化疗后发生DILI风险提供理论依据。现将结果报告如下。
1 资料与方法 1.1 研究对象选取新乡医学院第一附属医院2019年3月—2022年2月收治ALL病儿66例,根据是否发生DILI将病儿分为损伤组(观察组,49例)和非损伤组(对照组,17例)。根据DILI病情将观察组分为轻度(15例)、中度(24例)和重度(10例)亚组。DILI分级标准[6]:轻度,总胆红素 < 42.8 μmol/L,凝血酶原时间标准化比值(INR) < 1.5,碱性磷酸酶(ALP)和(或)丙氨酸转氨酶(ALT)水平呈可恢复性上升;中度,总胆红素为42.8~85.5 μmol/L,或INR>1.5,ALP和(或)ALT水平上升;重度,总胆红素≥85.5 μmol/L,血清ALP和(或)ALT水平上升。纳入标准:①符合ALL诊断标准[7];②观察组病儿符合《药物性肝损伤诊治指南》(2017版)中DILI诊断标准[6];③年龄1~14岁;④均为初治病例;⑤化疗前肝功能检测正常。排除标准:①混合型白血病;②合并基础肝脏疾病、病毒性肝炎等其他肝病或影响肝功能的疾病;③合并自身免疫病;④合并其他肿瘤者;⑤放弃积极治疗者。
1.2 研究方法采集病儿清晨外周血5 mL,以3 000 r/min离心10 min,取上清液置于-70 ℃环境下保存待检。采用酶联免疫吸附法分别检测血清CK18-M30和CK18-M65活力,试剂盒均购自苏州和锐生物科技有限公司。检测步骤严格按照试剂盒说明书进行。对两组及不同DILI病情类型病儿的血清CK18-M30和CK18-M65水平进行比较。
收集所有入组病儿的相关临床资料,包括性别、年龄、体质量指数(BMI)、ALL危险程度、有无感染和输血、是否应用保肝药等,并收集其在确诊ALL时肝功能指标(血清ALP、ALT、胆红素等),以及血清CK18-M30和CK18-M65检测结果。对影响ALL病儿DILI发生及其病情程度的因素进行单因素和多因素分析。采用受试者工作特征(ROC)曲线分析血清CK18-M30以及CK18-M65对ALL病儿发生DILI的预测价值。
1.3 统计学处理用SPSS 20.0软件进行统计分析。计数资料数据以例数和百分数表示,组间比较采用χ2检验。计量资料数据以x±s形式表示,两组均数比较采用两独立样本t检验;多组均数比较采用单因素方差分析,两两比较采用LSD法。采用多因素Logistic回归分析ALL病儿发生DILI的影响因素。采用ROC曲线分析血清CK18-M30和CK18-M65对ALL发生DILI的预测价值,联合预测采用Logistic回归模型。以P < 0.05为差异具有统计学意义。
2 结果 2.1 DILI及其病情程度对血清细胞角蛋白影响观察组血清CK18-M30和CK18-M65活力明显高于对照组,差异均有统计学意义(t=12.735、14.230,P < 0.05)。见表 1。观察组病儿DILI病情越重,血清CK18-M30和CK18-M65活力越高,差异有统计学意义(F=5.551、20.122,P < 0.05)。见表 2。
| 表 1 两组ALL病儿血清CK18-M30和CK18-M65比较(z/U·L-1,x±s) |
|
|
| 表 2 不同DILI病情程度血清CK18-M30和CK18-65比较(z/U·L-1,x±s) |
|
|
与对照组相比较,观察组ALL疾病危险程度较高,感染和输血病儿构成比较大,应用保肝药物病儿构成比较小,差异均有统计学意义(χ2=4.440~10.686,P < 0.05)。见表 3。
| 表 3 影响ALL病儿发生DILI的单因素分析 |
|
|
采用逐步回归分析变量选择方法(向后-条件)进行分析。根据单因素分析结果,以ALL病儿发生DILI为应变量,对自变量进行赋值:ALL疾病危险程度中、低危赋值0,高危赋值1;未感染赋值0,感染赋值1;未输血赋值0,输血赋值1;未应用保肝药物赋值0,应用保肝药物赋值1;血清CK18-M30、CK18-M65活力原值代入。结果显示,ALL疾病危险程度、感染、输血、血清CK18-M30和CK18-M65活力等均为ALL病儿发生DILI的危险因素(OR=1.869~2.866,95%CI=(1.205~1.799)~(2.773~4.257),P < 0.05),而保肝药应用则为其保护因素(OR=0.522,95%CI=0.395~0.670,P < 0.05)。见表 4。
| 表 4 影响ALL病儿发生DILI的多因素Logistic回归分析 |
|
|
ROC曲线分析结果显示,血清CK18-M30与CK18-M65活力预测ALL病儿发生DILI的曲线下面积(AUC)分别为0.739和0.699,灵敏度分别为79.6%和71.4%,特异度分别为68.2%和71.4%,两者联合预测的AUC为0.871,灵敏度和特异度分别为81.6%和90.9%。见表 5和图 1。
| 表 5 血清CK18-M30和CK18-M65预测DILI的ROC分析 |
|
|
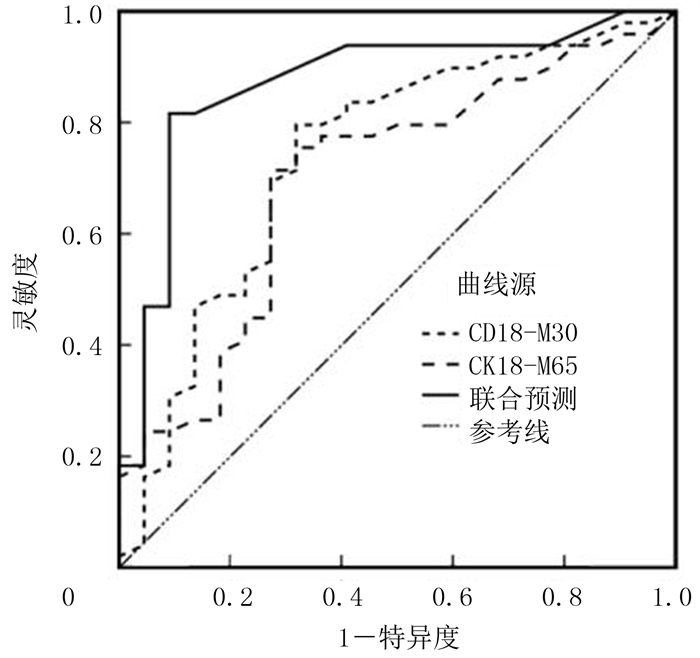 |
| 图 1 CK18-M30和CK18-M65预测DILI的ROC曲线 |
ALL目前的主要治疗方式为化疗,化疗过程中使用的多种药物对机体均会造成不同程度的损伤,常见的有血小板和白细胞减少,严重时甚至导致肝功能损伤[8-9]。DILI是ALL病儿治疗过程中的常见不良反应,大部分病儿在治疗过程中会出现ALT水平上升,并于停药后迅速恢复正常水平。
CK18是组成细胞骨架的重要成分,参与肝细胞的成熟过程[10-12]。当肝细胞出现坏死、凋亡与自噬时,CK18-M30和CK18-M65会被释放进入血液中,其在血清中的活力升高,因此CK18被视为肝细胞损伤的特异性标志之一[13-15]。有研究结果显示,CK18-M30和CK18-M65对于抗结核药物性肝损伤具有较高的鉴别诊断价值,其与其他肝功能指标如ALP、ALT等具有相似的临床意义[16-17]。CK18-M30和CK18-M65对肝功能损伤的诊断特异性较高,其原因为ALP等因子来源复杂,能由心脏、肾脏释放,当心脏和肾脏等出现损伤时,其表达水平也会出现异常[18-20]。BAE等[21]研究认为,CK18-M30对于慢性乙型肝炎病人发生显著炎症有预测价值,其表达水平与炎症分级之间存在相关性。LI等[22]的研究也得出相似的结论。DENG等[23]认为,CK18-M65能够预测非乙醇性脂肪性肝炎的发生。在本研究中,发生DILI的ALL病儿血清中CK18-M30和CK18-M65活力明显高于未发生者。ROC曲线分析显示,CK18-M30和CK18-M65对于接受治疗的ALL病儿发生DILI有较高的预测价值,两者联合预测效能更高。
ALL病儿在治疗期间容易出现肝功能异常,且该异常多无临床症状,导致临床上易出现漏诊。因此,明确ALL病儿发生DILI的危险因素,并对危险因素进行干预,这对疾病治疗有较高的指导价值。在本研究的观察组病儿中,中轻度DILI病儿构成比较大,重度者较少,出现该结果的原因可能是儿童具有较强的肝脏代谢能力和再生能力,同时在对病儿进行化疗时,大都进行了保肝治疗[24-25]。本文不同性别ALL病儿在接受治疗后发生DILI的风险无差异。但是有研究显示,ALL病人中女性并发DILI的风险相较于男性更高,其原因为女性对药物敏感性更高;同时也有动物实验研究显示,雌激素和雄激素会对肝脏药物的代谢产生不同的影响[26-28]。而本研究中不同性别病儿之间DILI发生率无差异,其原因可能与研究纳入样本量较小有关。
有研究结果表明,高危型ALL病儿发生DILI的风险高于中低危型者,但也有研究显示中危型病儿DILI发生率更高[29-30]。本文的研究结果与其不一致的原因可能为化疗方案和个体差异性之间存在相关性,需要在未来的研究中加大样本量深入分析。在ALL化疗的各阶段应用保肝药物对于病儿发生DILI有较高的抑制作用。本研究结果还显示,化疗过程中感染和输血均会使病儿DILI风险增高。其原因为发生感染的病儿会释放大量炎性因子,导致肝脏组织受到损伤[31-32]。另一方面,感染病儿需要接受抗生素治疗,而抗生素的使用会加剧肝损伤程度[33-34]。此外,感染还会激活人体免疫机制,加重肝细胞的免疫损伤[35-36]。输血病儿存在骨髓抑制,这可能是由于化疗药物使用剂量较大造成的,而机体在此状态下,更易发生肝功能异常[37-38]。本研究多因素Logistic回归分析也显示,ALL疾病危险程度、感染、输血、血清CK18-M30和CK18-M65活力等均为ALL病儿发生DILI的危险因素,而保肝药应用为其保护因素。
综上所述,ALL病儿血清CK18-M30和CK18-M65活力可作为发生DILI的预测指标,其血清活力越高,疾病危险程度越高,发生DILI的风险越高,且化疗过程中感染和输血均为发生DILI的危险因素,需要对这些因素进行干预。而应用保肝药物进行干预,可以降低DILI的发生风险。
| [1] |
徐祖超, 刘艳冰. 联合检测miR-195、SOCS3 mRNA、miR-210对急性淋巴细胞性白血病的诊断价值分析[J]. 广州医科大学学报, 2021, 49(2): 54-60. DOI:10.3969/j.issn.2095-9664.2021.02.11 |
| [2] |
DUFFIELD A S, MULLIGHAN C G, BOROWITZ M J. International Consensus Classification of acute lymphoblastic leukemia/lymphoma[J]. Virchows Archiv: an International Journal of Pathology, 2023, 482(1): 11-26. DOI:10.1007/s00428-022-03448-8 |
| [3] |
王嘉怡, 林慧玲, 黄儒霖, 等. 6-巯嘌呤片剂不同分割法治疗儿童急性淋巴细胞白血病的疗效和不良反应比较[J]. 儿科药学杂志, 2023, 29(2): 23-26. |
| [4] |
刘吉祥, 谭礼让, 金军. 血清细胞角蛋白18裂解片段M30、前白蛋白和血小板衍生生长因子在乙型肝炎病毒感染相关疾病进展和预后中的价值[J]. 中西医结合护理, 2020, 6(4): 65-71. |
| [5] |
ZDANOWICZ K, OLANSKI W, KOWALCZUK-KRYSTON M, et al. Total keratin-18 (M65) as a potential, early, non-invasive biomarker of hepatocyte injury in alcohol intoxicatedadolescents-a preliminary study[J]. Biomolecules, 2021, 11(6): 911. DOI:10.3390/biom11060911 |
| [6] |
于乐成, 茅益民, 陈成伟. 药物性肝损伤诊治指南[J]. 临床肝胆病杂志, 2015, 31(11): 1752-1769. DOI:10.3969/j.issn.1001-5256.2015.11.002 |
| [7] |
中华医学会儿科学分会血液学组, 《中华儿科杂志》编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第4次修订)[J]. 中华儿科杂志, 2014, 52(9): 641-644. DOI:10.3760/cma.j.issn.0578-1310.2014.09.001 |
| [8] |
王苗, 沈树红. 6-巯嘌呤对维持治疗期急性淋巴细胞白血病患儿的不良反应及其个体化治疗研究现状[J]. 国际输血及血液学杂志, 2021, 44(2): 93-100. DOI:10.3760/cma.j.cn511693-20200809-00165 |
| [9] |
杨春会, 段绍琴, 崔婷婷, 等. NUDT15基因多态性与云南省彝族儿童急性淋巴细胞白血病相关性研究[J]. 安徽医药, 2020, 24(3): 492-496. DOI:10.3969/j.issn.1009-6469.2020.03.018 |
| [10] |
李雪娇, 何文姬, 郭俊梅, 等. SWE观察儿童急性淋巴细胞白血病化疗后药物性肝损伤的保肝治疗效果[J]. 医学影像学杂志, 2023, 33(6): 1040-1043. |
| [11] |
师锐赞, 牛亚楠, 高宇, 等. 细胞角蛋白18下调增加非肌肉肌球蛋白ⅡA表达促进乳腺癌转移[J]. 中国药理学通报, 2022, 38(6): 861-865. DOI:10.12360/CPB202111110 |
| [12] |
胡盛龙, 赵莉, 庄立琨, 等. 血清细胞角蛋白-18水平与经磁共振成像质子密度脂肪分数量化的肝脏脂肪变性程度的相关性[J]. 实用医学杂志, 2022, 38(9): 1102-1107. DOI:10.3969/j.issn.1006-5725.2022.09.011 |
| [13] |
姜浩, 谢卓君, 张昊东, 等. Wnt5b过表达对小鼠胚胎肝干细胞分化的影响及其对小鼠慢性肝损伤的修复作用[J]. 解剖学报, 2022, 53(4): 461-469. |
| [14] |
KORVER S, BOWEN J, PEARSON K, et al. The application of cytokeratin-18 as a biomarker for drug-induced liver injury[J]. Archives of Toxicology, 2021, 95(11): 3435-3448. DOI:10.1007/s00204-021-03121-0 |
| [15] |
RUPPRECHTER S A E, SLOAN D J, OOSTHUYZEN W, et al. MicroRNA-122 and cytokeratin-18 have potential as a biomarkers of drug-induced liver injury in European and African patients on treatment for mycobacterial infection[J]. British Journal of Clinical Pharmacology, 2021, 87(8): 3206-3217. DOI:10.1111/bcp.14736 |
| [16] |
勾阳阳, 曾广娴, 喻嵘, 等. 2型糖尿病合并非酒精性脂肪性肝病肝细胞损伤模型的建立及探讨[J]. 湖南中医药大学学报, 2023, 43(1): 47-52. |
| [17] |
卓海燕, 何兰兰, 吴伟杰, 等. 抗结核药物性肝损伤患者血清细胞角蛋白18-M30与M65的临床意义的探讨[J]. 海峡药学, 2023, 35(1): 104-107. |
| [18] |
ANTOINE D J, DEAR J W, LEWIS P S, et al. Mechanistic biomarkers provide early and sensitive detection of acetaminophen-induced acute liver injury at first presentation to hospital[J]. Hepatology, 2013, 58(2): 777-787. DOI:10.1002/hep.26294 |
| [19] |
PICKKERS P, ANGUS D C, AREND J, et al. Study protocol of a randomised, double-blind, placebo-controlled, two-arm parallel-group, multi-centre phase 3 pivotal trial to investigate the efficacy and safety of recombinant human alkaline phosphatase for treatment of patients with sepsis-associated acute kidney injury[J]. BMJ Open, 2023, 13(4): e065613. DOI:10.1136/bmjopen-2022-065613 |
| [20] |
ALTERIIS G D, PUGLIESE G, SARNO A D, et al. Visceral obesity and cytokeratin-18 antigens as early biomarkers of liver damage[J]. International Journal of Molecular Sciences, 2023, 24(13): 10885. |
| [21] |
BAE C B, KIM S S, AHN S J, et al. Caspase-cleaved fragments of cytokeratin-18 as a marker of inflammatory activity in chronic hepatitis B virus infection[J]. Journal of Clinical Virology: the Official Publication of the Pan American Society for Clinical Virology, 2013, 58(4): 641-646. |
| [22] |
LI J, VERHAAR A P, PAN Q W, et al. Serum levels of caspase-cleaved cytokeratin 18 (CK18-Asp396) predict severity of liver disease in chronic hepatitis B[J]. Clinical and Expe-rimental Gastroenterology, 2017, 10: 203-209. |
| [23] |
DENG H, WANG C L, LAI J, et al. Noninvasive diagnosis of hepatic steatosis using fat attenuation parameter measured by FibroTouch and a new algorithm in CHB patients[J]. Hepatitis Monthly, 2016, 16(9): e40263. |
| [24] |
蔡琼, 杨星月, 李芝奇, 等. 基于机体状态和功能因素探讨药物诱导肝损伤的研究进展[J]. 中草药, 2022, 53(17): 5523-5530. |
| [25] |
李春杏, 李云杉, 刘丽艳, 等. 基于倾向性评分匹配法探讨不同种数保肝药物联用对药物性肝损伤治疗效果差异[J]. 中国新药与临床杂志, 2023, 42(5): 317-322. |
| [26] |
AMACHER D E. Female gender as a susceptibility factor for drug-induced liver injury[J]. Human & Experimental Toxico-logy, 2014, 33(9): 928-939. |
| [27] |
LEE C B, KIM J, HAN J, et al. Formyl peptide receptor 2 determines sex-specific differences in the progression of nonalcoholic fatty liver disease and steatohepatitis[J]. Nature Communications, 2022, 13(1): 578. |
| [28] |
李宇, 樊晖晖, 冯晓俊, 等. ABCB1 C3435T基因多态性与甲氨蝶呤治疗儿童急性淋巴细胞白血病安全性Meta分析[J]. 中国药物警戒, 2022, 19(4): 421-425. |
| [29] |
王磊, 赵颖, 孙文利, 等. 大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病血药浓度安全性的实证研究[J]. 中国药师, 2022, 25(11): 1969-1975. |
| [30] |
李白, 刘健, 毛舒婷, 等. 基于RUCAM量表的儿童急性淋巴细胞白血病化疗药物性肝损伤分析[J]. 中华实用儿科临床杂志, 2019, 34(3): 200-204. |
| [31] |
SUTTI S, TACKE F. Liver inflammation and regeneration in drug-induced liver injury: sex matters![J]. Clinical Science, 2018, 132(5): 609-613. |
| [32] |
谢菁, 周曼, 侯以林, 等. 巨细胞病毒感染对非酒精性脂肪性肝病血清miRNA-9和miRNA-122a水平及肝损伤的影响[J]. 中华医院感染学杂志, 2022, 32(11): 1678-1682. |
| [33] |
杨晨晨, 田居灵, 魏琴, 等. PD-1/PD-L1及相关炎症因子在细粒棘球蚴感染致肝损伤中的免疫调节作用[J]. 中国人兽共患病学报, 2022, 38(4): 297-302. |
| [34] |
林良沫, 洪绵慧, 吴丹娜, 等. 血药浓度监测与伏立康唑致肝损伤的发生情况及影响因素分析[J]. 中国感染与化疗杂志, 2023, 23(6): 709-714. |
| [35] |
沈军, 王建设. 疱疹病毒感染与儿童肝损伤[J]. 中国实用儿科杂志, 2022, 37(7): 490-493. |
| [36] |
陈茜楠, 徐琰, 刘晓昌, 等. 105例药物性胆汁淤积型肝损伤患者临床特征分析[J]. 安徽医科大学学报, 2023, 58(6): 1036-1040. |
| [37] |
王宇, 黄婧怡, 侯立新, 等. 社区获得性肺炎患者抗生素相关性肝损伤外周血体液免疫特点分析[J]. 中国药物警戒, 2023, 20(2): 132-135, 139. |
| [38] |
何丹. 戊二醛聚合血红蛋白对环磷酰胺所致骨髓抑制及肝肾损伤小鼠的保护作用[D]. 西安: 西北大学, 2021.
|
 2024, Vol. 60
2024, Vol. 60

