2. 滨州医学院基础医学院生理学教研室
慢性肾脏疾病(CKD)是一种临床病理综合征,以持续的肾脏结构和(或)功能发生改变为特征[1]。临床上,顺铂作为一种强效的化疗药物,长期使用会导致CKD的发生[2]。为了更好地模拟临床化疗药物对肾脏的影响,往往通过反复低剂量顺铂注射来诱导啮齿类动物CKD[3]。目前顺铂注射构建CKD动物模型的方式并不统一,急需建立一种恰当的动物模型来研究顺铂诱导CKD的病理生理学以及发生机制。因此,本文对顺铂构建临床相关CKD模型的方法及其影响因素作一综述。
1 CKD动物模型目前为止,构建CKD动物模型方式很多。肾单侧缺血再灌注(UIRI)模型很早被建立并经常被使用[4]。UIRI模型是通过微型血管夹阻断一侧肾脏血流。在此模型中,由于对侧肾脏结构和功能完好,小鼠得以长期存活,并逐步发展成CKD。此模型模拟了人类CKD的功能学改变(肾小球滤过率降低、肌酐清除率降低以及血尿素氮增加等)和病理学改变(肾小管扩张、肾小管间质纤维化以及肾小球硬化等)。
其他啮齿类动物CKD模型包括双侧缺血再灌注损伤(BIRI)[5]、单侧输尿管梗阻(UUO)[6]、链脲佐菌素诱导糖尿病肾病[7]以及基因小鼠模型(db/db小鼠和ob/ob小鼠)[8]等。BIRI和UUO小鼠模型需要进行手术操作,存在手术操作失误及感染导致小鼠死亡的风险;UUO小鼠模型常被用来研究肾小管间质纤维化的机制,但并不能展示CKD模型的所有特性。不同动物模型展示了CKD不同的病理生理学变化,例如,链脲佐菌素单独使用或与其他药物联合使用,用于诱导1型或2型糖尿病[7]。
另外,反复低剂量顺铂注射作为研究慢性肾损伤模型的方式被广泛接受,因为这种干预模式模拟了临床肿瘤病人长期接受化疗所引起的CKD中可见的大多数结构以及功能变化[9]。顺铂注射造成啮齿类动物血中的尿素氮、肌酐含量升高,蛋白尿产生以及肾小管扩张和间质纤维化,这些功能学以及病理学变化和人类CKD的病理生理学变化一致[10]。虽然造模过程中避免了手术操作的繁琐及感染后死亡的风险,但也存在局限性,反复顺铂注射会导致啮齿类动物死亡,影响其成模效率[11]。
2 优化顺铂构建的CKD模型肿瘤病人接受顺铂治疗逐步发展为CKD,目前尚缺乏合理的干预措施,主要原因之一在于缺乏合适的动物模型。在过去研究中,顺铂构建啮齿类动物模型主要被用于研究急性肾毒性损伤[12-13],而在啮齿类动物CKD中的研究较少。单次低剂量顺铂注射(小鼠:5~8 mg/kg;大鼠:1~3 mg/kg)仅引起肾脏轻微的损伤,在顺铂注射后4~5 d,小鼠肾脏组织形态学和功能学发生改变,分别表现为细胞核轻度嗜碱性以及出现少量坏死细胞和血糖升高及肾小球滤过率降低等[14-16]。重要的是,低剂量顺铂注射不会引起血尿素氮或血肌酐水平改变。而单次高剂量顺铂注射(小鼠:10~13 mg/kg;大鼠:3~8 mg/kg)后1~2 d出现线粒体减少、局部肾小管刷状缘丢失以及胞浆小泡增多;注射后3~4 d出现刷状缘大量丢失以及坏死细胞脱落入肾小管管腔[17-18];而血尿素氮和血肌酐在注射后的3~7 d明显降低,到第14天才恢复到基线[19]。显而易见,顺铂注射量的提高会导致啮齿类动物肾脏损伤严重,修复期也相应延长。当肾脏修复能力无法代偿时,逐渐发展成CKD。早期,有学者试图通过提高单次顺铂注射剂量来构建啮齿类动物CKD模型。研究表明,单次高剂量顺铂注射(3~8 mg/kg)不仅引起大鼠急性肾毒性,还会对大鼠肾脏结构和功能产生长期影响[20-21]。在顺铂注射的第20天后,大鼠肾脏出现间质纤维化和肾小管扩张[21]。虽然这种单次高剂量顺铂造模的方式很简单,但无法有效模拟临床肿瘤病人长期接受顺铂治疗引起的CKD,并且高剂量顺铂注射会大大增加啮齿类动物的死亡率,导致成模率降低[3]。因此,反复低剂量顺铂注射成为CKD造模的更好方式。在过去数十年中,为了更好地模拟临床病人顺铂化疗的真实情境,造模过程中顺铂注射的剂量及次数不断调整。DU等[22]构建了异种移植瘤和同基因肿瘤小鼠模型,并对这些荷瘤小鼠每周注射10 mg/kg顺铂,持续3~4周,小鼠出现明显的CKD病理特征。2016年TORRES等[23]对C57BL/6小鼠注射15 mg/kg顺铂,间隔2周再次注射,在第9周和第16周时小鼠肾功能显著降低和出现间质纤维化。与此同时,SHARP等[3]比较了单剂量(25 mg/kg,注射1次)和反复低剂量(7或9 mg/kg,每周1次,注射4次)顺铂注射后的造模效果。研究发现,反复低剂量顺铂注射后,炎症性趋化因子及细胞因子表达显著增加,纤维化标志物表达显著升高。同时,与7 mg/kg顺铂的注射剂量相比较,9 mg/kg剂量顺铂注射导致约10% FVB/n小鼠死亡。同样,有研究通过对C57BL/6小鼠在第0、1和3周腹腔注射10 mg/kg顺铂发现,此CKD模型小鼠在第3周出现小管扩张和中度肾脏间质纤维化,并在第4周加重。虽然注射次数从2次到7次均进行过尝试,但大多数研究更加倾向于使用每周注射1次,连续注射4次的造模方式(图 1)[24]。
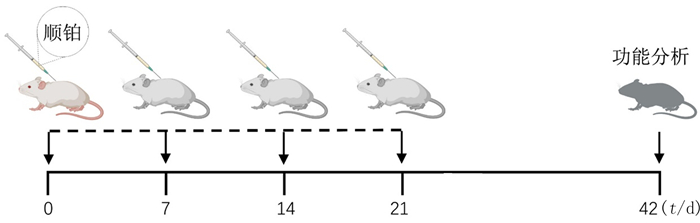 |
| 图 1 多次顺铂注射构建慢性肾脏纤维化模型 |
除了注射剂量及次数影响模型,啮齿类动物种属、性别和年龄等因素都会对造模结果产生影响。顺铂肾毒性的易感程度具有种属特异性。据研究报道,相较于小鼠,大鼠对顺铂的肾毒性更加敏感[25]。另外,不同啮齿类动物品系对顺铂诱导CKD动物模型具有影响。目前公认,C57BL/6小鼠对肾脏纤维化和CKD相关的肾小球改变以及对发展肾小管间质纤维化具有抵抗作用[26-27]。作者团队构建了相对稳定的顺铂诱导CKD动物模型,研究发现,6~8周龄C57BL/6小鼠在顺铂注射的第42天,出现CKD相关的慢性炎症以及轻度肾脏间质纤维化(纤维化面积占10%~30%),而在第24天时未出现明显纤维化[11]。由于此品系对肾脏纤维化的抵抗作用,导致成模周期需要42 d。SHARP等[3]对8周龄FVB小鼠注射7 mg/kg顺铂,连续注射4次,发现小鼠肾脏出现肾小管间质纤维化,然而,小鼠血肌酐及血尿素氮并未有显著性变化。
衰老已被认为是肾损伤加重的一个危险因素,而且老年病人肾脏结构发生改变,肾功能降低,对肾毒性更加敏感,发展为CKD的概率也更大[1, 28]。研究发现,啮齿类动物周龄的差异对顺铂肾毒性较为敏感,周龄大的大鼠比周龄小的大鼠更易发生肾脏顺铂堆积,且更易发生肾间质纤维化[29-30]。另外,有研究发现,周龄大的129Sv小鼠及SD大鼠对顺铂更加敏感,肾脏损伤更加严重[31],同样的结果在C57BL/6小鼠上得到验证[11]。然而,SHARP等[32]认为中度衰老并不会加重顺铂诱导的肾脏损伤及后期的纤维化程度。
此外,性别对顺铂构建啮齿类动物CKD模型的影响值得关注。一些研究者发现雄性Wistar大鼠对顺铂肾毒性的易感性高于雌性Wistar大鼠;另一些研究者则并没有发现性别在其中发挥的作用[33]。研究者同样在小鼠上进行了实验,结果显示,雄性C57BL/6小鼠对顺铂肾毒性更敏感[34];另外一些研究则发现雌性C57BL/6J和129Sv小鼠更敏感[35]。因此,性别对构建CKD模型的影响仍有待考究。
既往研究显示,要优化顺铂诱导的CKD动物模型,应重点关注啮齿类动物顺铂注射剂量及次数,同时种属、性别和年龄等因素也不可忽视。
3 顺铂诱导的CKD模型在多种药理学化合物临床疗效试验中的应用顺铂诱导的CKD动物模型,除了被用于阐明CKD的病理机制外,也被用于测试药物、化学物质和天然化合物等的治疗效果。表 1列举了一些以顺铂诱导的CKD动物模型为平台的实验。表中列出的化合物都处于临床前阶段,用于测试CKD的治疗效果。
| 表 1 顺铂诱导的CKD动物模型在测试药物、化学物质和天然产物治疗效果中的应用 |
|
|
关于表 1,在不考虑何种化学物质治疗的情况下,所有的顺铂诱导CKD模型最终都可能以氧化损伤作为导致肾脏炎症和纤维化的共同机制。因此,应用表 1中抗氧化物质的复合物能够有效治疗顺铂诱导的慢性肾脏损伤。然而,探讨化合物/化学物质对抗顺铂导致的慢性肾脏损伤的机制需要进行多次实验验证,这是由于各个实验室的测试条件及实验设计各不相同。另外,从表中可以发现多种物质的联合使用或许能够为CKD病人提供协同效益。
4 总结与展望长期以来,顺铂治疗癌症这一方式得到广泛认可,顺铂被认为是一种高效的抗肿瘤药物,但长期使用顺铂化疗会导致临床病人CKD的发生。目前对于顺铂引起的CKD的病理生理学变化及机制尚不清楚,需要进一步研究顺铂的作用途径及信号通路来帮助了解顺铂诱导CKD的发病机制。新的治疗或诊断方法的发现主要通过动物模型研究,因此,构建一个简单易行、可复制和稳定的CKD实验模型是必不可少的步骤。迄今为止,尚未有一个良好的模型来模拟临床上顺铂诱导的CKD。本文阐述了顺铂构建CKD模型的影响因素,包括顺铂剂量及次数、小鼠性别、年龄和种属差异等。因此,可以通过CKD动物模型来探索顺铂引起的慢性肾脏损伤的治疗策略,为临床病人减轻副作用。
| [1] |
FERENBACH D A, BONVENTRE J V. Mechanisms of ma-ladaptive repair after AKI leading to accelerated kidney ageing and CKD[J]. Nature Reviews Nephrology, 2015, 11(5): 264-276. DOI:10.1038/nrneph.2015.3 |
| [2] |
DUAN Z Y, CAI G Y, LI J J, et al. Cisplatin-induced renal toxicity in elderly people[J]. Therapeutic Advances in Medical Oncology, 2020, 12: 1758835920923430. |
| [3] |
SHARP C N, DOLL M A, DUPRE T V, et al. Repeated administration of low-dose cisplatin in mice induces fibrosis[J]. American Journal of Physiology Renal Physiology, 2016, 310(6): F560-F568. DOI:10.1152/ajprenal.00512.2015 |
| [4] |
ZAGER R A, JOHNSON A C M, BECKER K. Acute unila-teral ischemic renal injury induces progressive renal inflammation, lipid accumulation, histone modification, and end-stage kidney disease[J]. American Journal of Physiology Renal Physiology, 2011, 301(6): F1334-F1345. DOI:10.1152/ajprenal.00431.2011 |
| [5] |
LEE K, JANG H R, JEON J, et al. Repair phase modeling of ischemic acute kidney injury: recovery vs. transition to chronic kidney disease[J]. American Journal of Translational Research, 2022, 14(1): 554-571. |
| [6] |
CHEVALIER R L, FORBES M S, THORNHILL B A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy[J]. Kidney International, 2009, 75(11): 1145-1152. DOI:10.1038/ki.2009.86 |
| [7] |
TESCH G H, ALLEN T J. Rodent models of streptozotocin-induced diabetic nephropathy[J]. Nephrology, 2007, 12(3): 261-266. DOI:10.1111/j.1440-1797.2007.00796.x |
| [8] |
ALLEN T J, COOPER M E, LAN H Y. Use of genetic mouse models in the study of diabetic nephropathy[J]. Current Diabetes Reports, 2004, 4(6): 435-440. DOI:10.1007/s11892-004-0053-1 |
| [9] |
RAVICHANDRAN K, WANG Q, OZKOK A, et al. CD4 T cell knockout does not protect against kidney injury and wor-sens cancer[J]. Journal of Molecular Medicine, 2016, 94(4): 443-455. DOI:10.1007/s00109-015-1366-z |
| [10] |
PERŠE M, VEĈERIĈ-HALER Ž. Cisplatin-induced rodent model of kidney injury: characteristics and challenges[J]. BioMed Research International, 2018, 2018: 1462802. |
| [11] |
王鑫, 李慧, 王向东, 等. 顺铂注射对C57BL/6小鼠肾脏功能和结构影响[J]. 青岛大学学报(医学版), 2021, 57(6): 801-806. |
| [12] |
LI J Z, XU Z, JIANG L, et al. Rictor/mTORC2 protects against cisplatin-induced tubular cell death and acute kidney injury[J]. Kidney International, 2014, 86(1): 86-102. DOI:10.1038/ki.2013.559 |
| [13] |
SOLANKI M H, CHATTERJEE P K, XUE X Y, et al. Magnesium protects against cisplatin-induced acute kidney injury without compromising cisplatin-mediated killing of an ovarian tumor xenograft in mice[J]. American Journal of Physiology Renal Physiology, 2015, 309(1): F35-F47. DOI:10.1152/ajprenal.00096.2015 |
| [14] |
WAINFORD R D, WEAVER R J, STEWART K N, et al. Cisplatin nephrotoxicity is mediated by gamma glutamyltranspeptidase, not via a C-S lyase governed biotransformation pathway[J]. Toxicology, 2008, 249(2-3): 184-193. DOI:10.1016/j.tox.2008.05.006 |
| [15] |
JODRELL D I, NEWELL D R, MORGAN S E, et al. The renal effects of N10-propargyl-5, 8-dideazafolic acid (CB3717) and a non-nephrotoxic analogue ICI D1694, in mice[J]. British Journal of Cancer, 1991, 64(5): 833-838. DOI:10.1038/bjc.1991.409 |
| [16] |
MCKEAGE M J, MORGAN S E, BOXALL F E, et al. Lack of nephrotoxicity of oral ammine/amine platinum (Ⅳ) dicarboxylate complexes in rodents[J]. British Journal of Cancer, 1993, 67(5): 996-1000. DOI:10.1038/bjc.1993.182 |
| [17] |
DOBYAN D C, LEVI J, JACOBS C, et al. Mechanism of cis-platinum nephrotoxicity: Ⅱ. morphologic observations[J]. The Journal of Pharmacology and Experimental Therapeutics, 1980, 213(3): 551-556. |
| [18] |
SINGH G. A possible cellular mechanism of cisplatin-induced nephrotoxicity[J]. Toxicology, 1989, 58(1): 71-80. DOI:10.1016/0300-483X(89)90105-4 |
| [19] |
MIZUSHIMA Y, NAGAHAMA H, YOKOYAMA A, et al. Studies on nephrotoxicity following a single and repeated administration of cis-diamminedichloroplatinum (CDDP) in rats[J]. The Tohoku Journal of Experimental Medicine, 1987, 151(2): 129-135. DOI:10.1620/tjem.151.129 |
| [20] |
YAMATE J, MACHIDA Y, IDE M, et al. Cisplatin-induced renal interstitial fibrosis in neonatal rats, developing as solitary nephron unit lesions[J]. Toxicologic Pathology, 2005, 33(2): 207-217. DOI:10.1080/01926230490523978 |
| [21] |
BEHLING E B, SENDÃO M C, FRANCESCATO H D, et al. Comparative study of multiple dosage of quercetin against cisplatin-induced nephrotoxicity and oxidative stress in rat kidneys[J]. Pharmacological Reports, 2006, 58(4): 526-532. |
| [22] |
DU Y, ZHAO Y J, LI C, et al. Inhibition of PKCδ reduces amyloid-β levels and reverses Alzheimer disease phenotypes[J]. The Journal of Experimental Medicine, 2018, 215(6): 1665-1677. DOI:10.1084/jem.20171193 |
| [23] |
TORRES R, VELAZQUEZ H, CHANG J J, et al. Three-dimensional morphology by multiphoton microscopy with clea-ring in a model of cisplatin-induced CKD[J]. Journal of the American Society of Nephrology, 2016, 27(4): 1102-1112. DOI:10.1681/ASN.2015010079 |
| [24] |
KATAGIRI D, HAMASAKI Y, DOI K, et al. Interstitial renal fibrosis due to multiple cisplatin treatments is ameliorated by semicarbazide-sensitive amine oxidase inhibition[J]. Kidney International, 2016, 89(2): 374-385. DOI:10.1038/ki.2015.327 |
| [25] |
KATAYAMA R, NAGATA S, ⅡDA H, et al. Possible role of cysteine-S-conjugate β-lyase in species differences in cisplatin nephrotoxicity[J]. Food and Chemical Toxicology, 2011, 49(9): 2053-2059. DOI:10.1016/j.fct.2011.05.017 |
| [26] |
WALKIN L, HERRICK S E, SUMMERS A, et al. The role of mouse strain differences in the susceptibility to fibrosis: a syste-matic review[J]. Fibrogenesis & Tissue Repair, 2013, 6(1): 18. |
| [27] |
SUGIMOTO H, GRAHOVAC G, ZEISBERG M, et al. Renal fibrosis and glomerulosclerosis in a new mouse model of diabetic nephropathy and its regression by bone morphogenic protein-7 and advanced glycation end product inhibitors[J]. Diabetes, 2007, 56(7): 1825-1833. DOI:10.2337/db06-1226 |
| [28] |
SOBAMOWO H, PRABHAKAR S S. The kidney in aging: physiological changes and pathological implications[J]. Progress in Molecular Biology and Translational Science, 2017, 146: 303-340. |
| [29] |
APPENROTH D, WINNEFELD K, BRÄUNLICH H. Nephrotoxicity and pharmacokinetics of cisplatinum in young and adult rats[J]. Biomedica Biochimica Acta, 1988, 47(8): 791-797. |
| [30] |
YAMATE J, TATSUMI M, NAKATSUJI S, et al. Immunohistochemical observations on the kinetics of macrophages and myofibroblasts in rat renal interstitial fibrosis induced by cis-diamminedichloroplatinum[J]. Journal of Comparative Patho-logy, 1995, 112(1): 27-39. DOI:10.1016/S0021-9975(05)80087-8 |
| [31] |
SHI M J, MCMILLAN K L, WU J X, et al. Cisplatin nephrotoxicity as a model of chronic kidney disease[J]. Laboratory Investigation, 2018, 98(8): 1105-1121. DOI:10.1038/s41374-018-0063-2 |
| [32] |
SHARP C N, DOLL M, DUPRE T V, et al. Moderate aging does not exacerbate cisplatin-induced kidney injury or fibrosis despite altered inflammatory cytokine expression and immune cell infiltration[J]. American Journal of Physiology Renal Physiology, 2019, 316(1): F162-F172. DOI:10.1152/ajprenal.00463.2018 |
| [33] |
ESHRAGHI-JAZI F, NEMATBAKHSH M. Sex Difference in Cisplatin-Induced Nephrotoxicity: Laboratory and Clinical Findings[J]. J Toxicol, 2022, 2022: 3507721. |
| [34] |
TOWNSEND D M, TEW K D, HE L, et al. Role of gluta-thione S-transferase pi in cisplatin-induced nephrotoxicity[J]. Biomedecine & Pharmacotherapie, 2009, 63(2): 79-85. |
| [35] |
WEI Q Q, WANG M H, DONG Z. Differential gender diffe-rences in ischemic and nephrotoxic acute renal failure[J]. American Journal of Nephrology, 2005, 25(5): 491-499. DOI:10.1159/000088171 |
| [36] |
LI C Z, XIE N, LI Y, et al. N-acetylcysteine ameliorates cisplatin-induced renal senescence and renal interstitial fibrosis through sirtuin1 activation and p53 deacetylation[J]. Free Radical Biology & Medicine, 2019, 130: 512-527. |
| [37] |
GUO X J, XU L Y, VELAZQUEZ H, et al. Kidney-targeted renalase agonist prevents cisplatin-induced chronic kidney di-sease by inhibiting regulated necrosis and inflammation[J]. Journal of the American Society of Nephrology, 2022, 33(2): 342-356. DOI:10.1681/ASN.2021040439 |
| [38] |
LI C Z, SHEN Y T, HUANG L W, et al. Senolytic therapy ameliorates renal fibrosis postacute kidney injury by alleviating renal senescence[J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2021, 35(1): e21229. |
| [39] |
LI S Y, LIVINGSTON M J, MA Z W, et al. Tubular cell senescence promotes maladaptive kidney repair and chronic kidney disease after cisplatin nephrotoxicity[J]. JCI Insight, 2023, 8(8): e166643. DOI:10.1172/jci.insight.166643 |
| [40] |
EL-WASEIF E G, SHARAWY M H, SUDDEK G M. The modulatory effect of sodium molybdate against cisplatin-induced CKD: role of TGF-β/Smad signaling pathway[J]. Life Sciences, 2022, 306: 120845. DOI:10.1016/j.lfs.2022.120845 |
| [41] |
DEWAELES E, CARVALHO K, FELLAH S, et al. Istradefylline protects from cisplatin-induced nephrotoxicity and peripheral neuropathy while preserving cisplatin antitumor effects[J]. The Journal of Clinical Investigation, 2022, 132(22): e152924. DOI:10.1172/JCI152924 |
| [42] |
TSAI Y S, CHEN Y P, LIN S W, et al. Lactobacillus rhamnosus GKLC1 ameliorates cisplatin-induced chronic nephroto-xicity by inhibiting cell inflammation and apoptosis[J]. Biomedecine & Pharmacotherapie, 2022, 147: 112701. |
| [43] |
ADHIKARI A, MONDAL S, CHATTERJEE T, et al. Re-dox nanomedicine ameliorates chronic kidney disease (CKD) by mitochondrial reconditioning in mice[J]. Communications Bio-logy, 2021, 4(1): 1013. |
| [44] |
MAGHMOMEH A O, EL-GAYAR A M, EL-KAREF A, et al. Arsenic trioxide and curcumin attenuate cisplatin-induced renal fibrosis in rats through targeting Hedgehog signaling[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2020, 393(3): 303-313. DOI:10.1007/s00210-019-01734-y |
 2024, Vol. 60
2024, Vol. 60

