2. 青岛大学附属医院急诊科,山东 青岛 266071;
3. 青岛大学附属医院血液内科,山东 青岛 266071
蕈样肉芽肿(MF)是原发性皮肤T细胞淋巴瘤最常见的类型,恶性程度较低,临床上病情进展缓慢、病程一般较长,且早期易与其他皮肤病混淆,鉴别诊断困难。治疗主要根据不同病情采用个体化方案,以减轻症状、延缓疾病进展。但是病情一旦进展至肿瘤期或者合并大细胞转化,疾病会呈现侵袭性进展,需要加强联合化疗。本文对我科收治的1例晚期MF伴大细胞转化病人临床资料进行分析,并复习相关文献,为临床上此类病人的诊治提供经验。
1 病例报告病人,女,40岁。因“上肢皮疹4年,确诊MF 1年”于我院门诊就诊。病人4年前无明显诱因出现双侧上肢红斑,伴瘙痒,间断外用糠酸莫米松乳膏,瘙痒好转;2年前皮疹逐渐增多,累及躯干,于当地医院就诊,诊断为湿疹,给予地氯雷他定口服,皮疹未见明显好转;后局部皮肤红斑形成包块,自服中药治疗;1年前病人皮肤包块较前增多,于青岛市市立医院就诊。查体:躯干及双上肢可见多处红斑、包块,全身浅表淋巴结未触及。皮肤病理:(躯干)皮肤淋巴组织增生性疾病,淋巴细胞在真皮浅层呈宽带状浸润,并见表皮侵犯,浅层细胞以大细胞为主,真皮中下层淋巴细胞较小。免疫组化结果:CD3(弥漫+),CD20(少量背景细胞+),CD79a(-),CD4(+),CD8(散在个别背景细胞+),CD5(弱+),CD7(背景细胞散在+),PAX-5(-),CD30(+,其阳性比例约为15%),Ki-67(约60%阳性),CD56(-),TIA(-),Grb(-),CD1a(Langerhana组织细胞+),S100(-),EBV(-)。考虑为MF(肿瘤期),伴大细胞转化。未予特殊治疗。后病人就诊于山东省肿瘤医院,骨髓常规、活检、流式细胞学检查均未见异常。PET-CT检查:结合临床,淋巴瘤并多发皮下受累;右侧腋窝、双侧腹股沟淋巴结增大伴高代谢,考虑受累,大者短径约1.0 cm,最大标准摄取值(SUVmax)6.3;左侧股骨上段略高代谢,考虑受累,SUVmax5.4;左侧腋窝淋巴结增大伴略高代谢,建议观察以除外受累,大者短径约0.6 cm。给予病人CHOPE方案化疗,具体用药:环磷酰胺1.4 g,第1天;脂质体多柔比星40 mg,第1天;长春新碱2 mg,第1天;泼尼松片,第1~5天;依托泊苷0.1 g,第1~3天;每3周1疗程,共6疗程。化疗结束后病人右前臂遗留一枚质硬结节,余皮疹完全消退。15 d后病人因四肢、躯干再次出现水肿性红斑,再次就诊于青岛市市立医院。病理检查示皮肤MF复发。先后给予口服西达本胺(20 mg,每周2次)联合窄谱紫外线B(nB-UVB,每周3次)照射、苯达莫司汀化疗(100 mg,第1、2天,共2次)、西达本胺(20 mg,每周2次)联合来那度胺(25 mg,每日1次,吃2周停2周)、西达本胺(30 mg)联合沙利度胺(100 mg)治疗,皮疹均控制不佳。2021年7月病人于北京大学第一医院就诊,当时查体:四肢、躯干弥漫红色斑块,部分呈环形;左侧腰部可见一4 cm×3 cm×1 cm包块,质硬,无破溃;左侧腹股沟可触及一2 cm×3 cm大小淋巴结,质硬。病理检查:(腰部包块、斑块)皮肤真皮浅中层中~大型异型淋巴细胞成片增生浸润,大细胞核仁明显,伴嗜酸性粒细胞浸润,表皮局灶浸润。免疫组化:CD3(
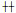

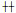
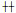


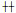
2021年9月病人为求进一步诊治,于我院血液科门诊就诊。查体:周身广泛皮肤淋巴水肿、隆起,左腹部多发包块(图 1A)。诊断为原发性皮肤T细胞淋巴瘤(MF)。既往多囊卵巢综合征病史,剖宫产术后。给予病人CD30单抗(安适利)+PD-1+GDP方案化疗,具体用药:安适利100 mg,第1天;PD-1 200 mg,第8天;吉西他滨1.7 g,第1、8天;顺铂60 mg,第1、2天;地塞米松40 mg,第1~4天。病人化疗期间达到2度骨髓抑制并发热,给予升血小板、升白细胞、促造血等对症支持治疗好转,未见其他毒副作用。治疗2疗程后病人左腹部包块较前逐渐缩小,目前已治疗4疗程(图 1B~D),仍继续治疗、随访中。
 |
| A:左腹部多发包块;B:左腹部包块化疗2疗程后皮肤表现;C:左腹部包块化疗3疗程后皮肤表现;D:左腹部包块化疗4疗程后皮肤表现。 图 1 MF病人左腹部包块及其化疗效果 |
MF是最常见的皮肤T细胞淋巴瘤,通常呈惰性临床过程,晚期病变可出现皮外受累(淋巴结、血液或较少见的其他器官)或大细胞转化。MF被认为是一个“伟大的模仿者”,并不总以典型临床表现出现,即使是典型的MF表现,也易与其他良性皮肤病混淆,而且皮肤活检存在假阴性率和假阳性率,导致误诊和延迟诊断[1]。在早期阶段,MF的特征病变类似于湿疹、多形性红斑等,在此期间,局部应用类固醇或免疫抑制药物可能会降低这些病变的强度,从而进一步延迟诊断[2]。MF的诊断具有挑战性,需要从临床表现、病理检查和分子研究等中获得信息。另外,胸腺细胞选择相关高迁移率群盒蛋白的表达可能是一种有用的辅助诊断指标[3]。有研究显示,MF从症状出现到确诊的中位时间为3~4年,但可能超过40年[4]。本文病人早期出现红斑、湿疹,但鉴别诊断不够完善,且早期应用类固醇药物,导致误诊和延迟诊断。虽然最终依靠病史、临床表现、病理检查和流式细胞学以及TCR分子重排证实了MF的诊断,但病人经过多种治疗效果不佳,疾病持续进展。本例病人确诊时即为MF晚期,并伴大细胞转化和淋巴结及骨骼受累,TNMB分期属于T3NXM0B0期,临床分期属于ⅡB期。因此,临床上若遇到患有红斑、湿疹、银屑病等疾病的病人,且皮疹治疗效果不佳,应及早考虑MF的可能。此外,该病人CD30(+),需与原发皮肤CD30+T细胞淋巴细胞增殖性疾病相鉴别。
MF的治疗通常是多学科的,虽然有几种疗法被美国国立综合癌症网络(NCCN)指南认可用于治疗晚期MF,但缺乏带来持久反应的有效疗法。AKPEK等[5]采用CHOPE方案治疗15例晚期难治性原发性皮肤T细胞淋巴瘤病人,在中位5个周期化疗后,完全缓解(CR)率27%,部分缓解(PR)率53%,总体反应率(ORR)80%。西达本胺作为一种苯甲酰胺类组蛋白去乙酰化酶抑制剂,可诱导肿瘤细胞生长停滞和凋亡,并增强细胞抗肿瘤免疫,被中国食品药品监督管理局批准用于治疗复发或难治性外周T细胞淋巴瘤(PTCL)[6]。曾有个案报道西达本胺治疗晚期MF病人结果有效和长期缓解[7]。同时,IFN-α的免疫调节活性在MF的治疗中也起着关键作用。JUMBOU等[8]采用IFN-α治疗51例MF和Sezary综合征(SS)病人,有41%的病人获得CR,67%的病人获得OR。由于本文病人在确诊MF时已处于晚期,整体采用了系统性治疗。然而本文病人接受标准CHOPE方案化疗后病情一度好转,停用化疗后病情复发,缓解时间较短。随后病人先后接受口服西达本胺联合来那度胺、西达本胺联合沙利度胺及苯达莫司汀化疗治疗,结果皮疹控制不佳。后又给予病人IFN-α联合维A酸治疗,结果仍未见效。
在2007年,NCCN将吉西他滨联合顺铂和地塞米松(GDP)方案列为非霍奇金淋巴瘤的二线推荐方案。陈英等[9]采用GDP方案治疗32例复发难治性非霍奇金淋巴瘤,CR率22.22%,PR率40.74%,总有效率62.96%,且毒副反应可耐受。基于此,有研究又用该方案治疗16例PTCL病人,结果CR率19%,PR率50%,毒性亦可耐受[10]。当活检标本有10%或更多的CD30+恶性细胞时,维布妥昔单抗(BV)可能是一个理想的治疗选择。BV是一种抗CD30的单克隆抗体,通过可被蛋白酶裂解的连接区与单甲基澳瑞他汀偶联[11]。多项临床研究显示,BV治疗CD30+MF病人有效并具有良好的耐受性,其主要不良反应为周围神经病变[12-13]。此外,一项在复发难治MF/SS中开展的Ⅱ期临床试验显示,PD-L1单抗对MF的ORR为55.6%,且具有持续反应和良好的安全性[14]。本文病人于我院就诊时,病情未得到控制、持续进展。考虑病人免疫组化提示CD30(+),且为复发难治,给予1疗程CD30单抗联合GDP方案化疗,皮疹未见明显消退;遂加用PD-1单抗联合治疗,皮疹逐渐消退,4疗程后左腹部只遗留一硬性包块。
综上所述,对怀疑为MF的病人,应及时进行病变部位皮肤活检,必要时进行多部位皮肤活检,并进行外周血、骨髓常规、病变淋巴结活检、CT或PET-CT检查以明确诊断及病情分期,并判断预后及选择治疗方案。本文病人临床最大的特征是病情迁延反复,各种治疗效果不佳,给予安适利+GDP+PD-1方案化疗,效果明显。因此,在MF治疗过程中,若遇传统治疗药物及方法疗效不佳,BV、PD-1等新药或许可为我们的治疗提供更多、更好的选择。
| [1] |
HODAK E, AMITAY-LAISH I. Mycosis fungoides: a great imitator[J]. Clinics in Dermatology, 2019, 37(3): 255-267. DOI:10.1016/j.clindermatol.2019.01.004 |
| [2] |
ALSAYYAH A. Is it mycosis fungoides? A comprehensive guide to reaching the diagnosis and avoiding common pitfalls[J]. Annals of Diagnostic Pathology, 2020, 47: 151546. DOI:10.1016/j.anndiagpath.2020.151546 |
| [3] |
LAROCCA C, KUPPER T. Mycosis fungoides and Sézary syndrome: an update[J]. Hematology/Oncology Clinics of North America, 2019, 33(1): 103-120. DOI:10.1016/j.hoc.2018.09.001 |
| [4] |
HRISTOV A C, TEJASVI T, WILCOX R A. Mycosis fungoides and Sézary syndrome: 2019 update on diagnosis, risk-stratification, and management[J]. American Journal of Hematology, 2019, 94(9): 1027-1041. DOI:10.1002/ajh.25577 |
| [5] |
AKPEK G, KOH H K, BOGEN S, et al. Chemotherapy with etoposide, vincristine, doxorubicin, bolus cyclophosphamide, and oral prednisone in patients with refractory cutaneous T-cell lymphoma[J]. Cancer, 1999, 86(7): 1368-1376. DOI:10.1002/(SICI)1097-0142(19991001)86:7<1368::AID-CNCR37>3.0.CO;2-8 |
| [6] |
LU X P, NING Z Q, LI Z B, et al. Development of chidamide for peripheral T-cell lymphoma, the first orphan drug approved in China[J]. Intractable & Rare Diseases Research, 2016, 5(3): 185-191. |
| [7] |
CHE Y X, DING X L, SONG J C, et al. Effective remission of chidamide on treatment of advanced mycosis fungoides: an unusual case report[J]. Dermatologic Therapy, 2019, 32(4): e12944. |
| [8] |
JUMBOU O, N'GUYEN J M, TESSIER M H, et al. Long-term follow-up in 51 patients with mycosis fungoides and Sézary syndrome treated by interferon-Alfa[J]. The British Journal of Dermatology, 1999, 140(3): 427-431. DOI:10.1046/j.1365-2133.1999.02704.x |
| [9] |
陈英, 吴晖, 陈宁斌, 等. GDP方案治疗复发难治性非霍奇金淋巴瘤的临床观察[J]. 中华肿瘤防治杂志, 2009, 16(16): 1262-1264. |
| [10] |
ARKENAU H T, CHONG G, CUNNINGHAM D, et al. Gemcitabine, cisplatin and methylprednisolone for the treatment of patients with peripheral T-cell lymphoma: the Royal Marsden Hospital experience[J]. Haematologica, 2007, 92(2): 271-272. DOI:10.3324/haematol.10737 |
| [11] |
KAMIJO H, MIYAGAKI T. Mycosis fungoides and sézary syndrome: updates and review of current therapy[J]. Current Treatment Options in Oncology, 2021, 22(2): 10. DOI:10.1007/s11864-020-00809-w |
| [12] |
DUVIC M, TETZLAFF M T, GANGAR P, et al. Results of a phase Ⅱ trial of brentuximab vedotin for CD30+ cutaneous T-cell lymphoma and lymphomatoid papulosis[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2015, 33(32): 3759-3765. DOI:10.1200/JCO.2014.60.3787 |
| [13] |
PRINCE H M, KIM Y H, HORWITZ S M, et al. Brentuximab vedotin or physician's choice in CD30-positive cutaneous T-cell lymphoma (ALCANZA): an international, open-label, randomised, phase 3, multicentre trial[J]. Lancet (London, England), 2017, 390(10094): 555-566. DOI:10.1016/S0140-6736(17)31266-7 |
| [14] |
KHODADOUST M S, ROOK A H, PORCU P, et al. Pembrolizumab in relapsed and refractory mycosis fungoides and sézary syndrome: a multicenter phase Ⅱ study[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2020, 38(1): 20-28. DOI:10.1200/JCO.19.01056 |
 2022, Vol. 58
2022, Vol. 58

