帕金森病(PD)是第二大常见的神经退行性疾病,据统计,2016年我国60岁以上人群中PD患病率为1.37%[1]。PD的临床表现除肌僵直、运动迟缓、静止性震颤等运动症状外,还伴随有嗅觉障碍、快速眼动睡眠障碍、便秘、抑郁等非运动症状。其主要病理特征为黑质致密部多巴胺能神经元的退行性病变及黑质脑区存在特异性的异常铁沉积[2-6]。研究表明,75%~90%的PD病人早期嗅觉功能减退,因此嗅觉障碍被认为是PD发病早期的一个重要标志[7-10]。鼻腔上皮的嗅觉感知神经元能够检测环境中的气味信息,并通过嗅神经传递到嗅觉相关的大脑皮质,最终形成嗅觉[11]。嗅觉感知神经元容易受到环境毒素如细菌、病毒、灰尘、花粉等的影响,继而引发神经炎症,导致嗅觉系统出现损伤[12]。有研究显示,C57BL/6小鼠鼻内滴注脂多糖(LPS)6周后出现明显的嗅觉障碍及PD样行为学变化; 经鼻给予α-突触核蛋白的预制纤维,猕猴黑质和苍白球脑区内出现明显铁沉积[13-14]。但在发生上述病变之前其他脑区是否存在铁沉积尚不清楚。有研究结果证实,黑质到嗅球和内侧前额叶皮质存在直接的神经投射通路[15-16]。本研究旨在探讨经鼻给LPS对小鼠嗅觉和嗅球及内侧前额叶皮质中轻链铁蛋白表达的影响。现将结果报告如下。
1 材料和方法 1.1 实验动物及主要试剂SPF级雄性C57BL/6小鼠,7周龄,体质量为(19±1) g,购自北京维通利华公司,饲养在可自由饮水摄食、室温25 ℃、湿度(50±5)%、12 h昼夜循环光照的SPF级清洁环境中,适应环境1周后开始实验。LPS购于美国Sigma公司; 酪氨酸羟化酶(TH)抗体购于美国Millipore公司,轻链铁蛋白抗体购于美国abcam公司,Rabbit Anti-GAPDH和HRP-IgG标记的二抗购于中国爱必信公司; PVDF膜、ECL发光液购于美国Millipore公司; 其他试剂均为国产分析纯。
1.2 动物分组与处理将16只小鼠随机分为对照组和LPS组,每组8只。LPS组双侧鼻孔交替给药(LPS用生理盐水配制的工作浓度为1 g/L),每只10 μL; 对照组给予等体积的生理盐水。小鼠异戊烷麻醉后,采用文献报道的方法进行鼻内滴注,隔天1次[17]。给药时间为3周,3周后立即进行嗅觉检测。
1.3 嗅觉功能检测检测采用透明的亚克力盒(30 cm×20 cm×20 cm),盒子中间有可拆卸的透明隔板,隔板底部中间有可供小鼠自由穿梭的拱形通道。将小鼠置于盒子底部通道处,盒子一侧铺放适量新垫料,另一侧铺放等量的小鼠笼内的旧垫料(笼内已生活过3~5 d)。小鼠适应1 min后,应用Ethvision XT7系统分别采集两组小鼠自由活动5 min内在新垫料中的总逗留时长,若时长存在统计学差异则反映LPS组有嗅觉障碍; 反之,则不存在嗅觉障碍。
1.4 免疫印迹法检测TH和轻链铁蛋白表达嗅觉功能检测结束后,处死小鼠,取新鲜的嗅球及内侧前额叶皮质组织并称质量。按每毫克25 μL的比例向组织样本中加入RIPA蛋白裂解液,用机器充分研磨后,于冰上静置30 min充分裂解,以12 000 r/min离心25 min,取上清,用BCA蛋白定量试剂盒检测蛋白浓度,加入1/4体积的Loading Buffer后95 ℃金属浴5 min。行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳(80 V、40 min,120 V、90 min),然后应用湿转法转至0.45 μm的PVDF膜上(300 mA、90 min)。用50 g/L脱脂奶粉室温封闭2 h,分别加入TH(1∶3 000)、轻链铁蛋白(1∶1 000)、GAPDH(1∶20 000)一抗于4 ℃摇床孵育过夜; 以TBST溶液洗3次,每次10 min; 加入山羊抗兔的HRP-IgG二抗(1∶10 000)室温孵育1 h; 以TBST溶液洗3次,每次10 min; 使用ECL发光液显影。应用Image J软件进行分析,TH和轻链铁蛋白表达水平以目的蛋白和内参照蛋白(GAPDH)的比值表示。
1.5 统计学处理应用Prism 6软件进行统计学处理,以x±s表示计量资料结果,两组间均数的比较采用t检验。P<0.05表示差异有统计学意义。
2 结果 2.1 经鼻给LPS对嗅觉功能的影响两组小鼠在新垫料中的总逗留时长的差值为(9.95±15.38)s,差异无统计学意义(P>0.05)。
2.2 经鼻给LPS对嗅球TH和轻链铁蛋白表达的影响与对照组相比较,LPS组小鼠嗅球内TH蛋白表达无明显变化(P>0.05);轻链铁蛋白表达明显上升,差异具有统计学意义(t=4.486,P<0.05)。见图 1和表 1。
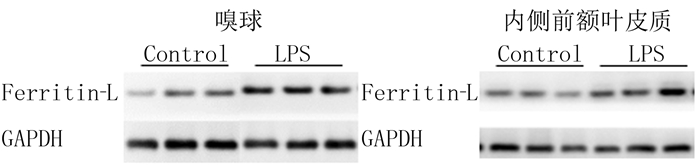 |
| 注:Ferritin-L为轻链铁蛋白。 图 1 LPS对嗅球和内侧前额叶皮质内轻链铁蛋白表达的影响 |
| 表 1 两组小鼠嗅球和内侧前额叶皮质中各蛋白表达水平比较(n=5,x±s) |
|
|
与对照组相比,LPS组轻链铁蛋白表达明显上调,差异有统计学意义(t=2.391,P<0.05)。见图 1和表 1。
3 讨论Braak分级学说认为,PD病理过程始于嗅球并逐渐累及延髓等低位脑干,进而中脑黑质等脑区发生损伤,出现运动症状[18-20]。有研究表明,经鼻给予LPS 6周,嗅球中小胶质细胞激活,导致黑质区多巴胺能神经元损伤,纹状体内多巴胺减少,这一过程与炎症因子受体介导有关[13]。本研究探讨经鼻给予LPS 3周能否引发嗅觉损伤,结果显示,LPS处理后小鼠没有明显的嗅觉障碍。这可能是由于LPS介导的炎症反应在3周时不足以引起嗅觉系统损伤。普遍认为嗅觉障碍可能与嗅球内多巴胺能神经元有关[17]。PD病人尸检研究显示,嗅球内TH阳性神经元数目增多; 另有临床研究显示,PD病人给予多巴胺制剂,不能改善其嗅觉障碍[7, 21]。这两项研究表明嗅球中的多巴胺能神经元似乎与嗅觉障碍并无直接关系。本研究亦未观察到嗅球内多巴胺能神经元出现明显损伤。
在脑内神经元生长代谢过程中,金属元素铁发挥着重要的生理作用,如参与线粒体中能量产生、合成血红蛋白参与氧转运、髓鞘形成、神经递质的合成与代谢等。然而,脑内过多的铁能通过Fenton反应产生羟自由基等活性氧,造成氧化应激; 过多的铁也可能通过铁死亡方式诱导脂质过氧化物积累,造成细胞死亡[6, 22-24]。研究表明,PD病人脑铁代谢存在异常[25-26]。本文研究结果显示,鼻内滴注LPS 3周能够引起嗅球和内侧前额叶皮质内轻链铁蛋白表达上调,提示嗅球和内侧前额叶皮质内可能存在铁沉积。有文献报道,经鼻给LPS通过白细胞介素1β及其受体途径介导嗅球小胶质细胞激活和α-突触核蛋白聚集[13]。嗅觉系统具有极其复杂的神经网络,在脑内与多个脑区存在直接或间接的联系[27]。聚集形式的α-突触核蛋白可经相互联系的神经通路从嗅球传播至黑质和纹状体并造成多巴胺能神经元损伤[13]。因此我们推测,LPS诱导的嗅球α-突触核蛋白聚集体也可能传播至内侧前额叶皮质或其他脑区,并进一步诱导这些脑区小胶质细胞激活。本实验室的研究结果和有关文献报道结果均表明,小胶质细胞介导的神经炎症可以促进脑区铁沉积的发生[14, 28-34],但铁沉积是否能够引发神经炎症尚无定论[35]。因此,LPS能够引起内侧前额叶皮质等不同脑区的铁含量增加,且可能与LPS导致的α-突触核蛋白聚集体的传播和神经炎症有关。鉴于黑质与嗅球和内侧前额叶皮质存在直接的神经投射通路,这两个脑区的铁沉积也可能通过跨脑区铁转运导致黑质等PD相关脑区铁沉积,但这还需要进一步的实验研究证实。
综上所述,经鼻给LPS 3周后,小鼠嗅觉功能没有发生显著变化,而且嗅球内多巴胺能神经元没有明显损伤,嗅球和内侧前额叶皮质内的铁含量显著上升。在本研究基础上,我们将继续探讨铁与炎症是否具有协同作用,以及经鼻给LPS能否引起黑质等PD相关脑区的铁含量上升。本文结果为研究经鼻给药对脑内铁代谢的影响提供了新的实验依据及理论基础。
| [1] |
QI S G, YIN P, WANG L H, et al. Prevalence of Parkin-son's disease: a community-based study in China[J]. Movement Disorders, 2021, 36(12): 2940-2944. DOI:10.1002/mds.28762 |
| [2] |
LEAK R K. Conditioning against the pathology of Parkinson's disease[J]. Conditioning Medicine, 2018, 1(3): 143-162. |
| [3] |
SUN J Y, LAI Z Y, MA J H, et al. Quantitative evaluation of iron content in idiopathic rapid eye movement sleep behavior disorder[J]. Movement Disorders, 2020, 35(3): 478-485. DOI:10.1002/mds.27929 |
| [4] |
JIANG H, WANG J, ROGERS J, et al. Brain iron metabolism dysfunction in Parkinson's disease[J]. Molecular Neurobiology, 2017, 54(4): 3078-3101. DOI:10.1007/s12035-016-9879-1 |
| [5] |
BARBOSA J H, SANTOS A C, TUMAS V, et al. Quanti-fying brain iron deposition in patients with Parkinson's disease using quantitative susceptibility mapping, R2 and R2[J]. Magnetic Resonance Imaging, 2015, 33(5): 559-565. DOI:10.1016/j.mri.2015.02.021 |
| [6] |
ZUCCA F A, SEGURA-AGUILAR J, FERRARI E, et al. Interactions of iron, dopamine and neuromelanin pathways in brain aging and Parkinson's disease[J]. Progress in Neurobio-logy, 2017, 155: 96-119. DOI:10.1016/j.pneurobio.2015.09.012 |
| [7] |
DOTY R L. Olfaction in Parkinson's disease and related disorders[J]. Neurobiology of Disease, 2012, 46(3): 527-552. DOI:10.1016/j.nbd.2011.10.026 |
| [8] |
DOTY R L. Olfactory dysfunction in Parkinson disease[J]. Nature Reviews Neurology, 2012, 8(6): 329-339. DOI:10.1038/nrneurol.2012.80 |
| [9] |
BOESVELDT S, VERBAAN D, KNOL D L, et al. A comparative study of odor identification and odor discrimination deficits in Parkinson's disease[J]. Movement Disorders: Official Journal of the Movement Disorder Society, 2008, 23(14): 1984-1990. DOI:10.1002/mds.22155 |
| [10] |
FULLARD M E, MORLEY J F, DUDA J E. Olfactory dysfunction as an early biomarker in Parkinson's disease[J]. Neuroscience Bulletin, 2017, 33(5): 515-525. DOI:10.1007/s12264-017-0170-x |
| [11] |
WILSON D A, KADOHISA M, FLETCHER M L. Cortical contributions to olfaction: Plasticity and perception[J]. Seminars in Cell & Developmental Biology, 2006, 17(4): 462-470. |
| [12] |
CONNOR E E, ZHOU Y, LIU G E. The essence of appetite: does olfactory receptor variation play a role?[J]. Journal of Animal Science, 2018, 96(4): 1551-1558. DOI:10.1093/jas/sky068 |
| [13] |
NIU H C, WANG Q, ZHAO W G, et al. IL-1β/IL-1R1 signaling induced by intranasal lipopolysaccharide infusion regulates alpha-Synuclein pathology in the olfactory bulb, substantia nigra and striatum[J]. Brain Pathology (Zurich, Switzerland), 2020, 30(6): 1102-1118. DOI:10.1111/bpa.12886 |
| [14] |
GUO J J, YUE F, SONG D Y, et al. Intranasal administration of α-synuclein preformed fibrils triggers microglial iron deposition in the substantia nigra of Macaca fascicularis[J]. Cell Death & Disease, 2021, 12(1): 81. |
| [15] |
HÖGLINGER G U, ALVAREZ-FISCHER D, ARIAS-CARRIÓN O, et al. A new dopaminergic nigro-olfactory projection[J]. Acta Neuropathologica, 2015, 130(3): 333-348. DOI:10.1007/s00401-015-1451-y |
| [16] |
WANG Z, ZENG Y N, YANG P, et al. Axonal iron transport in the brain modulates anxiety-related behaviors[J]. Nature Chemical Biology, 2019, 15(12): 1214-1222. DOI:10.1038/s41589-019-0371-x |
| [17] |
王冬霞, 谢俊霞, 宋宁. 经鼻给枸橼酸铁铵对小鼠嗅觉、嗅球铁含量及TH蛋白表达影响[J]. 青岛大学学报(医学版), 2019, 55(1): 13-16. |
| [18] |
BRAAK H, DEL TREDICI K, RVB U, et al. Staging of brain pathology related to sporadic Parkinson's disease[J]. Neuro-biology of Aging, 2003, 24(2): 197-211. DOI:10.1016/S0197-4580(02)00065-9 |
| [19] |
KALIA L V, LANG A E. Parkinson's disease[J]. Lancet (London, England), 2015, 386(9996): 896-912. DOI:10.1016/S0140-6736(14)61393-3 |
| [20] |
BRAAK H, RVB U, DEL TREDICI K. Cognitive decline correlates with neuropathological stage in Parkinson's disease[J]. Journal of the Neurological Sciences, 2006, 248(1/2): 255-258. |
| [21] |
SCHAPIRA A H V, CHAUDHURI K R, JENNER P. Non-motor features of Parkinson disease[J]. Nature Reviews Neuroscience, 2017, 18(8): 435-450. |
| [22] |
ZECCA L, YOUDIM M B H, RIEDERER P, et al. Iron, brain ageing and neurodegenerative disorders[J]. Nature Reviews Neuroscience, 2004, 5(11): 863-873. DOI:10.1038/nrn1537 |
| [23] |
WARD R J, ZUCCA F A, DUYN J H, et al. The role of iron in brain ageing and neurodegenerative disorders[J]. The Lancet Neurology, 2014, 13(10): 1045-1060. DOI:10.1016/S1474-4422(14)70117-6 |
| [24] |
SNYDER A M, CONNOR J R. Iron, the substantia nigra and related neurological disorders[J]. Biochimica et Biophysica Acta, 2009, 1790(7): 606-614. DOI:10.1016/j.bbagen.2008.08.005 |
| [25] |
DEXTER D T, WELLS F R, AGID F, et al. Increased nigral iron content in postmortem parkinsonian brain[J]. Lancet (London, England), 1987, 2(8569): 1219-1220. |
| [26] |
AYTON S, LEI P, HARE D J, et al. Parkinson's disease iron deposition caused by nitric oxide-induced loss of β-amyloid precursor protein[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2015, 35(8): 3591-3597. DOI:10.1523/JNEUROSCI.3439-14.2015 |
| [27] |
WILSON R S, SCHNEIDER J A, ARNOLD S E, et al. Olfactory identification and incidence of mild cognitive impairment in older age[J]. Archives of General Psychiatry, 2007, 64(7): 802-808. DOI:10.1001/archpsyc.64.7.802 |
| [28] |
URRUTIA P J, MENA N P, NỪÑEZ M T. The interplay between iron accumulation, mitochondrial dysfunction, and inflammation during the execution step of neurodegenerative disorders[J]. Frontiers in Pharmacology, 2014, 5: 38. |
| [29] |
ANDERSEN H H, JOHNSEN K B, MOOS T. Iron deposits in the chronically inflamed central nervous system and contri-butes to neurodegeneration[J]. Cellular and Molecular Life Sciences: CMLS, 2014, 71(9): 1607-1622. DOI:10.1007/s00018-013-1509-8 |
| [30] |
CHEN L L, HUANG Y, YU X, et al. Corynoxine protects dopaminergic neurons through inducing autophagy and dimi-nishing neuroinflammation in rotenone-induced animal models of Parkinson's disease[J]. Frontiers in Pharmacology, 2021, 12: 642900. DOI:10.3389/fphar.2021.642900 |
| [31] |
BADANJAK K, FIXEMER S, SMAJIĈ S, et al. The contribution of microglia to neuroinflammation in Parkinson'sdisease[J]. International Journal of Molecular Sciences, 2021, 22(9): 4676. DOI:10.3390/ijms22094676 |
| [32] |
PAJARES M, I ROJO A, MANDA G, et al. Inflammation in Parkinson's disease: mechanisms and therapeutic implications[J]. Cells, 2020, 9(7): E1687. DOI:10.3390/cells9071687 |
| [33] |
VAN VLIET E A, NDODE-EKANE X E, LEHTO L J, et al. Long-lasting blood-brain barrier dysfunction and neuroinflammation after traumatic brain injury[J]. Neurobiology ofDisease, 2020, 145: 105080. DOI:10.1016/j.nbd.2020.105080 |
| [34] |
FERNÁNDEZ-MENDÍVIL C, LUENGO E, TRIGO-ALONSO P, et al. Protective role of microglial HO-1 blockade in aging: implication of iron metabolism[J]. Redox Biology, 2021, 38: 101789. DOI:10.1016/j.redox.2020.101789 |
| [35] |
LIU Z, SHEN H C, LIAN T H, et al. Iron deposition in substantia nigra: abnormal iron metabolism, neuroinflammatory mechanism and clinical relevance[J]. Scientific Reports, 2017, 7(1): 14973. DOI:10.1038/s41598-017-14721-1 |
 2022, Vol. 58
2022, Vol. 58

