2. 重庆市陆军军医大学第一附属医院健康管理科
小胶质细胞在中枢神经系统的免疫调节过程中发挥核心作用[1]。研究发现,小胶质细胞中NOD样受体热蛋白结构域相关蛋白3(NLRP3)在人类轻度认知障碍和阿尔兹海默病(AD)等神经变性疾病中发挥着重要的作用[2-3]。NLRP3作为最具有特色的炎症小体,是胞浆内识别受体NOD样受体家族的一员,当细胞受到感染、组织损伤等刺激时,被激活的NLRP3能够通过结合凋亡相关的斑点样蛋白(ASC)招募半胱氨酸天冬氨酸蛋白酶-1(caspase-1)前体形成NLRP3炎症小体,从而促进caspase-1前体激活成为caspase-1,诱导白细胞介素1β(IL-1β)和白细胞介素18(IL-18)的成熟[4]。降钙素基因相关肽(CGRP)是一种神经肽类物质,可以直接作用于巨噬细胞和树突状细胞,抑制IL-1β的生成与释放[5-7]。本团队前期研究显示,CGRP可以改善脊髓损伤大鼠的运动功能,抑制半胱氨酸天冬氨酸蛋白酶-3(caspase-3)的表达,具有神经保护作用,但其分子机制仍不清楚[8]。NLRP3炎症小体的激活能够促进大量IL-1β的产生,而CGRP可以抑制IL-1β的生理功能,CGRP与NLRP3炎症小体之间可能存在着一定的联系。为了进一步探明二者关系,本研究采用脂多糖(LPS)与三磷酸腺苷(ATP)诱导的BV2小胶质细胞炎症小体激活模型,从NLRP3炎症小体途径探讨CGRP的神经保护机制。
1 材料与方法 1.1 实验材料BV2小胶质细胞,购自Santa Cruz Biotechno-logy公司。胎牛血清(Cell Signaling Technology);LPS(爱必信);ATP(FERMRNTAS);β-actin(Santa Cruz Biotechnology);CGRP抗体(北京义翘神州科技有限公司);ASC、caspase-1和NLRP3抗体(abcam);酶联免疫吸附试验(ELISA)检测试剂盒(南京建成生物工程研究所);BCA蛋白定量试剂盒(博士德生物工程有限公司);ECL显影液和PVDF膜(Millipore);HRP标记二抗(Sigma)。全波长酶标仪(Bio-tek,ELX 800);垂直电泳装置(北京市六一仪器厂,DYCZ-24DN);CO2恒温培养箱(ThermoForma,form 1341);LabWorksTM凝胶成像及分析系统(美国UVP公司,GelDoc-It310)。
1.2 实验方法 1.2.1 细胞培养与传代BV2小胶质细胞置于含体积分数0.10胎牛血清和10 g/L双抗的RPMI 1640培养液中,放于37 ℃的CO2细胞培养箱中,待细胞生长融合率80%时传代,隔2 d传代1次,传代3次后且细胞状态良好时用于后续实验。
1.2.2 LPS联合ATP激活小胶质细胞最佳模型确定及CGRP最佳剂量筛选将细胞分为6组,依据有关文献确定两种细胞模型处理条件[9-11]。对照组细胞用含体积分数0.10胎牛血清的DMEM/F12培养液培养;模型1组细胞先加入100 μg/L的LPS作用12 h,然后再加入5 mmol/L的ATP继续作用45 min;模型2组细胞先加入100 μg/L的LPS作用4 h,然后再加入5 mmol/L的ATP继续作用45 min;CGRP1、CGRP10、CGRP100组细胞先分别用1、10、100 μg/L的CGRP预处理1 h,然后加入100 μg/L的LPS作用12 h,再加入5 mmol/L的ATP继续作用45 min。根据NLRP3蛋白含量筛选出最佳模型和CGRP的最佳作用浓度进行后续实验。
1.2.3 细胞NLRP3、capase-1、ASC蛋白表达的检测采用蛋白免疫印迹法检测对照组(A组)、模型组(按筛选出的最佳模型制备方法进行处理,B组)、CGRP组(按筛选出的最佳作用浓度的CGRP进行处理,C组)细胞中NLRP3、capase-1和ASC的含量。样品裂解后提取蛋白,采用BCA蛋白定量试剂盒检测蛋白浓度。蛋白经SDS-PAGE凝胶电泳分离后,浸入脱脂奶粉封闭液中,室温下于摇床上轻轻摇动2 h;然后分别加入兔抗人单克隆NLRP3抗体(1∶100)、ASC抗体(1∶50)、capase-1(1∶200)抗体以及兔抗人多克隆GAPDH抗体(1∶500)4 ℃孵育过夜。TBS-T洗膜后,将膜于含对应二抗(HRP标记二抗)的脱脂奶粉溶液中,室温作用1.5 h,用ECL显影液显影,用LabWorksTM凝胶成像及分析系统摄像,分析条带的光密度值。
1.2.4 细胞IL-1β表达的ELISA检测收集对照组、模型组和CGRP组的细胞培养上清液,严格按照IL-1β检测试剂盒的说明进行检测。反应终止后使用全波长酶标仪于450 nm波长处检测吸光度值,根据标准品浓度和吸光度值做标准曲线,计算各组样本吸光度值对应的浓度值。
1.3 统计学分析应用SPSS 23.0软件进行统计学分析。计量资料结果以 x±s表示,先进行方差齐性检验,方差齐则组间比较采用单因素方差分析,组间两两比较采用LSD法;方差不齐则组间比较采用Kruskal-Wallis H检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 最佳模型与CGRP最佳作用浓度对照组、模型1组、模型2组以及CGRP1、CGRP10、CGRP100组NLRP3蛋白表达量分别为0.215±0.003、0.394±0.006、0.303±0.002、0.054± 0.000、0.036±0.000、0.047±0.000(n=3)。对照组、模型1组、模型2组NLRP3表达量比较差异有统计学意义(H=7.200,P<0.05),其中模型1组NLRP3蛋白表达量最高,因此选择模型1为最佳模型进行后续实验。对照组、模型1组以及CGRP1、CGRP10、CGRP100组NLRP3表达量比较差异有统计学意义(H=13.573,P<0.05),其中CGRP10组NLRP3蛋白表达量最低,因此选择10 μg/L的CGRP进行后续实验。见图 1。
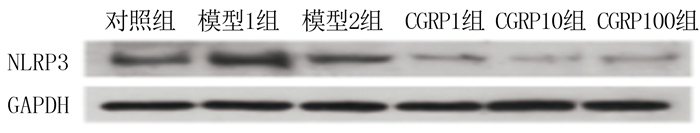 |
| 图 1 以NLRP3蛋白表达为标准确定最佳模型与CGRP最佳作用浓度 |
模型组细胞NLRP3、ASC、caspase-1、IL-1β的蛋白表达较对照组明显升高,CGRP组细胞上述蛋白表达较模型组明显降低,差异均有显著意义(F=7.261~151.232,P<0.05)。表明CGRP可以抑制炎症小体NLRP3的激活从而减轻炎症反应。见图 2和表 1。
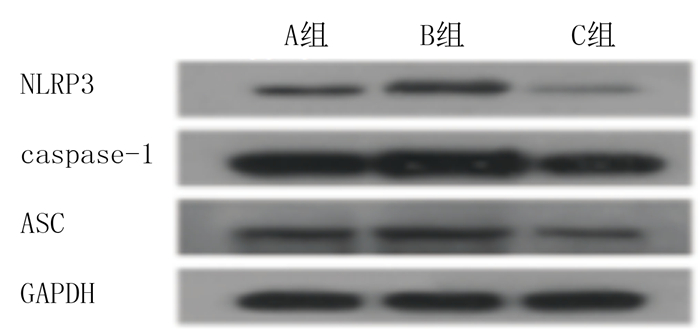 |
| 图 2 各组细胞NLRP3、caspase-1和ASC表达的蛋白免疫印迹检测 |
| 表 1 各组细胞NLRP3、caspase-1、ASC和IL-1β蛋白表达的比较(n=3,x±s) |
|
|
NLRP3炎症小体异常活化产生的过度炎症反应与人类多种疾病密切相关,其中包括AD、脊髓损伤等神经系统疾病[12-13]。已有实验研究结果表明,在AD模型中,NLRP3基因敲除的小鼠空间记忆能力显著提升,运动功能障碍与多巴胺能神经元退行性病变得以改善[14];在脊髓损伤模型中,小胶质细胞内的NLRP3炎症小体活化,并进一步激活核转录因子κB(NF-κB)信号通路,形成级联式炎症反应,加速神经元的死亡[15]。因此,抑制NLRP3炎症小体的过度激活可能是预防或治疗神经炎性疾病的关键。
研究发现,体外NLRP3炎症小体的激活需要两个信号:信号1是指当细胞受到LPS的刺激时,Toll样受体4(TLR4)迅速识别,激活NF-κB通路,导致pro-IL-1β和NLRP3蛋白水平的上调;信号2是指高浓度ATP刺激P2X7,导致K+外流,促进ASC和caspase-1的集合,从而导致NLRP3炎症小体的激活[16]。有研究表明,将ATP与LPS联合激活NLRP3炎症小体,可以缩短作用时间,并且刺激效果更显著[17]。但文献中未报道LPS联合ATP激活BV2小胶质细胞NLRP3炎症小体的具体浓度与反应时间。因此,本研究首先通过实验确定LPS联合ATP激活BV2小胶质细胞NLRP3炎症小体的最佳模型,结果表明,先以100 μg/L的LPS作用12 h,然后再以5 mmol/L的ATP继续作用45 min,小胶质细胞中炎症小体的激活最为显著,因此选用该浓度和反应时间建立体外小胶质细胞NLRP3激活模型。
CGRP为一种由37个氨基酸构成的多功能神经肽,是目前已知最强的扩血管物质,尤其对脑血管扩张具有极强的作用[18]。在免疫炎症方面,CGRP具有抗炎和促炎双向调节作用。例如,注射CGRP后,烟曲霉感染的真菌性角膜炎小鼠角膜组织中的IL-1β水平明显降低,角膜炎症状随之减轻,CGRP发挥了抗炎作用[19];而在偏头痛模型中,CGRP则通过一系列反应参与三叉神经血管系统信号转导,促进神经源性炎症从而引发偏头痛[20]。为了进一步了解CGRP在炎症中的作用,本研究将不同浓度的CGRP作用于BV2小胶质细胞,结果表明CGRP可以显著抑制NLRP3炎症小体的激活,但该作用并不呈浓度依赖性。因此我们推测,CGRP发挥抗炎和促炎的不同作用可能与其组织特性有关。既往有研究还表明,CGRP具有神经保护作用,该作用可能与CGRP抑制低氧海马神经元c-fos的表达,降低高阈值钙电流,抑制低氧时细胞外钙离子内流有关[21],但其具体机制尚不很清楚。本团队在研究CGRP与炎症关系时显示,CGRP和NLRP3炎症小体之间存在着千丝万缕的关系:CGRP可以抑制IL-1β和抗原呈递细胞,而NLRP3炎症小体的激活则可以促进IL-1β的表达[22];对比CGRP与NLRP3细胞内激活与传递途径显示,二者存在共同的信号通路cAMP/PKA[23-24]。因此,我们推测CGRP与NLRP3之间可能存在一定的调控关系,故而设计了本次实验。本文结果表明,CGRP可以降低LPS联合ATP诱导的BV2小胶质细胞中NLRP3、ASC和caspase-1的蛋白含量,减少细胞中IL-1β的表达,提示CGRP可以抑制小胶质细胞中NLRP3炎症小体的激活。本研究揭示了CGRP神经保护的又一作用机制,为临床上CGRP治疗神经炎性疾病提供了实验依据。
| [1] |
HICKMAN S, IZZY S, SEN P, et al. Microglia in neurodegeneration[J]. Nature Neuroscience, 2018, 21(10): 1359-1369. DOI:10.1038/s41593-018-0242-x |
| [2] |
HENEKA M T, KUMMER M P, STUTZ A, et al. NLRP3 is activated in Alzheimer's disease and contributes to pathology in APP/PS1 mice[J]. Nature, 2013, 493(7434): 674-678. DOI:10.1038/nature11729 |
| [3] |
ISING C, VENEGAS C, ZHANG S S, et al. NLRP3 inflammasome activation drives tau pathology[J]. Nature, 2019, 575(7784): 669-673. DOI:10.1038/s41586-019-1769-z |
| [4] |
BROZ P, DIXIT V M. Inflammasomes: mechanism of assembly, regulation and signalling[J]. Nature Reviews Immunology, 2016, 16(7): 407-420. DOI:10.1038/nri.2016.58 |
| [5] |
EDVINSSON L, HAANES K A, WARFVINGE K, et al. CGRP as the target of new migraine therapies-successful translation from bench to clinic[J]. Nature Reviews Neurology, 2018, 14(6): 338-350. DOI:10.1038/s41582-018-0003-1 |
| [6] |
HOLZMANN B. Antiinflammatory activities of CGRP modulating innate immune responses in health and disease[J]. Current Protein & Peptide Science, 2013, 14(4): 268-274. |
| [7] |
MIZUSHINA Y, SHIRASUNA K, USUI F, et al. NLRP3 protein deficiency exacerbates hyperoxia-induced lethality through Stat3 protein signaling independent of interleukin-1β[J]. Journal of Biological Chemistry, 2015, 290(8): 5065-5077. DOI:10.1074/jbc.M114.603217 |
| [8] |
柯晓华, 葛杜鹃, 王文春, 等. 运动点电针对急性脊髓损伤大鼠半胱氨酸天冬氨酸蛋白酶3和降钙素基因相关肽表达的影响[J]. 中国康复医学杂志, 2014, 29(10): 913-917. DOI:10.3969/j.issn.1001-1242.2014.10.003 |
| [9] |
刘富群, 高崎, 王丹丹, 等. 银杏酮酯抑制LPS/ATP诱导原代小胶质细胞NLRP3炎症小体的激活机制研究[J]. 中国中药杂志, 2018, 43(16): 3346-3352. |
| [10] |
王伟, 戴敏, 徐忠东. 丹皮酚对脂多糖/三磷酸腺苷诱导的小胶质细胞NLRP3炎症小体激活的影响[J]. 中国药理学通报, 2014, 30(5): 652-656. DOI:10.3969/j.issn.1001-1978.2014.05.014 |
| [11] |
DUAN J X, ZHOU Y, ZHOU A Y, et al. Calcitonin gene-related peptide exerts anti-inflammatory property through regulating murine macrophages polarization in vitro[J]. Molecular Immunology, 2017, 91: 105-113. DOI:10.1016/j.molimm.2017.08.020 |
| [12] |
HAN X J, SUN S F, SUN Y M, et al. Small molecule-driven NLRP3 inflammation inhibition via interplay between ubiquitination and autophagy: implications for Parkinson disease[J]. Autophagy, 2019, 15(11): 1860-1881. DOI:10.1080/15548627.2019.1596481 |
| [13] |
JIANG W, LI M Q, HE F, et al. Targeting the NLRP3 inflammasome to attenuate spinal cord injury in mice[J]. Journal of Neuroinflammation, 2017, 14(1): 207. DOI:10.1186/s12974-017-0980-9 |
| [14] |
GOLDMANN T, TAY T L, PRINZ M. Love and death: microglia, NLRP3 and the Alzheimer's brain[J]. Cell Research, 2013, 23(5): 595-596. DOI:10.1038/cr.2013.24 |
| [15] |
DAI W Y, WANG X G, TENG H L, et al. Celastrol inhibits microglial pyroptosis and attenuates inflammatory reaction in acute spinal cord injury rats[J]. International Immunopharmacology, 2019, 66: 215-223. DOI:10.1016/j.intimp.2018.11.029 |
| [16] |
GOMBAULT A, BARON L, COUILLIN I. ATP release and purinergic signaling in NLRP3 inflammasome activation[J]. Frontiers in Immunology, 2013, 3: 414. |
| [17] |
刘蓓桦, 候梁, 罗伟珏, 等. LPS与ATP共同诱导巨噬细胞中NLRP3炎症小体的激活[J]. 北京农学院学报, 2018, 33(1): 74-78. |
| [18] |
OMEIS I, NEIL J A, JAYSON N A, et al. Treatment of ce-rebral vasospasm with biocompatible controlled-release systems for intracranial drug delivery[J]. Neurosurgery, 2008, 63(6): 1011-1019. DOI:10.1227/01.NEU.0000327574.32000.9A |
| [19] |
XU M, LI C, ZHAO G Q, et al. The anti-inflammatory regulation of calcitonin gene-related peptide in mouse Aspergillus fumigatus keratitis[J]. International Journal of Ophthalmology, 2020, 13(5): 701-707. DOI:10.18240/ijo.2020.05.02 |
| [20] |
KUZAWIÑSKA O, LIS K, CESSAK G, et al. Targeting of calcitonin gene-related peptide action as a new strategy for migraine treatment[J]. Neurologia i Neurochirurgia Polska, 2016, 50(6): 463-467. DOI:10.1016/j.pjnns.2016.07.012 |
| [21] |
HARADA N, NARIMATSU N, KURIHARA H, et al. Stimulation of sensory neurons improves cognitive function by promoting the hippocampal production of insulin-like growth factor-Ⅰ in mice[J]. Translational Research: the Journal of Laboratory and Clinical Medicine, 2009, 154(2): 90-102. DOI:10.1016/j.trsl.2009.05.001 |
| [22] |
刘元, 郭俊峰, 蔡俊, 等. 降钙素基因相关肽通过降低炎性小体活性抑制巨噬细胞功能[J]. 免疫学杂志, 2017, 33(5): 400-404. |
| [23] |
RAYAMAJHI M, MIAO E A. Just say NO to NLRP3[J]. Nature Immunology, 2013, 14(1): 12-14. |
| [24] |
SHI L, RAO S, SUN H, et al. In vitro characterization of AA71, a potent and selective human monoclonal antibody against CGRP receptor[J]. The Journal of Headache and Pain, 2013, 14(1): 1. |
 2022, Vol. 58
2022, Vol. 58

