肌萎缩侧索硬化(ALS)是一种累及上、下运动神经元的进行性神经系统变性病[1],可以导致延髓、躯体部肌肉萎缩[2-3]。约90%的ALS病例是散发性的,只有10%的ALS病例为家族性的[4-5]。目前还没有有效的治疗方法可以阻止疾病进展。美国食品药品监督管理局(FDA)目前仅批准利鲁唑和依达拉奉作为有效延缓病程的药物[6]。有研究证实,家族性ALS中部分病人的发病与超氧化物歧化酶1(SOD1)基因突变有关[5, 7],还有一部分病人发病与TARDBP基因突变有关。目前认为TARDBP基因的突变可以导致异常TDP-43蛋白聚集而致病[7-9]。最新研究表明,TDP-43是ALS的病理性标志物。BRETTSCHNEIDER等[10-11]发现,异常聚集TDP-43在体内沉积具有病理特征性,从而提出4阶段分期,进一步突出了TDP-43在疾病进展中的作用。研究表明,百草枯(PQ)可以诱导SH-SY5Y细胞产生异常聚集的TDP-43蛋白[12]。
自噬是一种细胞进行自我吞噬的过程,更是清除细胞错误折叠蛋白质的关键机制。影响细胞自噬机制的主要是饥饿状态[13]、细胞凋亡[14]和某些药物[15]等。细胞自噬异常,可使异常或错误折叠的蛋白质聚集在细胞质、细胞核中,从而导致细胞器损伤及神经元功能障碍[16]。通过调节自噬可以减少神经变性病中的异常蛋白质聚集。天然小分子生物碱的调节自噬作用已经被广泛探究[15]。柯诺辛碱B(Cory B)作为一种天然小分子生物碱在帕金森病模型中可激活自噬、减少α突触核蛋白的表达[17]。但是,Cory B在ALS模型中的作用尚无明确的研究。故本研究用PQ处理细胞制备ALS模型,探讨Cory B是否可以通过调节自噬而发挥神经保护作用,以期为治疗ALS提供新方向和新思路。
1 材料与方法 1.1 药品与试剂所用Cory B购于MCE公司;PQ购于Sigma-Aldrich公司;SH-SY5Y细胞购于American Type Culture Collection公司;细胞培养耗材购于Corning公司;胎牛血清购于BI公司;所有抗体均购于Cell Signaling Technology公司;LC3B购于Abcam公司。
1.2 细胞培养取回细胞后先复苏细胞,再以800 r/min离心5 min,弃去上清液。用含体积分数0.10胎牛血清的DMEM/F12培养液重悬细胞,转移至培养瓶中,置于37 ℃、含体积分数0.05 CO2的培养箱中培养。每3~4 d按1∶6比例进行传代。根据细胞密度,将细胞接种于6孔板内,并用血细胞计数板计数,置于37 ℃、含体积分数0.05 CO2的培养箱中培养。
1.3 实验分组及处理实验分为正常对照组(Control组)、模型组(PQ组)和Cory B干预组(PQ+Cory B组)。Control组:用加入PBS缓冲液200 μL的培养液培养细胞24 h;PQ组:用加入PBS缓冲液100 μL和1 mmol/ L的PQ 100 μL的培养液培养细胞24 h;PQ+Cory B组:用加入设定浓度Cory B 100 μL的培养液预处理细胞12 h,再加入1 mmol/L的PQ 100 μL处理细胞12 h。在设定的时间点终止培养,进行下一步实验。
1.4 CCK8法检测细胞存活率收集各组细胞,培养24 h后接种于96孔板中。按1∶10的体积比加入CCK8试剂,37 ℃孵育1 h后,于酶标仪上测560 nm波长处光密度(OD)值。计算细胞存活率,细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值―空白组OD值)×100%。进行3次独立实验,结果取平均值。
1.5 细胞免疫荧光染色实验分组处理24 h,铺板细胞,待细胞种植6孔板贴于玻片后,用40 g/L多聚甲醛固定液固定细胞20 min,PBS浸洗。接着用5 g/L TritonX室温通透20 min,PBS浸洗。加入山羊血清封闭30 min,去除血清封闭液,加入LC3B一抗稀释液4 ℃孵育过夜。用PBS洗净一抗后,在避光条件下,加入荧光二抗稀释液孵育1 h。用PBS洗净二抗后,加入DAPI避光孵育5 min复染核,以PBS洗净DAPI,用抗荧光淬灭剂进行封片,观察并收集图像。
1.6 蛋白免疫印迹法(Western blot)检测实验分组处理24 h,收集细胞,用RIPA裂解液、PMFS和蛋白酶抑制剂配成的试剂提取蛋白。采用BCA法测定每组的蛋白浓度。SDS-PAGE凝胶电泳条件:80 V、40 min,120 V、45 min。电泳完毕,进行转膜,条件为295 mA恒流电转90 min。加入50 g/L脱脂奶粉置摇床上常温封闭1.5 h。去除封闭液,用TBST洗涤3次,每次10 min。加入按1∶1 000比例稀释的TDP-43(兔源)、GADPH(鼠源)、LC3B(兔源)一抗4 ℃过夜。去除一抗,使用TBST洗涤3次,每次10 min。加入按1∶5 000比例稀释的二抗(羊抗鼠和羊抗兔),置摇床上室温孵育1.5 h。去除二抗,使用TBST洗涤3次,每次10 min。最后用ECL发光液显影,使用Image J软件进行图像分析。以GADPH作为对照计算目的蛋白的相对表达量。
1.7 统计学方法用Graphpad Prism 8软件进行数据的统计分析。正态分布的计量数据以x±s形式表示,多组比较采用单因素方差分析,两组比较采用t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 PQ对SH-SY5Y细胞TDP-43聚集的影响根据先前的研究[18-20],用1 mmol/L PQ处理SH-SY5Y细胞12 h,然后进行Western blot检测。结果显示,PQ组细胞TDP-43(35 000)蛋白相对表达量为0.838±0.456,较Control组(0.600±0.012)的表达量明显增多(n=3,t=8.729,P<0.001)。见图 1。细胞免疫荧光染色结果显示,PQ诱导了SH-SY5Y细胞胞质内TDP-43(35 000)的异常聚集,该结果与Western blot检测结果一致。见图 2。
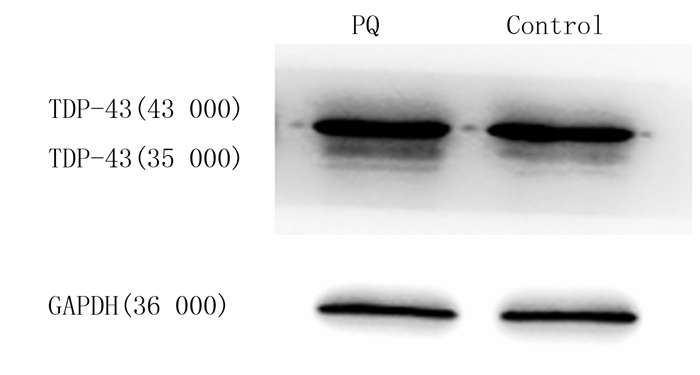 |
| 图 1 TDP-43蛋白表达Western blot检测 |
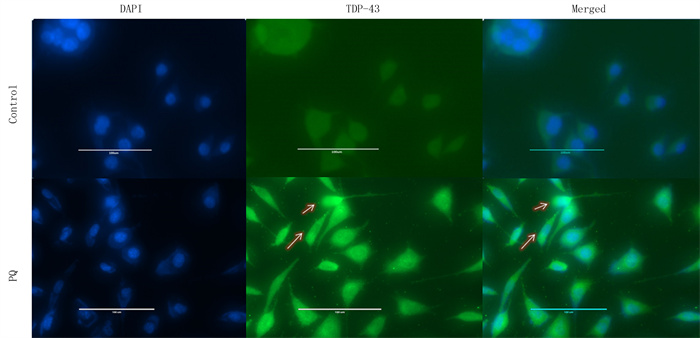 |
| SH-SY5Y细胞免疫荧光染色,箭头(↑)示异常TDP43聚集体。Scale bar为100 μm。 图 2 PQ对SH-SY5Y细胞TDP-43聚集影响的检测 |
CCK8法检测结果显示,Control组和PQ组的细胞存活率分别为1.070±0.043和0.351±0.041(n=3),PQ组的细胞存活率明显降低(t=20.930,P<0.001)。PQ+不同浓度Cory B组(Cory B浓度分别为10、15、20、25、30 μmol/L)细胞存活率分别为0.434±0.046、0.517±0.016、0.618±0.007、0.705±0.010、0.634±0.018(n=6),Cory B在一定浓度范围内,以剂量依赖的方式提高了1 mmol/L PQ诱导的SH-SY5Y细胞的存活率(F=179.800,P<0.001),当Cory B浓度为25 μmol/L时,细胞存活率达到峰值。提示Cory B具有神经保护作用,当Cory B浓度为25 μmol/L时细胞存活率最高,因此使用25 μmol/L的Cory B进行后续研究。
2.3 Cory B对PQ诱导的SH-SY5Y细胞自噬的影响为了研究Cory B是否可以诱导细胞自噬,采用LC3B抗体进行细胞免疫荧光染色。荧光显微镜下观察到,Control组细胞LC3B绿色点状荧光在胞质内分布较弥散、不清,聚集分布不明显;PQ组细胞LC3B在胞质内分布与Control组相似;与PQ组和Control组细胞相比较,PQ+Cory B组细胞内呈绿色点状荧光的LC3B明显增多。见图 3。Control组、PQ组和PQ+Cory B组的免疫荧光定量分别为0.105±0.002、0.161±0.002和0.089±0.004(n=3),3组比较差异有显著性(F=10.809,P<0.001)。表明Cory B可激活PQ诱导的细胞自噬。
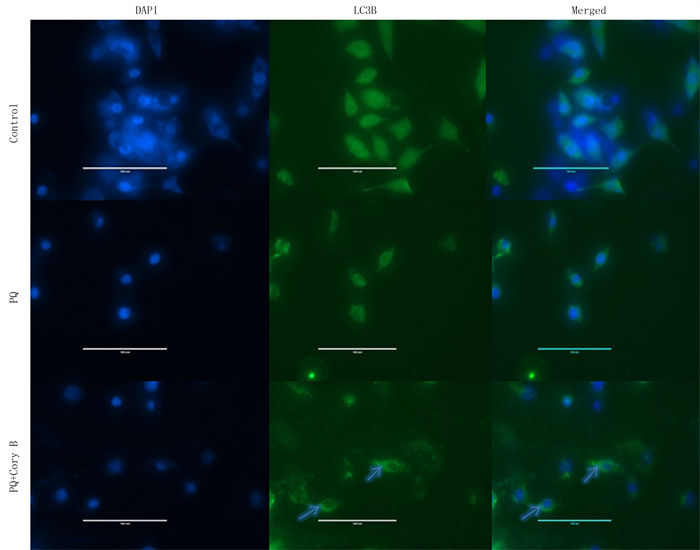 |
| LC3B蛋白在SH-SY5Y细胞胞质内呈点状聚集,箭头(↑)示自噬体生成。Scale bar为100 μm。 图 3 B对PQ诱导的SH-SY5Y细胞自噬影响的免疫荧光染色检测 |
LC3是自噬标志蛋白,一般分为分子量16 000的LC3-Ⅰ和分子量14 000的LC3-Ⅱ。自噬进行时,LC3-Ⅰ会向LC3-Ⅱ转化[21]。为了进一步验证Cory B的自噬诱导作用,采用Western blot方法检测LC的表达水平,并计算LC3-Ⅱ/LC3-Ⅰ比值。检测结果显示,Control组、PQ组、25.0 μmol/L Cory B组、PQ+12.5 μmol/L Cory B组和PQ+25.0 μmol/L Cory B组的LC3-Ⅱ/LC3-Ⅰ比值分别为2.099±0.165、0.785±0.049、4.212±0.355、1.754±0.116和5.099±0.472(n=5)。与PQ组和Control组相比,PQ+25.0 μmol/L Cory B组LC3-Ⅱ/LC3-Ⅰ比值明显升高(F=172.913,P<0.001)。实验进一步证实了Cory B可以促进PQ诱导的SH-SY5Y细胞自噬。见图 4。
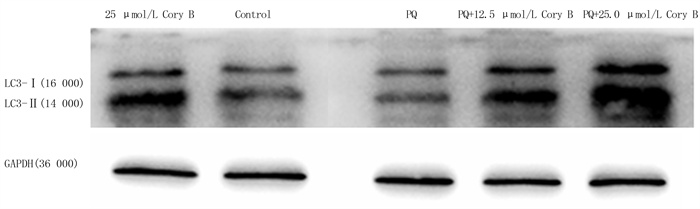 |
| 图 4 SH-SY5Y细胞LC3蛋白表达的Western blot检测 |
为了研究Cory B是否可以减少TDP-43蛋白异常聚集,采用Western blot检测TDP-43(35 000)蛋白的表达。结果显示,Control组、PQ组和PQ+Cory B组TDP-43(35 000)蛋白的相对表达量分别为0.570±0.330、0.953±0.336、0.449±0.223(n=3)。与Control组相比,PQ组的TDP-43(35 000)蛋白表达明显增高,而PQ+Cory B组的蛋白表达较PQ组明显下降(F=229.791,P<0.001)。表明Cory B可以减少PQ诱导的SH-SY5Y细胞异常的TDP-43蛋白聚集。见图 5。
 |
| 图 5 SH-SY5Y细胞TDP-43蛋白表达的Western blot检测 |
本研究根据先前的研究通过PQ的氧化应激作用诱导细胞产生异常聚集的TDP-43蛋白[12],制备病理性TDP-43聚集的ALS细胞模型。不仅观察到Cory B提高了PQ诱导的SH-SY5Y细胞的存活率,还观察到Cory B可以激活自噬进程,减少异常聚集TDP-43(35 000)蛋白的表达。
许多研究认为,帕金森病、阿尔茨海默病、ALS及亨廷顿病等神经系统变性疾病与自噬途径受损导致的蛋白质的异常聚集有关[22]。目前,关于通过调节自噬进程治疗神经变性疾病的研究很多,RAVIKUMAR等[23]在亨廷顿病的细胞模型中进行诱导自噬从而治疗疾病的研究;ROSCIC等[24]的研究报道了诱导自噬可以减少亨廷顿病模型中蛋白质异常聚集;STEELE等[25]也发现一些药物可以通过诱导自噬减少阿尔茨海默病模型中Aβ蛋白的异常聚集[26];最近的研究发现,p-香豆酸(巴西绿色蜂胶中的活性成分)通过自噬作用在Neuro2a细胞中对致病性SOD1引起的神经毒性起保护作用[27]。因此,激活自噬可能是清除神经变性疾病病理性蛋白质聚集的重要途径。
Cory B是钩藤中重要活性物质,为吲哚生物碱中的一种。钩藤碱、异钩藤碱、柯诺辛碱及Cory B互为同分异构体。钩藤对心血管系统及中枢神经系统均存在广泛的保护作用,在神经系统疾病治疗方面其应用广泛,在心血管系统疾病治疗方面,其用于治疗高血压、心律失常也并不罕见。Cory B作为一种天然小分子生物碱,具有许多同分异构体,CHEN等[28]研究发现,Cory B的一种同分异构体柯诺辛碱,也可以通过Akt/mTOR通路诱导自噬。本文研究结果表明,Cory B能够减少PQ诱导的SH-SY5Y细胞TDP-43蛋白的异常聚集,提高暴露于PQ的细胞的存活率,发挥神经保护作用。在自噬方面,本研究结果显示,Cory B可以促使LC3-Ⅰ向LC3-Ⅱ转化,并减少分子量35 000的TDP-43蛋白的异常聚集,表明Cory B可能通过促进自噬,分解异常聚集的蛋白质,发挥神经保护作用。但Cory B的具体作用机制目前仍不清楚。
以往的研究证明[17],Cory B主要通过Beclin-1依赖性途径调节细胞自噬。自噬具有细胞保护作用,但这并不意味着我们可以无限制地激活自噬,过度激活自噬可以导致神经元萎缩,同时也能引起细胞死亡[29-30]。对自噬进行更好的调控,可以使其达到治疗疾病的目的[31]。钩藤碱各种成分的作用,至今仍不完全清楚,但其对神经系统的保护作用,已经受到了广泛的关注。本文的研究结果表明,对细胞自噬进行调控,可以减少异常的蛋白质聚集,这进一步揭示了神经变性疾病的发病机制。这类天然小分子生物碱的自噬激活作用,虽然在抗肿瘤、抗衰老以及抗感染等方面有着重要作用,但在神经变性疾病治疗方面仍需要不断探索。由于实验条件的限制,本研究并没有进一步探究Cory B的自噬通路途径。但本研究结果为今后探讨Cory B的自噬激活作用与ALS之间的关系提供了参考方向,为治疗ALS提供了新思路。
| [1] |
KIERNAN M C, VUCIC S, CHEAH B C, et al. Amyotrophic lateral sclerosis[J]. The Lancet, 2011, 377(9769): 942-955. DOI:10.1016/S0140-6736(10)61156-7 |
| [2] |
TAYLOR J P, BROWN R H Jr, CLEVELAND D W. Decoding ALS: from genes to mechanism[J]. Nature, 2016, 539(7628): 197-206. |
| [3] |
BROWN R H Jr, AL-CHALABI A. Amyotrophic lateral sclerosis[J]. The New England Journal of Medicine, 2017, 377(16): 1602. DOI:10.1056/NEJMc1710379 |
| [4] |
TURNER M R, HARDIMAN O, BENATAR M, et al. Controversies and priorities in amyotrophic lateral sclerosis[J]. The Lancet Neurology, 2013, 12(3): 310-322. |
| [5] |
ANDERSEN P M. The genetics of amyotrophic lateral sclerosis (ALS)[J]. Supplements to Clinical Neurophysiology, 2004, 57: 211-227. |
| [6] |
ROTHSTEIN J D. Edaravone: a new drug approved for ALS[J]. Cell, 2017, 171(4): 725. DOI:10.1016/j.cell.2017.10.011 |
| [7] |
ARAI T, HASEGAWA M, AKIYAMA H, et al. TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis[J]. Biochemical and Biophysical Research Communications, 2006, 351(3): 602-611. |
| [8] |
NEUMANN M, SAMPATHU D M, KWONG L K, et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis[J]. Science (New York, N Y), 2006, 314(5796): 130-133. DOI:10.1126/science.1134108 |
| [9] |
WANG I F, WU L S, SHEN C K. TDP-43: an emerging new player in neurodegenerative diseases[J]. Trends in Molecular Medicine, 2008, 14(11): 479-485. DOI:10.1016/j.molmed.2008.09.001 |
| [10] |
BRETTSCHNEIDER J, DEL TREDICI K, TOLEDO J B, et al. Stages of pTDP-43 pathology in amyotrophic lateral sclerosis[J]. Annals of Neurology, 2013, 74(1): 20-38. |
| [11] |
BRETTSCHNEIDER J, ARAI K, DEL TREDICI K, et al. TDP-43 pathology and neuronal loss in amyotrophic lateral sclerosis spinal cord[J]. Acta Neuropathologica, 2014, 128(3): 423-437. |
| [12] |
LEI Y, ZHANG Z F, LEI R X, et al. DJ-1 suppresses cytoplasmic TDP-43 aggregation in oxidative stress-induced cell injury[J]. Journal of Alzheimer's Disease: JAD, 2018, 66(3): 1001-1014. |
| [13] |
HE L, ZHANG J, ZHAO J S, et al. Autophagy: the last defense against cellular nutritional stress[J]. Advances in Nutrition (Bethesda, Md), 2018, 9(4): 493-504. |
| [14] |
DOHERTY J, BAEHRECKE E H. Life, death and autophagy[J]. Nature Cell Biology, 2018, 20(10): 1110-1117. |
| [15] |
LAW B Y, CHAN W K, XU S W, et al. Natural small-molecule enhancers of autophagy induce autophagic cell death in apoptosis-defective cells[J]. Scientific Reports, 2014, 4: 5510. |
| [16] |
GHAVAMI S, SHOJAEI S, YEGANEH B, et al. Autophagy and apoptosis dysfunction in neurodegenerative disorders[J]. Progress in Neurobiology, 2014, 112: 24-49. |
| [17] |
LU J H, TAN J Q, DURAIRAJAN S S K, et al. Isorhynchophylline, a natural alkaloid, promotes the degradation of alpha-synuclein in neuronal cells via inducing autophagy[J]. Autophagy, 2012, 8(1): 98-108. |
| [18] |
PARKER S J, MEYEROWITZ J, JAMES J L, et al. Inhibition of TDP-43 accumulation by bis (thiosemicarbazonato)-copper complexes[J]. PLoS One, 2012, 7(8): e42277. DOI:10.1371/journal.pone.0042277 |
| [19] |
GABBIANELLI R, FERRI A, ROTILIO G, et al. Aberrant copper chemistry as a major mediator of oxidative stress in a human cellular model of amyotrophic lateral sclerosis[J]. Journal of Neurochemistry, 1999, 73(3): 1175-1180. |
| [20] |
YANG W, TIFFANY-CASTIGLIONI E. The bipyridyl herbicide paraquat produces oxidative stress-mediated toxicity in human neuroblastoma SH-SY5Y cells: relevance to the dopami-nergic pathogenesis[J]. Journal of Toxicology and Environmental Health Part A, 2005, 68(22): 1939-1961. |
| [21] |
PARZYCH K R, KLIONSKY D J. An overview of autophagy: morphology, mechanism, and regulation[J]. Antioxidants & Redox Signaling, 2014, 20(3): 460-473. |
| [22] |
WU H J, CHEN S, AMMAR A B, et al. Crosstalk between macroautophagy and chaperone-mediated autophagy: implications for the treatment of neurological diseases[J]. Molecular Neurobiology, 2015, 52(3): 1284-1296. |
| [23] |
RAVIKUMAR B, VACHER C, BERGER Z, et al. Inhibition of mTOR induces autophagy and reduces toxicity of polyglutamine expansions in fly and mouse models of Huntington di-sease[J]. Nature Genetics, 2004, 36(6): 585-595. |
| [24] |
ROSCIC A, BALDO B, CROCHEMORE C, et al. Induction of autophagy with catalytic mTOR inhibitors reduces huntingtin aggregates in a neuronal cell model[J]. Journal of Neurochemistry, 2011, 119(2): 398-407. |
| [25] |
STEELE J W, GANDY S. Latrepirdine (Dimebon®), a potential Alzheimer therapeutic, regulates autophagy and neuropathology in an Alzheimer mouse model[J]. Autophagy, 2013, 9(4): 617-618. |
| [26] |
CACCAMO A, MAJUMDER S, RICHARDSON A, et al. Molecular interplay between mammalian target of rapamycin (mTOR), amyloid-β, and tau: effects on cognitive impairments[J]. Journal of Biological Chemistry, 2010, 285(17): 13107-13120. |
| [27] |
UEDA T, ITO T, KURITA H, et al. P-coumaric acid has protective effects against mutant copper-zinc superoxide dismutase 1 via the activation of autophagy in N2a cells[J]. International Journal of Molecular Sciences, 2019, 20(12): E2942. |
| [28] |
CHEN L L, SONG J X, LU J H, et al. Corynoxine, a natural autophagy enhancer, promotes the clearance of alpha-synuclein via Akt/mTOR pathway[J]. Journal of Neuroimmune Pharmacology, 2014, 9(3): 380-387. |
| [29] |
BREDESEN D E, RAO R V, MEHLEN P. Cell death in the nervous system[J]. Nature, 2006, 443(7113): 796-802. |
| [30] |
RAMI A. Review: autophagy in neurodegeneration (firefighter and/or incendiarist)[J]. Neuropathology and Applied Neuro-biology, 2009, 35(5): 449-461. |
| [31] |
RUBINSZTEIN D C, GESTWICKI J E, MURPHY L O, et al. Potential therapeutic applications of autophagy[J]. Nature Reviews Drug Discovery, 2007, 6(4): 304-312. |
 2022, Vol. 58
2022, Vol. 58

