2. 青岛大学附属烟台毓璜顶医院病理科;
3. 青岛大学附属医院病理科
结直肠癌是我国最常见的消化道恶性肿瘤之一,近30年内的发病率以平均每年3%~4%上升。我国结直肠癌发病例数占全世界发病总例数的18.6%,死亡例数占全世界死亡总例数的20.1%,均占据第1位[1-2]。肿瘤的位置、浸润深度、淋巴结转移及大体类型是影响结直肠癌病人根治术后复发、转移的重要因素,也是判断结直肠癌病人预后情况的关键因素[2]。已有研究结果表明,结直肠癌的发生发展与上皮-间充质转化(EMT)机制相关[3-4]。富含AT序列的特异性结合蛋白2(SATB2)是一种核基质相关蛋白,属于SATB家族,SATB2通过与核基质附着区(MAR)相结合,激活及调控多个基因转录的过程。SATB2在大脑皮质、消化道的腺上皮细胞、骨髓及免疫系统中有较高的表达。最近有研究结果表明,SATB2不但在成骨细胞分化和中枢神经系统发育过程中起着重要的作用,而且在结直肠癌中有着高度的敏感性和特异性[5-7]。S100钙结合蛋白P(S100P)属于S100家族成员,是一种小型的钙离子结合蛋白。S100P与多种肿瘤如胰腺癌、乳癌、前列腺癌、结直肠癌、肺癌、胃癌等相关,其蛋白的异常表达与肿瘤细胞的生长、耐药性、转移以及预后不良有关。已有研究结果表明,S100P的表达对结直肠癌的生长转移有着重要的作用[8]。本文研究应用免疫组织化学的方法检测SATB2、S100P蛋白在结直肠癌组织中的表达,分析二者与肿瘤临床病理学特征的关系,以及与EMT相关蛋白β-连环蛋白(β-catenin)、上皮性钙黏附蛋白E(E-cadherin)之间的相关性,探讨SATB2及S100P蛋白在结直肠癌中的异常表达及其促进肿瘤浸润与转移的可能机制。现将结果报告如下。
1 材料与方法 1.1 标本及其来源随机选取青岛大学附属烟台毓璜顶医院手术切除、经病理检查诊断为结直肠腺癌的癌组织及其癌旁正常黏膜组织各100例。所有病人手术前均未接受放疗及化疗。100例病人中,男61例,女39例; 年龄27~82岁,平均(63.57±9.95)岁。肿瘤位于左半结肠77例,右半结肠23例; 低分化24例,中分化66例,高分化10例; 无淋巴结转移55例,1~3个淋巴结转移29例,>3个淋巴结转移16例。
1.2 实验试剂小鼠抗人SATB2单克隆抗体、S100P单克隆抗体、β-catenin单克隆抗体及E-cadherin单克隆抗体均购自北京中杉金桥生物技术有限公司,DAB染色液以及其免疫组化试剂盒均为罗氏诊断产品(上海)有限公司产品。
1.3 检测指标及方法标本经40 g/L甲醛固定,常规取材、石蜡包埋,4 μm厚连续切片6张,分别行免疫组化染色和苏木精-伊红(HE)染色,检测SATB2、S100P、β-catenin和E-cadherin的表达情况。根据试剂盒说明书进行操作。用已知阳性的切片作阳性对照,用PBS代替一抗作阴性对照。
1.4 结果判断SATB2阳性表达定位于细胞核; S100P阳性表达定位于细胞浆,少量定位于细胞膜以及细胞核; E-cadherin阳性表达定位于细胞膜。以细胞膜呈不同程度的棕黄色染色为阳性染色。用二级计分法对染色结果进行判定,首先根据阳性染色细胞所占比例评分:0分,< 5%;1分,6%~25%;2分,26%~50%;3分,51%~75%;4分,>75%。再根据细胞阳性染色程度计分:0分,未着色; 1分,淡黄色; 2分,黄色; 3分,棕褐色。最后根据两者分值的乘积判断结果:阴性,< 1分; 弱阳性,2~4分; 阳性,5~8分; 强阳性,>9分。
β-catenin正常阳性表达定位于细胞膜,呈棕黄色细小颗粒状,且阳性细胞数>70%;而β-catenin的异常表达指细胞膜阳性表达缺失以及细胞质/细胞核异位阳性表达。凡出现细胞膜阳性表达减弱或缺失为异常表达,≥10%的细胞质/细胞核异位阳性表达也视为异常表达[9]。
1.5 统计学处理应用SPSS 19.0软件进行统计学处理。计数资料比较采用卡方检验,相关分析采用Spearman等级相关方法。以P < 0.05为差异有统计学意义。
2 结果 2.1 结直肠癌组织和癌旁正常黏膜组织SATB2、S100P、β-catenin、E-cadherin表达比较结直肠癌组织SATB2、S100P、E-cadherin阳性表达率分别为90%、65%、85%,β-catenin异常表达率为46%;癌旁正常黏膜组织中SATB2、S100P、E-cadherin阳性表达率分别为98%、4%、100%,β-catenin异常表达率为0。两种组织SATB2、S100P、β-catenin、E-cadherin表达比较,差异有统计学意义(χ2=5.674~82.332,P < 0.05)。见图 1。
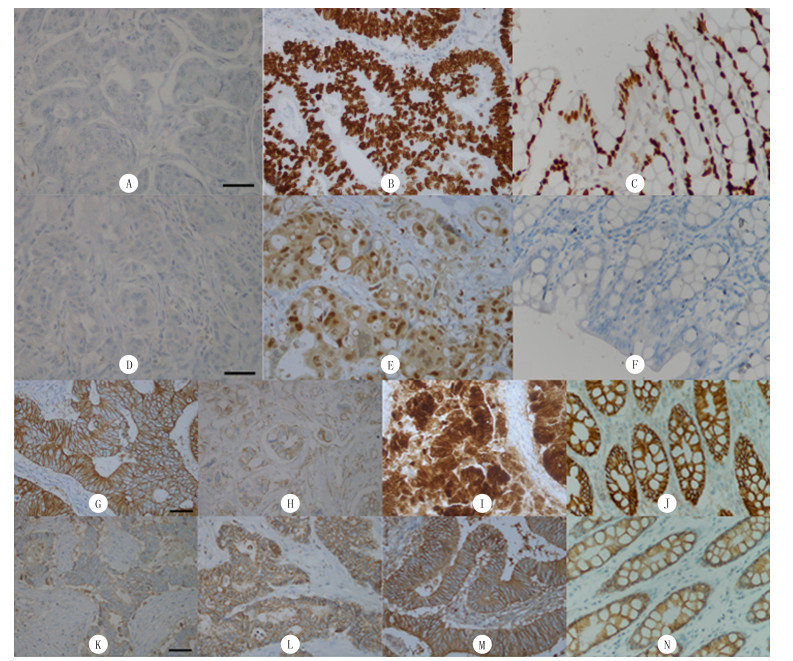 |
| A:结直肠癌组织中SATB2阴性表达; B:结直肠癌组织中SATB2阳性表达; C:癌旁正常黏膜组织中SATB2阳性表达; D:结直肠癌组织中S100P阴性表达; E:结直肠癌组织中S100P阳性表达; F:癌旁正常黏膜组织中S100P阴性表达; G:结直肠癌组织中β-catenin的正常表达; H:结直肠癌组织中β-catenin的异常表达,细胞膜表达缺失; I:结直肠癌组织中β-catenin的异常表达,定位于细胞核、细胞质; J:癌旁正常黏膜组织中β-catenin的正常表达; K:结直肠癌组织中E-cadherin弱阳性表达; L:结直肠癌组织中E-cadherin阳性表达; M:结直肠癌组织中E-cadherin强阳性表达; N:癌旁正常黏膜组织中E-cadherin强阳性表达。免疫组化染色,400倍。 图 1 结直肠癌和癌旁正常黏膜组织中SATB2、S100P、β-catenin和E-cadherin表达 |
SATB2表达与结直肠癌病人肿瘤直径、分化程度、淋巴结转移有关(χ2=14.733~19.424,P < 0.05);与性别、年龄、肿瘤部位、浸润深度、TNM分期无关(P>0.05)。S100P表达与结直肠癌病人肿瘤分化程度、淋巴结转移有关(χ2=13.298、14.945,P < 0.05);与性别、年龄、肿瘤部位、肿瘤直径、浸润深度、TNM分期无关(P>0.05)。见表 1、2。
| 表 1 SATB2蛋白表达与结直肠癌病人临床病理特征的关系(例) |
|
|
| 表 2 S100P蛋白表达与结直肠癌病人临床病理特征的关系(例) |
|
|
结直肠癌组织SATB2与S100P的表达呈负相关(r=-0.254,P < 0.05),与β-catenin的异常表达呈负相关(r=-0.258,P < 0.05),与E-cadherin表达不相关(r=-0.045,P>0.05);S100P与β-catenin的异常表达呈正相关(r=0.284,P < 0.05),与E-cadherin表达不相关(r=0.128,P>0.05)。见表 3~5。
| 表 3 结直肠癌组织中SATB2和S100P表达的相关性(例) |
|
|
| 表 4 结直肠癌组织中SATB2与β-catenin、E-cadherin表达的相关性(例) |
|
|
| 表 5 结直肠癌组织中S100P与β-catenin、E-cadherin表达的相关性(例) |
|
|
国内外研究均发现,在结直肠癌组织中存在SATB2的蛋白表达降低,并与结直肠癌的转移和浸润紧密相关[10-11]。何兴状等[12]应用实时荧光定量PCR方法检测了120例结直肠癌及其癌旁组织中SATB2 mRNA的表达, 结果显示72.5%的癌组织SATB2 mRNA低表达,而76.6%的癌旁组织中SATB2 mRNA高表达; CCK-8法与细胞划痕实验结果表明,在SW480、LOVO细胞中SATB2蛋白表达下调增强了细胞增殖以及转移的能力,认为SATB2基因可能为结直肠癌新的治疗靶点。最近几年,国内外学者在结直肠癌中S100P蛋白异常表达方面的研究也越来越多。FUENTES等[13]研究发现,结肠癌中S100P蛋白特异性表达,在SW480结肠癌细胞株(本身不表达S100P蛋白)中导入外源性的S100P基因,SW480结肠癌细胞株的增殖和转移能力都有明显的提高。李晓燕等[14]的研究也表明,结直肠癌组织中S100P蛋白的表达高于正常组织,且S100P表达与肿瘤组织的TNM分期和淋巴结转移有相关性,认为S100P在人结直肠癌的发生、发展中可能有一定的作用。
本实验结果显示,结直肠癌组织中SATB2蛋白表达明显低于癌旁正常黏膜组织,并且与肿瘤直径、分化程度、淋巴结转移有关,而与性别、年龄、肿瘤部位、浸润深度、TNM分期等无关; 而S100P蛋白在结直肠癌组织中表达高于癌旁正常黏膜组织,并与肿瘤分化程度、淋巴结转移有关,与性别、年龄、肿瘤部位、肿瘤直径、浸润深度、TNM分期等无关。提示SATB2和S100P基因可能参与结直肠癌的发生和进展过程,检测SATB2和S100P在结直肠癌中的表达水平可反映肿瘤的生物学行为。
多项研究表明,结直肠癌发生与Wnt、EGFR信号通路的激活、抑癌基因失去活性及TGF β信号的缺失等因素有关[15]。王凤等[4]对150例结直肠癌组织SATB2及EMT相关蛋白表达检测发现,结直肠癌组织SATB2蛋白的低表达促进β-catenin蛋白的异常表达,从而促进了EMT的发生。有研究表明,β-catenin是Wnt通路的关键性分子之一,可激活Wnt通路[16]。当肿瘤发生时,S100P蛋白与其靶蛋白钙周期结合蛋白(CacyBP/SIP)结合,阻止β-catenin的正常降解,使其含量剧增,促使Wnt信号通路激活,进而促进肿瘤发生与发展[17]。SHEN等[17]研究显示,S100P的过度表达与结肠癌的侵袭和转移表型有关,该表型与EMT有关,且呈晚期糖基化终产物受体(RAGE)依赖性。
本研究相关分析结果显示,结直肠癌组织中SATB2蛋白表达与S100P蛋白表达呈负相关,且与β-catenin蛋白异常表达呈负相关; S100P蛋白表达与β-catenin蛋白异常表达呈正相关。提示结直肠癌组织中可能存在SATB2与S100P基因异常激活或失活,导致SATB2与S100P蛋白异常表达,引起β-catenin积聚和蛋白的异常表达,激活Wnt信号通路,介导结直肠癌EMT的发生,最终促进了结直肠癌肿瘤细胞的增殖与转移。
综上所述,增加SATB2蛋白的表达以及阻断S100P蛋白与其靶蛋白CacyBP/SIP结合,可能会阻止β-catenin蛋白的异常表达、促进β-catenin蛋白的正常降解,从而抑制结直肠癌EMT的持续发生,为结直肠癌的分子靶向治疗提供新的思路。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
BÖCKELMAN C, ENGELMANN B E, KAPRIO T, et al. Risk of recurrence in patients with colon cancer stage Ⅱ and Ⅲ: a systematic review and meta-analysis of recent literature[J]. Acta Oncologica (Stockholm, Sweden), 2015, 54(1): 5-16. DOI:10.3109/0284186X.2014.975839 |
| [3] |
张扬, 吕杨, 钟诚, 等. BCYRN1对结直肠癌转移表型的影响及其机制探讨[J]. 现代肿瘤医学, 2019, 27(13): 2344-2349. DOI:10.3969/j.issn.1672-4992.2019.13.026 |
| [4] |
王凤, 陈世荣, 樊峰, 等. 结直肠癌组织SATB2蛋白表达与上皮-间充质转化相关性研究[J]. 中华肿瘤防治杂志, 2015, 22(19): 1540-1543. |
| [5] |
吕京澴, 周晓军. 核基质结合蛋白SATB2的鉴别诊断价值及其在恶性肿瘤中的作用研究进展[J]. 中华病理学杂志, 2017, 46(11): 813-816. DOI:10.3760/cma.j.issn.0529-5807.2017.11.019 |
| [6] |
NAIK R, GALANDE S. SATB family chromatin organizers as master regulators of tumor progression[J]. Oncogene, 2019, 38(12): 1989-2004. DOI:10.1038/s41388-018-0541-4 |
| [7] |
程凯, 何燕, 章如松, 等. SATB2在胃肠腺癌中的表达及其诊断价值[J]. 诊断病理学杂志, 2018, 25(2): 90-93, 98. |
| [8] |
江泽, 宋振川, 李胜水, 等. 人结直肠癌组织中S100P蛋白的表达及临床意义[J]. 临床误诊误治, 2012, 25(11): 52-54. |
| [9] |
MARUYAMA K, OCHIAI A, AKIMOTO S, et al. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer[J]. Oncology, 2000, 59(4): 302-309. DOI:10.1159/000012187 |
| [10] |
MEZHEYEUSKI A, PONTEN F, EDQVIST P H, et al. Metastatic colorectal carcinomas with high SATB2 expression are associated with better prognosis and response to chemotherapy: a population-based Scandinavian study[J]. Acta Oncologica (Stockholm, Sweden), 2020, 59(3): 284-290. DOI:10.1080/0284186X.2019.1691258 |
| [11] |
YANG D Q, LI R Z, XIA J F, et al. miR-3666 suppresses cellular proliferation and invasion in colorectal cancer by targeting SATB2[J]. Molecular Medicine Reports, 2018, 18(6): 4847-4854. |
| [12] |
何兴状, 马川, 牟辉, 等. SATB2基因表达对结直肠癌细胞增殖和转移能力的影响[J]. 湖南师范大学学报(医学版), 2018, 15(3): 24-28. |
| [13] |
FUENTES M K, NIGAVEKAR S S, ARUMUGAM T, et al. RAGE activation by S100P in colon cancer stimulates growth, migration, and cell signaling pathways[J]. Diseases of the Colon and Rectum, 2007, 50(8): 1230-1240. DOI:10.1007/s10350-006-0850-5 |
| [14] |
李晓燕, 张启芳, 张海莲, 等. S100P蛋白在结直肠癌中的表达及其意义[J]. 现代医学与健康研究(电子版), 2019(3): 82-84. |
| [15] |
包莹, 曹培国. 结直肠癌肝转移发生的相关信号通路研究进展[J]. 中国肿瘤, 2020, 29(2): 134-139. |
| [16] |
PAL I, RAJESH Y, BANIK P, et al. Prevention of epithelial to mesenchymal transition in colorectal carcinoma by regulation of the E-cadherin-β-catenin-vinculin axis[J]. Cancer Letters, 2019, 452: 254-263. |
| [17] |
SHEN Z Y, FANG Y, ZHEN L, et al. Analysis of the predictive efficiency of S100P on adverse prognosis and the pathoge-nesis of S100P-mediated invasion and metastasis of colon adenocarcinoma[J]. Cancer Genetics, 2016, 209(4): 143-153. |
 2021, Vol. 57
2021, Vol. 57

