干细胞凭借自身强分化和自我更新能力在细胞治疗策略中有着较好的应用前景,但干细胞治疗面临的问题是稳定高效细胞来源相对匮乏[1]。脂肪来源的间充质干细胞(ADMSCs)因相较骨髓、脐带来源的间充质干细胞具有较易收集并且提取过程相对简单的优点,成为目前应用较为广泛的间充质干细胞[2-4]。ADMSCs的提取方法不同是否会影响其生物学活性尚不清楚。本研究分别应用直接消化法和干细胞基质胶消化法分离提取ADMSCs,比较其增殖活力、成骨、成脂定向分化能力的差异。
1 材料与方法 1.1 实验材料ADMSCs来自临床吸脂术后废弃的脂肪组织;实验所用的高糖DMEM、DME/F12培养基均来自美国Hyclone公司;链霉素、胰蛋白酶、青霉素、抗体稀释液购于新赛美公司;油红O和茜素红S染料购于美国Sigma公司;胶原酶P购于美国Roche公司;A、B型脂肪转换器购于江苏凯帕公司;小鼠抗人CD105、CD73、CD45、CD14、CD34、CD90、HLA-DR直标抗体均购于美国BD公司;过氧化物酶体激活受体γ(PPAR-γ)和runt转录因子2(RUNX-2)抗体购于上海abcam公司。
1.2 实验方法 1.2.1 基质胶消化法分离提取ADMSCs参考YAO等[5]来自脂肪组织的胞外基质胶制备方法,在此基础上加以改进。将脂肪组织混液转移至50 mL离心管中,以1 500 r/min离心3 min后脂肪组织可见明显分层;将低密度脂肪层应用B型转换头反复推注破坏脂肪组织,离心(1 500 r/min,5 min)得到下层胶状物即低密度基质胶;高密度脂肪层则通过A型转换头推注制备高密度基质胶。等体积加入0.5 g/L胶原酶P,37 ℃摇床定速摇晃消化30 min,PBS清洗重悬,将获得的高密度基质胶、低密度基质胶底部细胞沉淀均接种于T75细胞培养瓶中,初始接种密度为2.0×106/cm2。应用此种提取方法分别获得高密度脂肪间充质干细胞(G MSC)组和低密度脂肪间充质干细胞(D MSC)组的ADMSCs。
1.2.2 直接消化法分离提取ADMSCs将脂肪组织混液转移至50 mL离心管中(用量同基质胶消化法),使用适量PBS液清洗,700 r/min离心4 min后吸弃下层PBS液保留上层脂肪组织, 等体积加入0.5 g/L胶原酶P,37 ℃摇床定速摇晃消化30 min, 消化完成后应用1.2.1方法接种细胞,获得脂肪间充质干细胞(MSC组)。
取3组传代至第5代细胞用于后续实验。
1.2.3 流式细胞术鉴定ADMSCs细胞免疫学表型细胞以每孔1.2×106/cm2密度接种于6孔板内,观察其生长状态,达到80%~90%融汇时收集至EP管中,PBS清洗、重悬,分别加入相应直标抗体,4 ℃孵育30 min,使用PBS清洗未结合的抗体,重复清洗1次后使用400 μL的PBS液重悬,在流式细胞仪上检测各组ADMSCs的免疫学表型。
1.2.4 细胞增殖活力检测细胞以每孔8×104/cm2密度接种于96孔板,细胞正常贴壁生长后,应用CCK-8试剂盒检测细胞增殖活力,按试剂盒说明进行操作,使用酶标仪检测各组的吸光度值,以其表示细胞的增殖活力。
1.2.5 ADMSCs体外成骨、成脂诱导及鉴定细胞以每孔2.5×105/cm2密度接种于24孔板内,隔天更换新配制的成骨、成脂诱导分化培养基,此后隔3 d更换新鲜诱导培养基。鉴定:按照操作指南的方法配制碱性磷酸酶染色液、1 g/L浓度茜素红S染色工作液及油红O染色工作液,将诱导12 d后的各组ADMSCs使用PBS冲洗3次,40 g/L多聚甲醛固定15 min,固定完成后洗3次,加入染色液,置于37 ℃恒温箱中孵育30 min;取出后使用PBS洗3次,光镜观察3组细胞碱性磷酸酶蓝色沉淀、细胞成骨分化后红色钙质结节、细胞成脂分化后细胞内红色脂滴的产生情况。
1.2.6 Real-time PCR检测成脂相关基因PPAR-γ和成骨相关基因RUNX-2的mRNA表达细胞以每孔1.2×106/cm2密度接种于6孔板内,进行成脂、成骨诱导分化。参照RNA总提取试剂说明书的方法分别提取成骨诱导3 d后和成脂诱导6 d后各组细胞总RNA,使用逆转录试剂盒行逆转录。条件为:25 ℃,5 min;42 ℃,30 min;85 ℃,5 min。参照SYBR Green Master Mix(No Rox)试剂盒操作手册方法进行Real-time PCR检测。以GAPDH作为内参照基因,通过循环扩增的ct值分析PPAR-γ和RUNX-2的mRNA表达。每个实验组样品设置3个复孔,重复实验3次。
1.2.7 Western blot方法检测成脂及成骨蛋白表达细胞以每孔1.2×106/cm2密度接种于6孔板内,成脂、成骨诱导分化后,使用RIPA裂解液裂解细胞,提取细胞蛋白样品,按照SDS-PAGE凝胶试剂盒操作指南制胶,恒压电泳将所提取的蛋白样品分离,随后恒流条件下转移蛋白到PVDF膜;使用100 g/L的脱脂奶粉室温封闭1 h,然后分别加入GADPH、RUNX-2、PPAR-γ的一抗4 ℃孵育过夜, 隔天洗膜后加入二抗室温孵育1 h;使用ECL发光检测试剂盒显影。以GAPDH作为内参照蛋白,Image J软件分析蛋白电泳条带灰度值。实验重复3次。
1.3 统计学分析使用GraphPad Prism 8、SPSS 26软件进行统计学处理。计量资料数据以x±s表示,数据间比较采用单因素方差分析;具有组别和时间两种因素计量资料比较采用双因素方差分析,两组之间数据比较使用LSD法。P < 0.05表示差异有显著性。
2 结果 2.1 各组ADMSCs生长形态和免疫表型鉴定各组ADMSCs在原代细胞时期均为贴壁生长的梭形集聚生长;细胞培养至第3代时各组形态均为梭型,呈旋涡、鱼群状生长。3组第5代ADMSCs免疫表型鉴定结果见图 1和表 1,均符合国际细胞学会对间充质干细胞的定义标准。
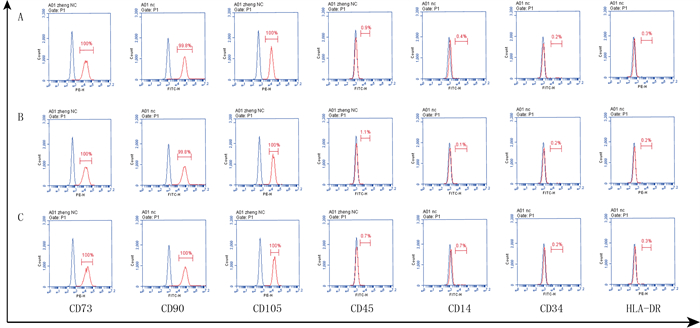 |
| A为MSC组;B为D MSC组;C为G MSC组。 图 1 流式细胞术检测ADMSCs免疫表型 |
| 表 1 各组ADMSCs免疫表型(χ/%) |
|
|
ADMSCs增殖活力在培养时间和组别之间存在交互作用(F=194.529,P < 0.05)。基质胶消化法得到的G MSC组和D MSC组细胞相对于直接消化法得到的MSC组细胞在培养第3天的增殖活力更高(F=727.139,P < 0.05)。见表 2。
| 表 2 各组ADMSCs增殖活力的比较(n=3, x±s) |
|
|
双因素方差分析显示,成脂标志基因PPAR-γ的mRNA表达在诱导时间和组别之间具有交互作用(F=26.321,P < 0.05);多重比较显示,诱导分化后0、3 d各组PPAR-γ mRNA表达无明显差异,成脂诱导6~12 d的G MSC组和D MSC组PPAR-γ的mRNA表达高于MSC组,差异有显著意义(F=40.260~157.532,P < 0.05)。见表 3。油红O染色观察显示,诱导至12 d时G MSC组和D MSC组较MSC组有相对多的油红O染液着色的小脂滴(图 2A)。
| 表 3 各组ADMSCs成脂诱导后PPAR-γ mRNA表达比较(n=3,x±s) |
|
|
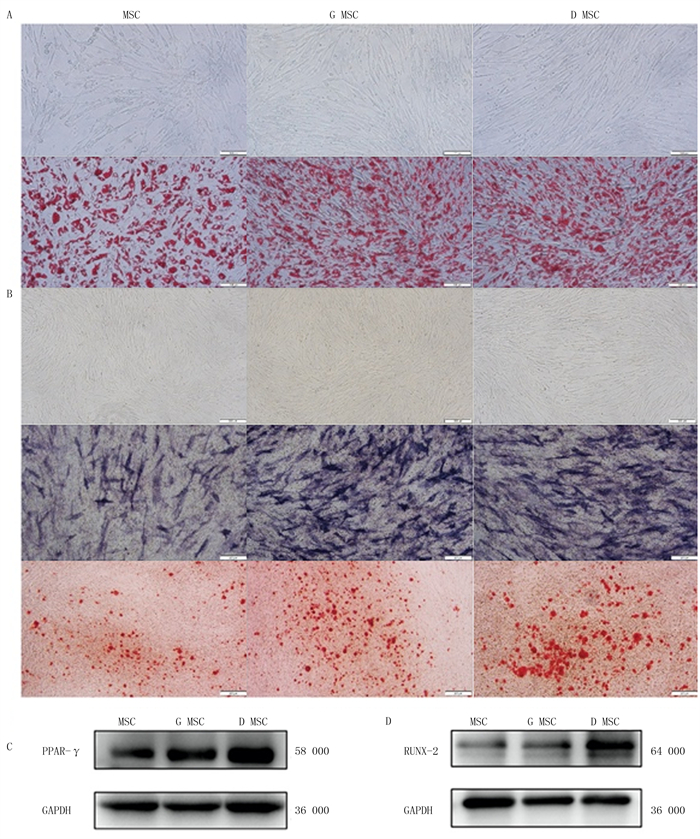 |
| A: 未诱导及成脂诱导12 d后3组ADMSCs的油红O染色;B: 未诱导及成骨诱导12 d后3组ADMSCs碱性磷酸酶和茜素红S染色;C: 成脂诱导6 d后3组ADMSCs PPAR-γ蛋白表达; D:成骨诱导3 d后3组ADMSCs RUNX-2蛋白表达。标尺:A为100 μm;B为200 μm。 图 2 各组ADMSCs成脂、成骨分化能力比较 |
双因素方差分析显示,成骨标志基因RUNX-2的mRNA表达在诱导时间和组别之间具有交互作用(F=113.162,P < 0.05);多重比较显示,成骨诱导3~12 d时G MSC组和D MSC组RUNX-2 mRNA表达均高于MSC组,差异有统计学意义(F=58.018~763.253,P < 0.05)。见表 4。在诱导至12 d时碱性磷酸酶和茜素红S染色显示,基质胶消化法得到的两组细胞有更多的蓝色碱性沉淀物以及红色钙质结节(图 2B)。
| 表 4 各组ADMSCs RUNX-2 mRNA表达比较(n=3,x±s) |
|
|
单因素方差分析显示,成脂诱导分化6 d后G MSC组和D MSC组PPAR-γ蛋白表达水平高于MSC组(F=1 501.475,P < 0.05)。成骨诱导分化3 d后G MSC组和D MSC组RUNX-2蛋白表达高于MSC组(F=2 402.049,P < 0.05)。见表 5。
| 表 5 各组ADMSCs的PPAR-γ、RUNX-2蛋白表达比较(n=3, x±s) |
|
|
间充质干细胞在抗衰老、提高机体免疫力和再生医学中的应用是人们一直以来所关注的。脂肪移植术目前作为一种公认的外科手术被应用在整形美容领域以及外伤组织修复中,ADMSCs的加入使得脂肪移植效果提高。其机制为:ADMSCs具有高度分化的能力,可以分化为成熟的脂肪细胞促进脂肪生成,也可因为自身的旁分泌机制分泌细胞因子、趋化因子促使血管再生,促进损伤部位的组织再生能力,提高脂肪移植物在体内的正常存活率[6-7]。
本文研究结果显示,用基质胶消化法分离得到的ADMSCs成脂诱导分化后标志基因PPAR-γ的mRNA和蛋白表达水平较直接消化法更高,提示该方法分离获取的ADMSCs有更好的成脂分化的能力。ADMSCs应用于再生医学领域的另一个重要原因是其具有成骨分化能力。有研究显示,良好的生物材料可以构建一个相对良好的骨再生微环境,同时有ADMSCs的加入会进一步促进骨组织的形成[8-9];注射自体ADMSCs用于治疗骨关节炎的安全性及有效性评估显示,ADMSCs的应用缓解了骨关节炎病灶区的疼痛,同时减少了再生骨组织的缺损[10]。本研究结果显示,基质胶消化法分离提取的ADMSCs有更高的RUNX-2 mRNA和蛋白表达水平,提示其拥有较好的成骨分化潜能。这些结果表明,ADMSCs应用于整形美容、组织充填、骨生理以及骨再生领域是十分有竞争力的。ADMSCs的应用已经不仅局限于整形美容和再生医学领域,其具有的免疫调节能力、旁分泌能力也被证实对肝脏、呼吸循环系统疾病、神经系统疾病等都有着一定的缓解作用[11-12]。但其机制仍需进一步的研究。
| [1] |
PETRINI C. Bioethics of clinical applications of stem cells[J]. International Journal of Molecular Sciences, 2017, 18(4): 814. DOI:10.3390/ijms18040814 |
| [2] |
HASSANSHAHI A, HASSANSHAHI M, KHABBAZI S, et al. Adipose-derived stem cells for wound healing[J]. Journal of Cellular Physiology, 2019, 234(6): 7903-7914. DOI:10.1002/jcp.27922 |
| [3] |
SHI R F, JIN Y P, HU W W, et al. Exosomes derived from mmu_circ_0000250-modified adipose-derived mesenchymal stem cells promote wound healing in diabetic mice by inducing miR-128-3p/SIRT1-mediated autophagy[J]. American Journal of Physiology Cell Physiology, 2020, 318(5): C848-C856. DOI:10.1152/ajpcell.00041.2020 |
| [4] |
MURATA D, FUJIMOTO R, NAKAYAMA K. Osteochondral regeneration using adipose tissue-derived mesenchymal stem cells[J]. International Journal of Molecular Sciences, 2020, 21(10): E3589. DOI:10.3390/ijms21103589 |
| [5] |
YAO Y, DONG Z Q, LIAO Y J, et al. Adipose extracellular matrix/stromal vascular fraction gel: a novel adipose tissue-derived injectable for stem cell therapy[J]. Plastic and Reconstructive Surgery, 2017, 139(4): 867-879. DOI:10.1097/PRS.0000000000003214 |
| [6] |
MOU S, ZHOU M R, LI Y, et al. Extracellular vesicles from human adipose-derived stem cells for the improvement of angiogenesis and fat-grafting application[J]. Plastic and Reconstructive Surgery, 2019, 144(4): 869-880. DOI:10.1097/PRS.0000000000006046 |
| [7] |
AN Y, LIN S Y, TAN X J, et al. Exosomes from adipose-derived stem cells and application to skin wound healing[J]. Cell Proliferation, 2021, 54(3): e12993. DOI:10.1111/cpr.12993 |
| [8] |
MAZZONI E, D’AGOSTINO A, IAQUINTA M R, et al. Hydroxylapatite-collagen hybrid scaffold induces human adipose-derived mesenchymal stem cells to osteogenic differentiation in vitro and bone regrowth in patients[J]. Stem Cells Translational Medicine, 2020, 9(3): 377-388. DOI:10.1002/sctm.19-0170 |
| [9] |
KUNISCH E, GUNNELLA F, WAGNER S, et al. The poly (l-lactid-co-glycolide; PLGA) fiber component of brushite-forming calcium phosphate cement induces the osteogenic differentiation of human adipose tissue-derived stem cells[J]. Biomedical Materials (Bristol, England), 2019, 14(5): 055012. DOI:10.1088/1748-605X/ab3544 |
| [10] |
LEE W S, KIM H J, KIM K I, et al. Intra-articular injection of autologous adipose tissue-derived mesenchymal stem cells for the treatment of knee osteoarthritis: a phase Ⅱb, rando-mized, placebo-controlled clinical trial[J]. Stem Cells Trans-lational Medicine, 2019, 8(6): 504-511. DOI:10.1002/sctm.18-0122 |
| [11] |
JOO H S, SUH J H, LEE H J, et al. Current knowledge and future perspectives on mesenchymal stem cell-derived exosomes as a new therapeutic agent[J]. International Journal of Molecular Sciences, 2020, 21(3): E727. DOI:10.3390/ijms21030727 |
| [12] |
BI Y, LIN X B, LIANG H Z, et al. Human adipose tissue-derived mesenchymal stem cells in Parkinson’s disease: inhibition of T helper 17 cell differentiation and regulation of immune balance towards a regulatory T cell phenotype[J]. Clinical Interventions in Aging, 2020, 15: 1383-1391. DOI:10.2147/CIA.S259762 |
 2021, Vol. 57
2021, Vol. 57

