2. 青岛元美整形医院
肌成纤维细胞的异质性是决定病理性瘢痕发生和转归的重要机制[1]。诱导肌成纤维细胞再分化为其他类型的细胞可能是治疗病理性瘢痕的有效方法之一。机械张力是导致病理性瘢痕形成的重要因素[2]。创面愈合初期,高张力下的创面刺激成纤维细胞大量增殖聚集,成纤维细胞高表达α-平滑肌肌动蛋白(α-SMA),分化为肌成纤维细胞来维持细胞内外的力学平衡[3]。而创面愈合后期,伴随着创周张力的降低,肌成纤维细胞逐渐再分化、凋亡最终形成成熟瘢痕,或在持续高张力作用下持续异常增殖而形成病理性瘢痕[4]。机械张力参与了肌成纤维细胞形成与再分化的全部过程。在前期研究中,我们应用力学技术成功诱导皮肤成纤维细胞转化为肌成纤维细胞,构建肌成纤维细胞力学模型,阐明了机械张力在瘢痕形成过程中的作用及其机制[4-7]。本文研究探讨肌成纤维细胞在微张力作用下的转归情况,为研究病理性瘢痕的转归提供理论依据。现将结果报告如下。
1 材料和方法 1.1 主要实验仪器及试剂多通道细胞应力加载仪(BF-3001C;Flex-cell公司,美国);6孔弹性基底膜培养板(BF-3001C;Flex-cell公司,美国);CO2培养箱(Panasonic公司,日本);倒置光学显微镜(Olympus公司,日本);酶联免疫检测仪(BioTek公司,美国);ABI ViiATM 7 SYBR Green qPCR仪(ABI公司,美国);化学发光成像系统(ALPHA FCE公司,美国)。Eagle培养基(CORNING公司,美国)、FBS、含EDTA的胰酶(Gibco公司,美国);Cell Counting Kit-8(CCK-8)试剂盒(同仁化学,日本);ELISA试剂盒(R & D Systems公司,美国);TRIzol试剂(Ambion公司,美国);反转录试剂盒、荧光定量PCR试剂盒(大连宝生物工程有限公司);PCR引物及其序列由上海生工生物工程技术服务有限公司设计合成;整合素β1、α-SMA兔抗人单克隆抗体(Abcam公司,英国),山羊抗兔二抗(Abgent公司,苏州),PVDF膜、ECL发光液(Millipore公司,美国)。
1.2 细胞培养与分组人体背部正常皮肤标本3例均取自青岛大学附属医院美容整形外科行色素痣切除术的病人,均为女性,年龄分别为26、36、41岁。本文研究通过青岛大学附属医院伦理委员会批准,所有病人均签署知情同意书。应用组织块法体外培养成纤维细胞,取第3~5代细胞进行实验。调整细胞悬液密度至1×107/L,均匀地接种于6孔弹性基底膜培养板,每孔2 mL。于37 ℃、含体积分数0.05 CO2及饱和湿度条件下培养24 h,倒置显微镜下观察细胞融合度达30%后,更换培养基。根据前期研究方法构建肌成纤维细胞模型[4],设置加载机械张力参数为:拉伸幅度10%,加力频率0.1 Hz,加力波形为正弦波,加载机械张力7 d。实验分为阴性对照组、阳性对照组、实验组。阴性对照组:正常皮肤成纤维细胞,加载2%幅度牵张力;阳性对照组:肌成纤维细胞,加载10%幅度牵张力;实验组:肌成纤维细胞,加载2%幅度牵张力。各组加载牵张力时间为7 d,37 ℃、含体积分数0.05 CO2饱和湿度条件下培养,每隔2 d每孔补充含体积分数0.10血清培养液0.5 mL。每组实验重复3次。
1.3 检测指标及方法 1.3.1 CCK-8法检测细胞增殖能力加力结束后,各组取3孔细胞,每孔加入CCK-8试剂200 μL,轻摇培养板将试剂混匀后继续在培养箱中培养3 h。分别取200 μL细胞培养上清液,置于96孔板中,以不含细胞的培养基作为空白孔,用酶联免疫检测仪检测450 nm波长处吸光度值,以其表示细胞数量。
1.3.2 SYBR Green qPCR法检测细胞内整合素β1、转化生长因子-β1(TGF-β1)、α-SMA和Ⅰ型胶原的mRNA表达加力结束后,各组取3孔细胞,应用Trizol法提取细胞总RNA,进行逆转录反应后,行SYBR Green qPCR检测。PCR反应体系20 μL,内含有:SYBR Premix Ex Taq Ⅱ10 μL,上下游引物各0.8 μL,ROX Reference Dye Ⅱ 0.4 μL,灭菌蒸馏水6 μL,cDNA溶液2 μL。应用ABI ViiATM 7 SYBR Green qPCR仪进行扩增反应,以95 ℃、30 s,95 ℃、5 s,60 ℃、30 s重复45个循环。扩增完成后,应用ABI ViiATM 7软件对反应产物的熔解曲线进行自动定量分析。以GAPDH作为内参,各引物序列见表 1。采用相对定量法2-ΔΔCt计算各目的基因的mRNA含量。ΔΔCt=(Ct目的-Ct内参)-(Ct对照-Ct内参)。
| 表 1 PCR引物及其序列 |
|
|
收集各组培养板孔内细胞上清液,按照TGF-β1、Ⅰ型胶原ELISA试剂盒说明书进行操作。
1.3.4 Western-Blot法检测细胞内整合素β1、α-SMA蛋白表达量加力结束后,各组取3孔细胞,将蛋白裂解液和蛋白酶抑制剂按100∶1的比例制成混合溶液,裂解细胞30 min后,提取总蛋白,用BCA法测定蛋白浓度,测定后加入1/4样品体积量的上样缓冲液,95 ℃金属浴5 min后室温备用。调整电泳参数为:浓缩胶80 V、30 min,分离胶120 V、60 min。取出凝胶后湿转法转膜,转膜参数280 mA 140 min。整合素β1、α-SMA一抗稀释浓度为1∶5 000,内参β-actin稀释浓度为1∶1 500;二抗稀释浓度为1∶10 000。加入一抗4 ℃孵育过夜,加入二抗室温下孵育1 h后,涂ECL发光液于化学发光成像系统中显影。应用Image J图像分析系统测定各种蛋白条带的灰度值,以灰度值和条带面积的乘积(IntDen)进行蛋白半定量的分析。蛋白的相对表达量=实验组(IntDen目的-IntDen内参)/对照组(IntDen目的-IntDen内参)。
1.4 统计学分析采用SPSS R23.0.0.0软件进行统计学处理,计量资料结果以x±s表示,多组间比较采用单因素方差分析,两两比较采用q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组细胞增殖能力比较各组细胞增殖能力相比较,阳性对照组>实验组>阴性对照组,差异具有统计学意义(F=67.75, P < 0.05),见表 2。
| 表 2 各组细胞增殖能力和其他指标检测结果比较(n=6, x±s) |
|
|
阳性对照组整合素β1 mRNA和蛋白表达高于实验组(F=807.45、90.23, q=47.86、2.53, P < 0.05),实验组和阴性对照组之间比较差异无统计学意义(P>0.05)。见表 2。
2.3 各组TGF-β1、α-SMA、Ⅰ型胶原mRNA表达和蛋白表达的比较各组TGF-β1、Ⅰ型胶原mRNA和蛋白含量比较,阳性对照组>实验组>阴性对照组,差异有统计学意义(F=132.63~981.60, P < 0.05)。实验组α-SMA mRNA和蛋白表达高于阴性对照组,差异有显著性(F=496.01、132.64, q=37.43、16.95, P < 0.05),实验组和阳性对照组α-SMA蛋白表达差异无统计学意义(P>0.05)。见表 2,图 1。
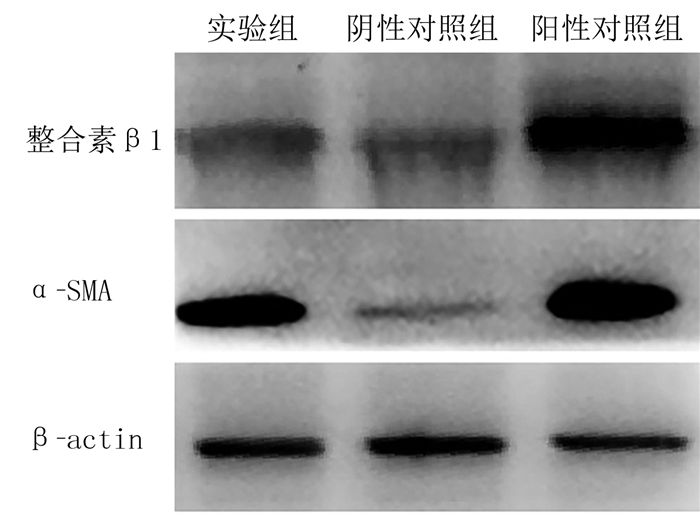 |
| 图 1 各组细胞整合素β1、α-SMA蛋白表达Westen-Blot结果 |
肌成纤维细胞的异质性是决定增生性瘢痕发生和转归的重要机制[1]。最近研究发现,肌成纤维细胞能够被诱导分化为脂肪细胞[8]。诱导肌成纤维细胞再分化为其他类型细胞,可能是治疗病理性瘢痕的有效手段之一。
机械张力是影响创面愈合和瘢痕形成的重要因素[9]。创面愈合早期,皮肤完整性遭到破坏,创面承受机械张力骤增,刺激炎症细胞浸润、成纤维细胞大量增殖聚集[10];组织再生期,皮肤成纤维细胞在张力作用下表达α-SMA,分泌大量细胞外基质成分,分化为肌成纤维细胞,肌成纤维细胞籍α-SMA维持细胞内外之间的力学平衡状态[3, 11];创面愈合后期,肌成纤维细胞的转归决定了创面愈合的最终结果。研究表明,如果创面修复后不再承受较大的机械张力刺激,肌成纤维细胞逐渐再分化、凋亡,创面最终形成成熟的瘢痕[12];如果创面持续承受较大的机械张力刺激,肌成纤维细胞持续增殖,创面就会形成病理性瘢痕[3, 13]。
创面愈合的不同结局提示机械张力参与了肌成纤维细胞形成与再分化的全部过程[14-15]。细胞对机械张力的反应有一定选择性,在比较适合的张力作用下才会产生明显的力学-生化信号传导。有研究表明,在牵张力幅度低于2%时,真皮成纤维细胞不会发生形态学变化[16],本文阴性对照组结果与其一致。因此,我们推测低幅度牵张力可能会诱导肌成纤维细胞再分化。
足够大的张力微环境和TGF-β1是诱导肌成纤维细胞形成的两个必要条件[17-18]。整合素-细胞骨架信号通路是机械张力传导的主要途径[17-20]。整合素胞外区域与其特异的细胞外基质配体结合后,就会导致细胞骨架蛋白聚集,形成黏着复合体,黏着复合体可以成熟为更大的黏着斑(FA)。只有形成足够大的FA,成纤维细胞才开始表达α-SMA[21]。整合素、FA、α-SMA都是张力的传导者,负责把力学信号传导至胞内影响基因表达[22]。同时,足够大的机械张力才能通过整合素激活细胞外基质中潜伏状态的TGF-β1,活化的TGF-β1通过SMAD信号通路调节细胞基因表达[23-24]。
肌成纤维细胞内α-SMA、TGF-β1表达水平较高,而皮肤成纤维细胞表达少量的TGF-β,且几乎不表达α-SMA[25]。机械张力使成纤维细胞大量分泌TGF-β1,TGF-β1可协同机械张力的作用促使细胞表达α-SMA、Ⅰ/Ⅲ型胶原,促使成纤维细胞转化为肌成纤维细胞[26-27]。与正常皮肤成纤维细胞相比,肌成纤维细胞合成细胞外基质能力较高,突出表现为α-SMA、TGF-β1、Ⅰ型胶原等重要分子标志物的表达水平提高[28-29]。
基于前期研究结果,本文构建肌成纤维细胞模型作为本次研究的目的细胞,选择10%和2%幅度的牵张力作为高、低幅度牵张力作用于肌成纤维细胞,以正常成纤维细胞持续加载2%幅度的牵张力为阴性对照组。本文研究结果显示,10%幅度的牵张力明显刺激肌成纤维细胞增殖,2%幅度的牵张力作用下肌成纤维细胞的增殖能力高于正常成纤维细胞,再次证明张力对成纤维细胞具有促增殖的作用。同时,在2%幅度牵张力作用下,肌成纤维细胞和成纤维细胞内整合素β1基因和蛋白表达水平明显低于10%幅度牵张力作用下的水平,说明细胞对较低幅度牵张力的传导效应较弱,与我们前期的研究结果一致。理论上讲,低幅度牵张力作用下,细胞内相关基因表达会降低,生化反应随之减弱。本文的研究结果显示,2%幅度牵张力作用7 d后,肌成纤维细胞TGF-β1、Ⅰ型胶原的基因和蛋白表达水平低于10%幅度牵张力作用,仍然高于正常成纤维细胞表达水平;肌成纤维细胞内α-SMA表达水平仍然较高。这一结果说明,低张力微环境下肌成纤维细胞没有发生明显变化,这与临床上病理性瘢痕的转归现象不符。因为体外培养不能完全模拟体内细胞所处的复杂环境,推测低幅度牵张力不能直接诱导肌成纤维细胞的再分化,可能存在其他机制介导了张力诱导肌成纤维细胞再分化的过程。
综上所述,在2%幅度牵张力作用下,肌成纤维细胞仍然高表达α-SMA、TGF-β1和Ⅰ型胶原,肌成纤维细胞的表型没有发生本质变化。低幅度牵张力作用不能直接诱导肌成纤维细胞再分化,与机体复杂内环境有关,也可能存在其他机制参与了张力诱导肌成纤维细胞再分化的过程,仍需要深入研究。
| [1] |
RINKEVICH Y, WALMSLEY G G, HU M S, et al. Skin fibrosis. Identification and isolation of a dermal lineage with intrinsic fibrogenic potential[J]. Science (New York, N.Y.), 2015, 348(6232): aaa2151. DOI:10.1126/science.aaa2151 |
| [2] |
FINNERTY C C, JESCHKE M G, BRANSKI L K, et al. Hypertrophic scarring: the greatest unmet challenge after burn injury[J]. Lancet (London, England), 2016, 388(10052): 1427-1436. DOI:10.1016/S0140-6736(16)31406-4 |
| [3] |
XU Q C, KUANG R X, WEI S Q, et al. Analysis of mechanical behavior of dermal fibroblasts obtained from various anatomical sites in humans[J]. Annals of Plastic Surgery, 2017, 79(5): 438-443. DOI:10.1097/SAP.0000000000001121 |
| [4] |
朱明宇, 李雨珊, 王志国, 等. 机械牵张力加载时间对诱导正常皮肤成纤维细胞向增生性瘢痕成纤维细胞转化过程的影响研究[J]. 中国美容医学, 2018, 27(6): 55-59. |
| [5] |
朱明宇, 匡瑞霞, 王志国, 等. 机械应力导致病理性瘢痕形成的机制[J]. 中华医学杂志, 2017, 26: 2072-2074. DOI:10.3760/cma.j.issn.0376-2491.2017.26.016 |
| [6] |
王志国, 匡瑞霞, 陈振雨, 等. 不同幅度牵张力对正常皮肤成纤维细胞向病理性瘢痕成纤维细胞转化的诱导作用[J]. 中华医学杂志, 2015, 95(4): 294-298. DOI:10.3760/cma.j.issn.0376-2491.2015.04.013 |
| [7] |
王志国, 匡瑞霞, 徐全臣, 等. 人体不同部位正常皮肤成纤维细胞对机械张力反应的研究[J]. 中国修复重建外科杂志, 2015, 29(4): 467-471. |
| [8] |
PLIKUS M V, GUERRERO-JUAREZ C F, ITO M, et al. Regeneration of fat cells from myofibroblasts during wound healing[J]. Science (New York, N.Y.), 2017, 355(6326): 748-752. DOI:10.1126/science.aai8792 |
| [9] |
BARNES L A, MARSHALL C D, LEAVITT T, et al. Mechanical forces in cutaneous wound healing: emerging therapies to minimize scar formation[J]. Advances in Wound Care, 2018, 7(2): 47-56. DOI:10.1089/wound.2016.0709 |
| [10] |
MARTINO F, PERESTRELO A R, VINARSKY V, et al. Cellular mechanotransduction: from tension to function[J]. Frontiers in Physiology, 2018, 9: 824. |
| [11] |
HINZ B, MASTRANGELO D, ISELIN C E, et al. Mechanical tension controls granulation tissue contractile activity and myofibroblast differentiation[J]. The American Journal of Pathology, 2001, 159(3): 1009-1020. DOI:10.1016/S0002-9440(10)61776-2 |
| [12] |
YAGMUR C, AKAISHI S, OGAWA R, et al. Mechanical receptor-related mechanisms in scar management: a review and hypothesis[J]. Plastic and Reconstructive Surgery, 2010, 126(2): 426-434. DOI:10.1097/PRS.0b013e3181df715d |
| [13] |
HINZ B, PHAN S H, THANNICKAL V J, et al. Recent developments in myofibroblast biology: paradigms for connective tissue remodeling[J]. The American Journal of Pathology, 2012, 180(4): 1340-1355. DOI:10.1016/j.ajpath.2012.02.004 |
| [14] |
LEAVITT T, HU M S, MARSHALL C D, et al. Scarless wound healing: finding the right cells and signals[J]. Cell and Tissue Research, 2016, 365(3): 483-493. DOI:10.1007/s00441-016-2424-8 |
| [15] |
JUNGBAUER S, GAO H J, SPATZ J P, et al. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates[J]. Biophysical Journal, 2008, 95(7): 3470-3478. DOI:10.1529/biophysj.107.128611 |
| [16] |
KLINGBERG F, CHOW M L, KOEHLER A, et al. Prestress in the extracellular matrix sensitizes latent TGF-β1 for activation[J]. Journal of Cell Biology, 2014, 207(2): 283-297. DOI:10.1083/jcb.201402006 |
| [17] |
MICALLEF L, VEDRENNE N, BILLET F, et al. The myofibroblast, multiple origins for major roles in normal and pathological tissue repair[J]. Fibrogenesis & Tissue Repair, 2012, 5(Suppl 1): S5. DOI:10.1186/1755-1536-5-S1-S5 |
| [18] |
HOFFMAN B D, GRASHOFF C, SCHWARTZ M A. Dynamic molecular processes mediate cellular mechanotransduction[J]. Nature, 2011, 475(7356): 316-323. DOI:10.1038/nature10316 |
| [19] |
GOLDMANN W H. Mechanotransduction and focal adhesions[J]. Cell Biology International, 2012, 36(7): 649-652. DOI:10.1042/CBI20120184 |
| [20] |
PLOTNIKOV S V, PASAPERA A M, SABASS B, et al. Force fluctuations within focal adhesions mediate ECM-rigidity sensing to guide directed cell migration[J]. Cell, 2012, 151(7): 1513-1527. DOI:10.1016/j.cell.2012.11.034 |
| [21] |
GOFFIN J M, PITTET P, CSUCS G, et al. Focal adhesion size controls tension-dependent recruitment of alpha-smooth muscle actin to stress fibers[J]. The Journal of Cell Biology, 2006, 172(2): 259-268. DOI:10.1083/jcb.200506179 |
| [22] |
KUMAR A, SHUTOVA M S, TANAKA K, et al. Filamin A mediates isotropic distribution of applied force across the actin network[J]. The Journal of Cell Biology, 2019, 218(8): 2481-2491. DOI:10.1083/jcb.201901086 |
| [23] |
HAPPE C L, ENGLER A J. Mechanical forces reshape dif- ferentiation cues that guide cardiomyogenesis[J]. Circulation Research, 2016, 118(2): 296-310. DOI:10.1161/CIRCRESAHA.115.305139 |
| [24] |
WIPFF P J, RIFKIN D B, MEISTER J J, et al. Myofibroblast contraction activates latent TGF-beta1 from the extracellular matrix[J]. The Journal of Cell Biology, 2007, 179(6): 1311-1323. |
| [25] |
HINZ B A, MCCULLOCH C M, COELHO N. Mechanical regulation of myofibroblast phenoconversion and collagen contraction[J]. Experiental Cell Research, 2019, 379(1): 119-128. |
| [26] |
HUANG C Y, OGAWA R. The link between hypertension and pathological scarring: does hypertension cause or promote keloid and hypertrophic scar pathogenesis?[J]. Wound Repair and Regeneration, 2014, 22(4): 462-466. |
| [27] |
LIU S Y, JIANG L, LI H J, et al. Mesenchymal stem cells prevent hypertrophic scar formation via inflammatory regulation when undergoing apoptosis[J]. The Journal of Investigative Dermatology, 2014, 134(10): 2648-2657. |
| [28] |
LODYGA M, HINZ B. TGF-β1-A truly transforming growth factor in fibrosis and immunity[J]. Seminars in Cell Developmental Biology, 2020, 101: 123-139. |
| [29] |
SHU D Y, LOVICU F J. Myofibroblast transdifferentiation: the dark force in ocular wound healing and fibrosis[J]. Progress in Retinal and Eye Research, 2017, 60: 44-65. |
 2021, Vol. 57
2021, Vol. 57

