2. 济宁医学院附属金乡医院消化内科;
3. 青岛大学附属青岛市市立医院中心实验室
肠上皮化生(IM)是指病理学上正常胃黏膜上皮细胞被含有杯状细胞、Paneth细胞和吸收细胞的肠表型所取代[1]。IM的分度根据肠化腺体占胃黏膜腺体和表面上皮总面积比值分为轻度、中度和重度[2]。IM被认为是肠型胃癌的癌前病变,通常与幽门螺杆菌(Hp)感染等因素有关。已有研究认为,胃癌的发生是一个多步骤的级联过程,包括胃黏膜从非萎缩性胃炎到慢性萎缩性胃炎(CAG)、IM、异型增生(Dys),最终发展为胃癌[3]。这一过程被认为是由Hp感染发起和促进的。基于此原因,1994年Hp被世界卫生组织国际癌症研究机构列为Ⅰ类致癌物[4]。相关研究指出,IM和Dys发展为胃癌的危险性显著高于CAG[5]。本研究旨在分析Hp感染与IM发生的相关性,明确Hp感染对IM发生风险的影响,为IM的预防和治疗提供理论依据。现将结果报告如下。
1 资料与方法 1.1 一般资料收集2006年12月—2019年11月青岛市市立医院132 368例胃镜检查病人病理报告结果,活检病理标本均钳取自病人胃窦黏膜。IM病理诊断标准以1996年修订的新悉尼系统为依据[6]。病人男66 197例,女66 171例;年龄18~98岁,平均(53±13)岁。由医院病理科病理管理系统获得病人临床及病理资料。
1.2 统计学处理采用SPSS18.0软件进行统计分析。计数资料比较采用χ2检验和趋势检验,关联程度用优势比(OR)和95%可信区间(CI)表示。采用多因素Logistic回归分析IM的危险因素。
2 结果 2.1 IM危险因素的多因素Logistic回归分析IM病人39 805例,检出率为30.1%。将年龄、性别、Hp感染分别作为自变量,IM作为因变量,进行Logistic回归,筛选出有统计学意义的变量。随后采用进入法,进行多因素Logistic回归,结果显示IM与年龄、性别、Hp感染均有关。年龄每增长1岁,IM风险约增加3.8% (OR=1.038,95%CI=1.037~1.039,P < 0.01);男性病人发生IM的风险是女性的1.264倍(OR=1.264,95%CI=1.234~1.286,P < 0.01);Hp感染病人发生IM的风险是未感染者的1.487倍(OR=1.487,95%CI=1.449~1.527,P < 0.01)。见表 1。
| 表 1 IM的多因素Logistic回归分析 |
|
|
随年龄增长,IM检出率逐渐升高,差异有统计学意义(χ2=4 484.890,P < 0.01)。60岁以后进入平台期,60~69岁年龄组与≥70岁年龄组IM发生率分别为38.1%和37.9%,两组差异无统计学意义(χ2=0.098,P>0.05)。见图 1。
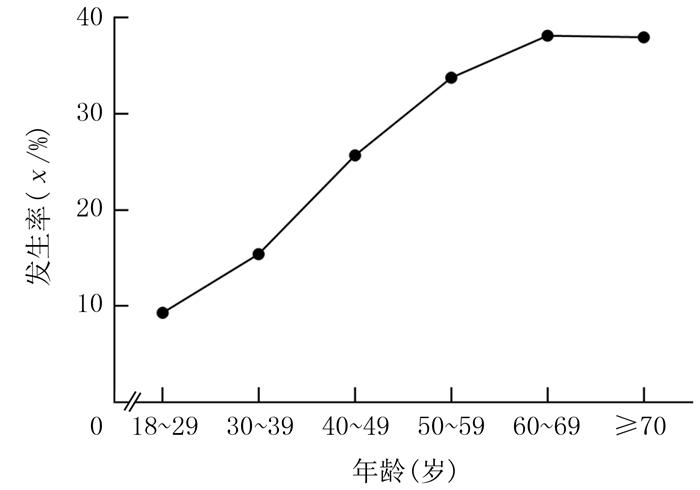 |
| 图 1 不同年龄段IM发生率比较 |
男性的IM发生率为31.8%(21 079/66 197),高于女性的28.3%(18 726/66 171),差异有统计学意义(χ2=197.588,P < 0.01)。男性的IM发生率为女性的1.184倍(OR=1.184,95%CI=1.156~1.212,P < 0.01)。
2.4 Hp感染与IM的相关性共有125 746例病人行Hp检测,总体Hp感染率为31.3%(39 376/125 746)。IM病人Hp感染率为35.2%(13 906/39 529),明显高于无IM胃炎病人的29.5%(25 470/86 217),差异有统计学意义(χ2=400.480,P < 0.01),IM胃炎病人的Hp感染率为无IM者的1.294倍(OR=1.294,95%CI=1.262~1.328,P < 0.01)。
2.5 IM程度与Hp感染率的关系轻度、中度和重度IM病人的Hp感染率分别为37.1%(9 654/26 036)、33.6%(3 715/11 046)和21.9%(537/2 447),各组之间比较差异有统计学意义(χ2=240.759,P < 0.01),随着IM程度的加重,Hp感染率呈下降趋势(χ2=203.962,P < 0.001)。
3 讨论IM是胃黏膜良性病变向胃癌演变的中间过程,IM是胃癌的癌前病变,而IM病人发生胃癌的风险较无IM的病人增加[7]。因此,找到IM的危险因素极为重要。IM的发生率各地报道不一致,其与Hp的关系尚有争议。本文研究结果显示,青岛地区IM发生率为30.1%,Hp感染率为31.3%。青岛地区IM发生率、Hp感染率与其他研究数据有所差异。文献报道,我国不同地区Hp感染率为41.35%~ 72.30%[8]。分析原因,可能有以下几点:①Hp感染与饮食习惯、生活方式及经济条件密切相关,青岛地区经济条件、卫生条件均较好,Hp感染率较低;②本研究中的部分病人已经做了根除Hp治疗,导致病理活检Hp转阴;③病理组织学检查的Hp感染情况受到活检组织取材部位的影响,假阴性的存在导致阳性率偏低。
本文研究结果显示,Hp感染、年龄、男性为IM的危险因素。JIANG等[9]对中国东南地区28 745例接受上消化道内镜检查和内镜活检病人IM危险因素分析显示,年龄、性别、胃溃疡、胆汁反流、Hp感染、慢性和急性炎症严重程度均为IM的危险因素。CAMORLINGA-PONCE等[10]报道,导致胃黏膜发生IM的因素包括Hp感染、高盐摄入、吸烟、饮酒和慢性胆汁反流。在胃癌高发的韩国,老年、吸烟和Hp感染与高风险OLGIM(可操作的与胃癌风险联系的肠化生评估)阶段相关,高风险的OLGIM在40岁以前并不常见(2.8%),但在60岁时则增加到30.1%[11]。本文结果与其一致。
本文研究还显示,随着年龄的增长,IM的检出率逐渐升高,到了60岁进入平台期。有研究显示,持续性Hp感染、年龄>45岁是与IM进展相关的独立危险因素[12]。OHKUMA等[13]研究显示,无论是否存在Hp感染,IM的患病率随年龄增长而显著增加。这些结果均提示IM是由衰老和Hp感染共同引起的。PAN等[14]进行的流行病学调查也显示,年龄与IM及Dys患病率呈线性关系,提示IM及Dys随着年龄的增长而累积和发展。有研究显示,男性和有胃癌一级家族史病人患IM的风险增加;未感染Hp的女性病人患IM的风险降低[13, 15]。这与男性饮食习惯、吸烟、饮酒、Hp感染率高有直接关系。本文研究结果与其一致。
FONTHAM等[16]研究显示,Hp感染者发生IM的危险是非Hp感染者的4.7倍。Hp感染导致IM的机制主要有以下几方面。①Hp毒力因子:Hp具有多种毒力因子,包括菌毛、鞭毛、尿素酶、黏液酶、脂酶、磷脂酶A、溶血素、脂多糖、细胞毒素相关蛋白A(CagA)及空泡细胞素A(VacA)等,其中CagA和VacA是主要的毒力因子,可能是IM发生的始动因素。许多流行病学调查和动物模型研究显示,CagA及VacA能干扰胃黏膜上皮细胞中生长因子的调节机制,抑制细胞的修复,影响上皮的愈合,导致出现胃黏膜萎缩、IM和异型增生,最终导致胃癌发生[17]。②基因突变:LEUNG等[18]研究结果显示,与低风险基因型个体相比较,宿主炎性细胞因子(IL-1B-511t)和Hp基因型VacA-m1的存在进一步增加了IM的风险。而NAKAJIMA等[19]研究结果显示,Hp感染IM病人的胰岛素样生长因子-1受体(IGF-1R)表达明显高于慢性胃炎,IGF-1R的持续过表达是使胃黏膜向肠化生转变的诱导因素。SATOH等[20]研究显示,Hp是诱导尾型同源盒基因家族(CDX2)异位表达的重要诱因,慢性胃炎病人胃黏膜中的CDX2表达与IM密切相关。还有研究发现,Hp可以直接激活胃癌细胞中的细胞外信号调节激酶(Erk)通路,使Elk-1和血清反应因子(SRF)活化,分别诱导Elk-1和SRF与肠上皮细胞特异性标记物villin的近端启动子激活和协同结合,从而促进肠上皮的发生[21]。③对细胞周期的作用:POLAT等[22]的研究显示,Hp感染者ki-67、p53、p21(Waf1/Cipl)和细胞周期蛋白(Cyclin)D1等细胞周期调节因子过表达,这些因子表达在胃黏膜萎缩和IM病人中升高更为明显。④细胞因子:Hp感染后刺激机体产生白细胞介素(IL)-8、IL-6、IL-1β、肿瘤坏死因子(TNF)-α等细胞因子,参与了IM及胃癌的发生[23]。⑤端粒酶活化:相关研究显示,Hp感染能使大量活性氧和活性氮释放,促使胃黏膜上皮细胞端粒酶异常活化,从而在IM过程中启动“干细胞”的增殖[24]。⑥环氧合酶(COX)-2/前列腺素E2(PGE2):ZHANG等[25]对我国胃癌高发区山东临朐具有癌前病变病理组织学诊断病人的研究显示,Hp诱导的COX-2/PGE2通路在胃癌癌前病变的进展中起重要作用。
本文研究还显示,随着IM程度的加重,Hp检出率逐渐下降。OSAWA等[26]的研究显示,IM程度与抗Hp滴度呈负相关,抗Hp滴度在无IM组为75%,中度IM组为43%,广泛IM组为37%。虽然人们认为Hp感染是IM发生的重要危险因素,但Hp并不经常在IM病人的胃黏膜中检测到,IM区环境改变,包括与正常胃黏膜相比分泌型IgA增加和酸度降低,可能是Hp在IM黏膜中减少的原因;胃液中的IgA可能在抑制细菌与上皮表面的黏附方面起重要作用,胃内的胃酸降低可抑制Hp的增殖,随着胃黏膜化生程度的加重,细菌数量可能会减少。还有研究显示,Ⅲ型IM更多地出现在中或重度IM中,而不是轻度IM中,而Ⅲ型IM病人胃环境不适合Hp生存。但这并不代表Ⅲ型IM病人没有感染过Hp。
综上所述,青岛市IM的危险因素包括Hp感染、年龄、性别,随着年龄的增长,IM发生率升高,60岁以后会进入一个平台期;男性发生IM的风险高于女性;Hp感染的病人发生IM的风险增高,但随着IM程度的加重,Hp感染率呈下降趋势,这可能与中、重度IM的胃内微环境不适合Hp生存有关。
| [1] |
FILIPE M I, MUÑOZ N, MATKO I, et al. Intestinal Metaplasia types and the risk of gastric cancer: a cohort study in Slovenia[J]. International Journal of Cancer, 1994, 57(3): 324-329. DOI:10.1002/ijc.2910570306 |
| [2] |
CAPELLE L G, DE VRIES A C, HARINGSMA J, et al. The staging of gastritis with the OLGA system by using intestinal Metaplasia as an accurate alternative for atrophic gastritis[J]. Gastrointestinal Endoscopy, 2010, 71(7): 1150-1158. DOI:10.1016/j.gie.2009.12.029 |
| [3] |
CORREA P. A human model of gastric carcinogenesis[J]. Cancer Research, 1988, 48(13): 3554-3560. |
| [4] |
International Agency for Research on Cancer (1994). Infection with Helicobacter pylori[J]. IARC Monogr Eval Carcinog Risks Hum, 1994, 61(1): 177-240. |
| [5] |
马峻岭, 刘伟东, 张在臻, 等. 胃癌与癌前病变关系的研究[J]. 华人消化杂志, 1998, 6(3): 42-43. |
| [6] |
DIXON M F, GENTA R M, YARDLEY J H, et al. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston 1994[J]. The American Journal of Surgical Pathology, 1996, 20(10): 1161-1181. DOI:10.1097/00000478-199610000-00001 |
| [7] |
DE VRIES A C, VAN GRIEKEN N C, LOOMAN C W, et al. Gastric cancer risk in patients with premalignant gastric lesions: a nationwide cohort study in the Netherlands[J]. Gastroenterology, 2008, 134(4): 945-952. DOI:10.1053/j.gastro.2008.01.071 |
| [8] |
尹庆娜, 王伟. 某地区体检人群幽门螺旋杆菌感染现状的分析[J]. 中国医药指南, 2018, 16(12): 106-107. |
| [9] |
JIANG J X, LIU Q, ZHAO B, et al. Risk factors for intestinal Metaplasia in a southeastern Chinese population: an analysis of 28, 745 cases[J]. Journal of Cancer Research and Clinical Oncology, 2017, 143(3): 409-418. DOI:10.1007/s00432-016-2299-9 |
| [10] |
CAMORLINGA-PONCE M, FLORES-LUNA L, LAZCANO-PONCE E, et al. Age and severity of mucosal lesions influence the performance of serologic markers in Helicobacter pylori-associated gastroduodenal pathologies[J]. Cancer Epidemiology Biomarkers & Prevention, 2008, 17(9): 2498-2504. |
| [11] |
ISAJEVS S, LIEPNIECE-KARELE I, JANCIAUSKAS D, et al. Gastritis staging:interobserver agreement by applying OLGA and OLGIM systems[J]. Virchows Archiv: an International Journal of Pathology, 2014, 464(4): 403-407. DOI:10.1007/s00428-014-1544-3 |
| [12] |
LEUNG W K, LIN S R, CHING J Y, et al. Factors predicting progression of gastric intestinal metaplasia:results of a randomised trial on Helicobacter pylori eradication[J]. Gut, 2004, 53(9): 1244-1249. DOI:10.1136/gut.2003.034629 |
| [13] |
OHKUMA K, OKADA M, MURAYAMA H, et al. Association of Helicobacter pylori infection with atrophic gastritis and intestinal Metaplasia[J]. Journal of Gastroenterology and Hepatology, 2000, 15(10): 1105-1112. DOI:10.1046/j.1440-1746.2000.02305.x |
| [14] |
PAN K F, ZHANG L, GERHARD M, et al. A large randomised controlled intervention trial to prevent gastric cancer by eradication of Helicobacter pylori in Linqu County, China: baseline results and factors affecting the eradication[J]. Gut, 2016, 65(1): 9-18. DOI:10.1136/gutjnl-2015-309197 |
| [15] |
LEUNG W K, NG E K W, CHAN W Y, et al. Risk factors associated with the development of intestinal Metaplasia in first-degree relatives of gastric cancer patients[J]. Cancer Epidemiology, Biomarkers & Prevention, 2005, 14(12): 2982-2986. |
| [16] |
FONTHAM E T, RUIZ B, PEREZ A, et al. Determinants of Helicobacter pylori infection and chronic gastritis[J]. The American Journal of Gastroenterology, 1995, 90(7): 1094-1101. |
| [17] |
崔轶霞, 王海军, 惠起源. 幽门螺杆菌致胃癌发生的机制研究进展[J]. 现代肿瘤医学, 2006, 14(5): 625-627. |
| [18] |
LEUNG W K, CHAN M C, TO K F, et al. H.pylori genotypes and cytokine gene polymorphisms influence the development of gastric intestinal Metaplasia in a Chinese population[J]. The American Journal of Gastroenterology, 2006, 101(4): 714-720. DOI:10.1111/j.1572-0241.2006.00560.x |
| [19] |
NAKAJIMA N, KOZU K, KOBAYASHI S, et al. The expression of IGF-1R in Helicobacter pylori-infected intestinal Metaplasia and gastric cancer[J]. Journal of Clinical Biochemistry and Nutrition, 2016, 59(1): 53-57. DOI:10.3164/jcbn.16-11 |
| [20] |
SATOH K, MUTOH H, EDA A, et al. Aberrant expression of CDX2 in the gastric mucosa with and without intestinal metaplasia: effect of eradication of Helicobacter pylori[J]. Helicobacter, 2002, 7(3): 192-198. DOI:10.1046/j.1523-5378.2002.00080.x |
| [21] |
RIEDER G, TESSIER A J, QIAO X T, et al. Helicobacter-induced intestinal Metaplasia in the stomach correlates with Elk-1 and serum response factor induction of villin[J]. The Journal of Biological Chemistry, 2005, 280(6): 4906-4912. DOI:10.1074/jbc.M413399200 |
| [22] |
POLAT A, CINEL L, DUSMEZ D, et al. Expression of cell-cycle related proteins in Helicobacter pylori gastritis and association with gastric carcinoma[J]. Neoplasma, 2002, 49(2): 95-100. |
| [23] |
周丽雅. Hp与胃癌的基础与临床研究进展[J]. 继续医学教育, 2006, 20(3): 4-6. |
| [24] |
KUNIYASU H, YASUI W, YOKOZAKI H, et al. Helicobacter pylori infection and carcinogenesis of the stomach[J]. Langenbeck's Archives of Surgery, 2000, 385(2): 69-74. DOI:10.1007/s004230050248 |
| [25] |
ZHANG Y, PAN K F, ZHANG L, et al. Helicobacter pylori, cyclooxygenase-2 and evolution of gastric lesions: results from an intervention trial in China[J]. Carcinogenesis, 2015, 36(12): 1572-1579. |
| [26] |
OSAWA H, INOUE F, YOSHIDA Y. Inverse relation of serum Helicobacter pylori antibody titres and extent of intestinal Metaplasia[J]. Journal of Clinical Pathology, 1996, 49(2): 112-115. |
 2020, Vol. 56
2020, Vol. 56

