帕金森病(PD)是一种好发于中老年人的神经退行性疾病[1-2],其主要病理改变是中脑黑质致密部(SNpc)多巴胺(DA)能神经元的选择性丢失,及残存的神经元内形成α-突触核蛋白(α-Syn)聚集为主的路易小体[3-4]。到目前为止,PD的病因尚未完全明确,但是α-Syn异常聚集参与了PD中DA能神经元退行性病变过程[5-6]。缝隙连接(GJ)是将相邻的两个细胞的细胞膜上的连接小体对接形成的直径约为1.5 nm的细胞通道,每个连接小体由6个相同或不同的杆状的连接蛋白(Cx)构成[7-9]。迄今为止,已经发现的在人类中表达的Cx有20余种,其中在中枢神经系统中表达的有13种[10]。大多数的Cx为磷蛋白并且处于不同的磷酸化水平,根据其分子质量的差异而命名为Cx31、Cx32、Cx36、Cx37、Cx40、Cx43、Cx45、Cx46、Cx50和Cx56等[11-12],其中细胞间分布最广泛的是Cx43[13]。Cx43的磷酸化影响广泛,它能够影响GJ的通透性及门控特性等,从而对细胞间连接产生作用,进而在体内外影响生理或者病理过程[14-15]。大量研究表明,Cx43及其磷酸化可能参与了诸多疾病的发生及发展[16-17]。但是Cx43作为细胞间通讯的重要调节蛋白,对PD的作用尚未明确。本文研究选取具有DA能神经元特性的SH-SY5Y细胞,过表达野生型α-Syn以及人突变型A53T α-Syn,通过检测Cx43蛋白及磷酸化Cx43蛋白(p-Cx43)的表达,探讨Cx43及p-Cx43在PD中的作用,从而阐明PD的发病机制,为药物干预治疗提供可能的作用靶点。
1 材料和方法 1.1 实验细胞本实验选用的SH-SY5Y细胞购自中国科学院典型培养物保藏委员会细胞库,其来自于人神经母细胞瘤细胞,具有DA能神经元特性。将其置于温度37 ℃、含体积分数0.05 CO2的培养箱中,使用含RPMI-1640(1:1)、体积分数0.2胎牛血清、10 g/L青霉素和链霉素混合液的完全培养液进行培养。
1.2 试剂RPMI-1640(1:1)培养液、胎牛血清和Opti-MEM® Ⅰ培养液均购于Gibco公司,LipotamineTM2000、BCA蛋白试剂盒均购于Thermo公司,兔源β-tubulin、Cx43、p-Cx43抗体均购于CST公司,兔源α-Syn抗体购于Abcam公司,辣根过氧化物酶标记的山羊抗兔IgG二抗购于Absin公司,RIPA (strong)裂解液、分离胶缓冲液、浓缩胶缓冲液和丙烯酰胺均购于康为公司,ECL试剂盒购于美国Millipore公司。
1.3 实验仪器CO2培养箱购于Thermo Electron Corporation公司,倒置荧光显微镜购于Olympus公司,台式低温离心机(5417R)购于Eppendorf公司,电泳槽、电泳仪、电转仪(湿转)均购于BIO-RAD公司。
1.4 过表达α-Syn的细胞模型制备待培养瓶中细胞生长良好,将细胞以1×108/L的密度接种至6孔板中,待板中的细胞融合度达到70%~90%时进行转染。取5 μL LipotamineTM2000溶于150 μL Opti-MEM® Ⅰ无血清培养基中,同时取2 μg含有绿色荧光标签质粒GV230-EGFP(对照组,A组)、GV230-EGFP-WT-α-Syn(WT α-Syn组, B组)、GV230-EGFP-A53T-α-Syn(A53T α-Syn组, C组)溶于150 μL Opti-MEM® Ⅰ无血清培养基中,分别混匀后,室温静置5 min。将质粒和LipotamineTM2000混合均匀,在无菌操作台中静置30 min。置于培养箱中培养4 h后,弃去含LipofectamineTM2000-DNA混合物的Opti-MEM® Ⅰ无血清培养液,换为含血清、抗生素的完全培养基培养24 h。使用倒置荧光显微镜观察质粒转染效率。
1.5 Western Blot检测α-Syn、Cx43及p-Cx43蛋白表达水平待细胞处理完毕后吸除培养基,用预冷的PBS洗细胞3次,完全去除培养基,向每孔加入120 μL细胞裂解液,在冰上进行裂解,静置30 min后将细胞刮下转移至冰上预冷的EP管中,4 ℃、12 000 r/min离心20 min,吸取上清置于新的EP管中,采用BCA法测蛋白浓度。按每孔25 μg蛋白上样,经SDS-PAGE电泳后,电转移到PVDF膜上,室温下使用100 g/L脱脂奶粉封闭2 h,加入相应的一抗(Cx43、p-Cx4及α-Syn稀释滴度均为1:1 000;β-tubulin稀释滴度为1:10 000),4 ℃摇床孵育过夜后,使用TBST洗脱3次,用1:10 000稀释辣根过氧化物酶标记的山羊抗兔二抗于室温孵育1 h,TBST洗脱3次后,ECL发光液显影,UVP凝胶成像系统成像,Image J软件读取目的条带的灰度值,对α-Syn、Cx43及p-Cx43蛋白表达水平进行分析。
1.6 统计学方法应用SPSS 17.0及GraphPad Prism软件进行统计分析,计量资料结果以x±s表示,组间比较采用单因素方差分析(One-Way ANOVA)。以P < 0.05表示差异有统计学意义。
2 结果 2.1 成功构建过表达α-Syn的SH-SY5Y细胞模型将含GV230-EGFP、GV230-EGFP-WT-α-Syn和GV230-EGFP-A53T-α-Syn的质粒分别转染至SH-SY5Y细胞24 h后,Western Blot检测显示,在过表达WT α-Syn和A53T α-Syn的SH-SY5Y细胞中,α-Syn的蛋白表达明显增多(F=108.03,q=17.36、20.07,P < 0.01)。见图 1、表 1。
 |
| 图 1 过表达α-Syn的SH-SY5Y细胞内α-Syn蛋白电泳检查 |
| 表 1 各组α-Syn、Cx43蛋白表达及p-Cx43/Cx43水平(n=4, x±s) |
|
|
Western Blot检测显示,与对照组相比,WT α-Syn组和A53T α-Syn组的细胞内Cx43蛋白表达增加(F=6.37,q=4.04、5.76,P < 0.05),p-Cx43/Cx43水平明显升高(F=23.43,q=5.73、9.65,P < 0.01);与WT α-Syn组相比,A53T α-Syn组的细胞内Cx43蛋白表达差异无统计学意义(P>0.05), p-Cx43/Cx43水平升高,差异有显著性(q=3.61,P < 0.05)。见图 2,表 1。
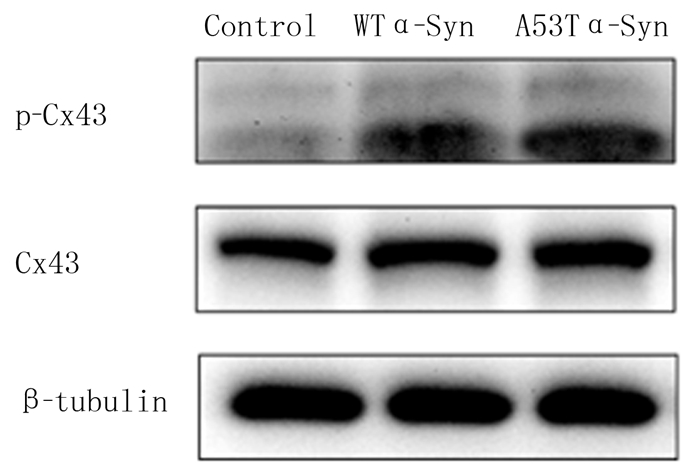 |
| 图 2 过表达α-Syn的SH-SY5Y细胞内Cx43蛋白及p-Cx43蛋白电泳结果 |
PD的病理表现为SNpc DA能神经元选择性缺失,并且形成α-Syn聚集为主的路易小体[3],α-Syn异常聚集可能参与了DA能神经元退行性病变的过程[5-6, 18]。在脑内,各细胞间都存在着GJ,迄今为止发现了3个连接蛋白家族:Cx、pannexin和innexin[19]。其中,以Cx家族研究最为广泛[9],在细胞中表达最普遍及研究最多的是Cx43[13]。中枢神经系统中Cx43广泛分布在神经元以及角质细胞中[20],它首先在细胞内质网核糖体上合成,随后被转运到高尔基体中,最后在细胞膜上聚集形成了GJ[21-22],从而起到及时清除神经元周围聚集的各类代谢产物以及减弱代谢产物对细胞自身损伤的作用[23]。正常情况下,细胞间可通过Cx43对DA产生一定的保护支持作用,而在脑卒中、癫痫等病理情况下会出现Cx43的异常表达[17]。Cx43蛋白及其组成的GJ在脑内形成了细胞传递信号的重要通道,参与调控离子通道的启闭,并且参与了多种神经系统疾病的发生[24-25]。在细胞的生命周期中,Cx43发生着不同的磷酸化[22, 26],并且磷酸化是Cx43最主要的共价修饰[27]。Cx43的C端是磷酸化作用的区域,易受到大量丝氨酸(S)和酪氨酸激酶和磷酸酶的调节,其中包括蛋白激酶A(PKA)、蛋白激酶C(PKC)、酪蛋白激酶1(CK1)以促分裂原活化蛋白激酶(MAPK)等[28-31],这些激酶和磷酸酶在其生命周期的所有阶段产生多种作用,包括从内质网到高尔基体及质膜的转运、GJ的组装及门控、GJ的降解和细胞周期调节[14, 32-34],影响Cx43正常生理功能及细胞间通讯,进而影响各种疾病的发生与发展。
本文研究结果显示,与空载组相比,WT α-Syn组以及A53T α-Syn组SH-SY5Y细胞的Cx43蛋白以及p-Cx43/Cx43水平均明显升高,且A53T α-Syn组p-Cx43/Cx43水平与WT α-Syn组相比明显升高,说明Cx43及p-Cx43/Cx43水平随着PD病情进展而增加,Cx43作为一种重要的调节蛋白,可能参与了PD的发病过程,为阐明PD的发病机制提供了实验依据,进而为药物干预PD病程提供可能的作用靶点。
综上所述,随着PD病程的发展,Cx43蛋白及其磷酸化蛋白的表达水平发生异常,但是Cx43蛋白磷酸化对PD病程的影响还需进一步研究。
| [1] |
ASAHINA M, LOW D A, MATHIAS C J, et al. Skin temperature of the hand in multiple system atrophy and Parkinson's disease[J]. Parkinsonism & Related Disorders, 2013, 19(5): 560-562. |
| [2] |
BEITZ J M. Parkinson's disease:a review[J]. Frontiers in Bioscience-Landmark, 2014, 6: 65-74. |
| [3] |
LEX K M, KUNDT F S, LORENZL S. Using tube feeding and levodopa-carbidopa intestinal gel application in advanced Parkinson's disease[J]. British Journal of Nursing (Mark Allen Publishing), 2018, 27(5): 259-262. DOI:10.12968/bjon.2018.27.5.259 |
| [4] |
ALERTE T N, AKINFOLARIN A A, FRIEDRICH E E, et al. Alpha-synuclein aggregation alters tyrosine hydroxylase phosphorylation and immunoreactivity:lessons from viral transduction of knockout mice[J]. Neuroscience Letters, 2008, 435(1): 24-29. DOI:10.1016/j.neulet.2008.02.014 |
| [5] |
CAO Zhentang, WU Yufeng, LIU Genliang, et al. alpha-Synuclein in salivary extracellular vesicles as a potential biomar-ker of Parkinson's disease[J]. Neuroscience Letters, 2019, 696: 114-120. DOI:10.1016/j.neulet.2018.12.030 |
| [6] |
ZHANG Guoxin, XIA Yun, WAN Fang, et al. New perspectives on roles of alpha-Synuclein in Parkinson's disease[J]. Frontiers in Aging Neuroscience, 2018, 10: 370-378. DOI:10.3389/fnagi.2018.00370 |
| [7] |
AVSHALUMOVA L J, KORIAKOS A. Overview of skin di-seases linked to connexin gene mutations[J]. International Journal of Dermatology, 2014, 53(2): 192-205. DOI:10.1111/ijd.12062 |
| [8] |
EPIFANTSEVA I, SHAW R M. Intracellular trafficking pathways of Cx43 gap junction channels[J]. Biochimica et Biophysica Acta-Biomembranes, 2018, 1860(1): 51-52. |
| [9] |
VINKEN M. Introduction:connexins, pannexins and their channels as gatekeepers of organ physiology[J]. Cellular and Molecular Life Sciences, 2015, 72(15): 2775-2778. DOI:10.1007/s00018-015-1958-3 |
| [10] |
NAGY J I, RASH J E. Connexins and gap junctions of astrocytes and oligodendrocytes in the CNS[J]. Brain Research Reviews, 2000, 32(1): 51-52. |
| [11] |
BENNETT M V, BARRIO L C, BARGIELLO T A, et al. Gap-junctions-new tools, new answers, new questions[J]. Neuron, 1991, 6(3): 305-320. DOI:10.1016/0896-6273(91)90241-Q |
| [12] |
LAMPE P D, LAU A F. The effects of connexin phosphorylation on gap junctional communication[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(7): 1171-1186. |
| [13] |
SÖHL G, WILLECKE K. Gap junctions and the connexin protein family[J]. Cardiovascular Research, 2004, 62(2): 228-232. DOI:10.1016/j.cardiores.2003.11.013 |
| [14] |
JOHNSON R G, REYNHOUT J K, TENBROEK E M, et al. Gap junction assembly:roles for the formation plaque and re-gulation by the C-Terminus of connexin43[J]. Molecular Biology of the Cell, 2011, 22(1): 71-86. |
| [15] |
SOLAN J L, LAMPE P D. Connexin43 phosphorylation:structural changes and biological effects[J]. The Biochemical Journal, 2009, 419(2): 261-272. DOI:10.1042/BJ20082319 |
| [16] |
LIN J H, YANG J, LIU S J, et al. Connexin mediates gap junction-independent resistance to cellular injury[J]. Journal of Neuroscience, 2003, 23(2): 430-441. DOI:10.1523/JNEUROSCI.23-02-00430.2003 |
| [17] |
FONSECA C G, GREEN C R, NICHOLSON L F. Upregulation in astrocytic connexin 43 gap junction levels may exacerbate generalized seizures in mesial temporal lobe epilepsy[J]. Brain Research, 2002, 929(1): 105-116. DOI:10.1016/S0006-8993(01)03289-9 |
| [18] |
SURMEIER D J, OBESO J A, HALLIDAY G M. Selective neuronal vulnerability in Parkinson disease[J]. Nature Reviews Neuroscience, 2017, 18(2): 101-113. DOI:10.1038/nrn.2016.178 |
| [19] |
BEYER E C, BERTHOUD V M. Gap junction gene and protein families:connexins, innexins, and pannexins[J]. Biochimica et Biophysica Acta-Biomembranes, 2018, 1860(1): 5-8. DOI:10.1016/j.bbamem.2017.05.016 |
| [20] |
FARBER N M, PEREZ-LLORET S, GAMZU E R. Design and development of a novel supportive care product for the treatment of sialorrhea in Parkinson's disease[J]. Current Topics in Medicinal Chemistry, 2015, 15(10): 939-954. DOI:10.2174/156802661510150328224130 |
| [21] |
SAEZ J C, BERTHOUD V M, BRANES M C, et al. Plasma membrane channels formed by connexins:their regulation and functions[J]. Physiological Reviews, 2003, 83(4): 1359-1400. DOI:10.1152/physrev.00007.2003 |
| [22] |
VANSLYKE J K, MUSIL L S. Dislocation and degradation from the ER are regulated by cytosolic stress[J]. Journal of Cell Biology, 2002, 157(3): 381-394. DOI:10.1083/jcb.200111045 |
| [23] |
ZUNDORF G, KAHLERT S, REISER G. Gap-junction blocker carbenoxolone differentially enhances NMDA-induced cell death in hippocampal neurons and astrocytes in co-culture[J]. Journal of Neurochemistry, 2007, 102(2): 508-521. DOI:10.1111/j.1471-4159.2007.04509.x |
| [24] |
VINKEN M, DECROCK E, LEYBAERT L, et al. Non-channel functions of connexins in cell growth and cell death[J]. Biochimica et Biophysica Acta-Biomembranes, 2012, 1818(8, SI): 2002-2008. DOI:10.1016/j.bbamem.2011.06.011 |
| [25] |
GREER K, CHEN Jiang, BRICKLER T, et al. Modulation of gap junction-associated Cx43 in neural stem/progenitor cells following traumatic brain injury[J]. Brain Research Bulletin, 2017, 134: 38-46. DOI:10.1016/j.brainresbull.2017.06.016 |
| [26] |
SOLAN J L, LAMPE P D. Specific Cx43 phosphorylation events regulate gap junction turnover in vivo[J]. FEBS Letters, 2014, 588(8): 1423-1429. DOI:10.1016/j.febslet.2014.01.049 |
| [27] |
MUSIL L S, CUNNINGHAM B A, EDELMAN G M, et al. Differential phosphorylation of the gap junction protein connexin43 in junctional communication-competent and-deficient cell lines[J]. Journal of Cell Biology, 1990, 111(5 Pt 1): 2077-2088. |
| [28] |
YOGO K, OGAWA T, AKIYAMA M A, et al. PKA implicated in the phosphorylation of Cx43 induced by stimulation with FSH in rat granulosa cells[J]. Journal of Reproduction and Development, 2006, 52(3): 321-328. DOI:10.1262/jrd.17107 |
| [29] |
BERTHOUD V M, LEDBETTER M L, HERTZBERG E L, et al. Connexin43 in MDCK cells:regulation by a tumor-promoting phorbol ester and Ca2+[J]. European Journal of Cell Biology, 1992, 57(1): 40-50. |
| [30] |
COOPER C D, LAMPE P D. Casein kinase 1 regulates connexin-43 gap junction assembly[J]. The Journal of Biological Chemistry, 2002, 277(47): 44962-44968. DOI:10.1074/jbc.M209427200 |
| [31] |
CAMERON S J, MALIK S, AKAIKE M, et al. Regulation of epidermal growth factor-induced connexin 43 gap junction communication by big mitogen-activated protein kinase1/ERK5 but not ERK1/2 kinase activation[J]. The Journal of Biological Chemistry, 2003, 278(20): 18682-18688. DOI:10.1074/jbc.M213283200 |
| [32] |
THEVENIN A F, KOWAL T J, FONG J T, et al. Proteins and mechanisms regulating gap-junction assembly, internalization, and degradation[J]. Physiology (Bethesda, Md.), 2013, 28(2): 93-116. |
| [33] |
SOLAN J L, LAMPE P D. Kinase programs spatiotemporally regulate gap junction assembly and disassembly:effects on wound repair[J]. Seminars in Cell & Developmental Biology, 2016, 50: 40-48. |
| [34] |
FALK M M, BELL C L, KELLS A M, et al. Molecular mechanisms regulating formation, trafficking and processing of annular gap junctions[J]. BMC Cell Biology, 2016, Suppl 1: 22-32. https: //link.springer.com/article/10.1186/s12860-016-0087-7
|
 2019, Vol. 55
2019, Vol. 55

