2. 青岛大学代谢病研究院;
3. 山东省代谢病重点实验室
KCNQ1基因于1996年在人类遗传性LQT综合征中首次被发现[1],该基因位于染色体11p15.5区,包括17个外显子。KCNQ1基因编码的蛋白为电压门控性钾离子通道KQT样亚家族成员,在人类组织中广泛表达[2-3]。KCNQ1和KCNE家族蛋白相互作用,装配成功能性钾通道,例如心肌细胞中KCNQ1/KCNE1装配形成慢性激活延迟整流钾通道,参与心肌细胞复极过程,胃黏膜细胞及肾小管上皮细胞中KCNQ1/KCNE2参与胃酸的分泌和水盐代谢等重要生理作用[4-6]。因此,KCNQ1基因突变及其表达水平的变化与人类多种疾病的发生密切相关。KCNQ1基因突变会导致遗传性LQT综合征和家族性心房颤动,除此之外,KCNQ1基因多态性与2型糖尿病及糖尿病性肾病有关[7-9]。LI等[10]应用全基因组关联分析(GWAS)发现,KCNQ1基因单核苷酸多态性(rs179785,G>A)与痛风发生紧密相关。王静[11]的研究显示,痛风病人外周血单核细胞中KCNQ1的表达水平明显高于健康人群,提示KCNQ1可能通过影响单核细胞功能参与痛风的发病过程,但具体机制不清。为探讨KCNQ1在痛风发病中的作用及其机制,本研究应用Cre-Loxp系统条件性基因敲除技术构建外周血单核细胞KCNQ1基因条件性敲除小鼠模型,并对该小鼠模型的生化指标及痛风关键炎症因子白细胞介素1β(IL-1β)的表达进行初步分析。
1 材料和方法 1.1 实验动物KCNQ1 cKO小鼠(KCNQ1flox/flox)及特异性启动子驱动的Lyz2-cre工具鼠均购自上海南方模式生物有限公司。小鼠在青岛大学附属医院科研实验中心SPF级动物房内进行繁殖和实验。小鼠养殖的环境温度为(23±2)℃,湿度为(48±5)%,每天光照时间为12 h。小鼠饲养笼、垫料及饮用水均经过高温高压灭菌处理。小鼠喂以啮齿类动物繁殖饲料,自由进食和饮水。动物实验获得青岛大学附属医院医学伦理委员会批准。
1.2 主要的仪器和试剂CFX 96荧光定量PCR仪和凝胶成像系统(美国BIO-RAD公司),全自动生化分析仪(日本东芝公司),酶联免疫吸附试验(ELISA)试剂盒(NEO公司),低温超速离心机(美国SIGMA公司)。
1.3 实验方法 1.3.1 获得KCNQ1flox/flox/Lyz2-cre+小鼠的交配策略小鼠按雄:雌=1:2的比例交配。首先让KCNQ1flox/flox小鼠与特异性表达cre酶的Lyz2-cre+工具鼠进行交配,以获得KCNQ1flox/+/Lyz2-cre+杂合子小鼠。然后让KCNQ1flox/+/Lyz2-cre+杂合子小鼠互相交配,鉴定和筛选后获得基因型为KCNQ1flox/flox/Lyz2-cre+的单核细胞KCNQ1基因条件性敲除小鼠(KCNQ1 cKO小鼠),以同窝出生的基因型为KCNQ1+/+/Lyz2-cre-的小鼠作为野生型(WT)对照。
1.3.2 子代小鼠基因型鉴定待鉴定小鼠生长至2周龄时剪取3 mm左右的鼠尾置于1.5 mL的EP管中,加入40 μL的NaOH溶液(50 mmol/L),在95 ℃金属浴中以350 r/min离心20 min,再加入40 μL Tris HCl涡旋震荡混匀,以12 000 r/min离心10 min,获得基因组DNA产物,用于PCR反应。PCR反应体系为20 μL:2×Taq Plus Master Mix 1 10 μL,上、下游引物各0.5 μL,ddH2O 5 μL,含基因组DNA的裂解产物4 μL。KCNQ1及Lyz2-cre引物由生工生物工程有限公司合成,序列见表 1。KCNQ1和Lyz2-cre反应条件:94 ℃、3 min;94 ℃、30 s,55 ℃、45 s,72 ℃、1 min,35个循环;72 ℃、5 min。取PCR扩增产物在15 g/L琼脂糖凝胶中电泳,用凝胶成像系统观察结果。当KCNQ1基因扩增产物仅在583 bp出现条带时小鼠的基因型为KCNQ1flox/flox,仅在480 bp出现条带时小鼠基因型为KCNQ1+/+,在583 bp和480 bp同时出现条带时小鼠的基因型为KCNQ1flox/+;当Lyz2-cre基因扩增产物在700 bp出现条带时小鼠的基因型则为Lyz2-cre+。
| 表 1 PCR反应所用引物序列 |
|
|
待KCNQ1 cKO小鼠和WT小鼠生长至8周龄时,各取8只,经内眦静脉取血500 μL,然后以3 500 r/min离心10 min后获得血清。采用全自动生化分析仪检测两组小鼠血尿酸(SUA)、空腹血糖(FPG)、三酰甘油(TG)、胆固醇(TC)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、肌酐(CRE)的水平。
1.3.4 KCNQ1 cKO小鼠和WT小鼠血清IL-1β水平检测采用ELISA法,按照试剂盒中提供的操作步骤进行检测。
1.4 数据处理及统计学分析采用SPSS 24.0软件进行统计学分析,所得计量资料数据以x±s表示,KCNQ1 cKO小鼠和WT小鼠间血生化指标及IL-1β水平的比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 基因型鉴定对子代小鼠基因型鉴定显示,KCNQ1flox/flox小鼠仅在583 bp处出现条带,而KCNQ1flox/+小鼠在583 bp和480 bp处同时出现条带,KCNQ1+/+仅在480 bp处出现条带;Lyz2-cre+小鼠在700 bp处出现条带,而Lyz2-cre-小鼠在350 bp处出现条带。其中157号小鼠的基因型为KCNQ1flox/flox/Lyz2-cre+,表明单核细胞特异性KCNQ1基因条件敲除小鼠模型构建成功。见图 1。
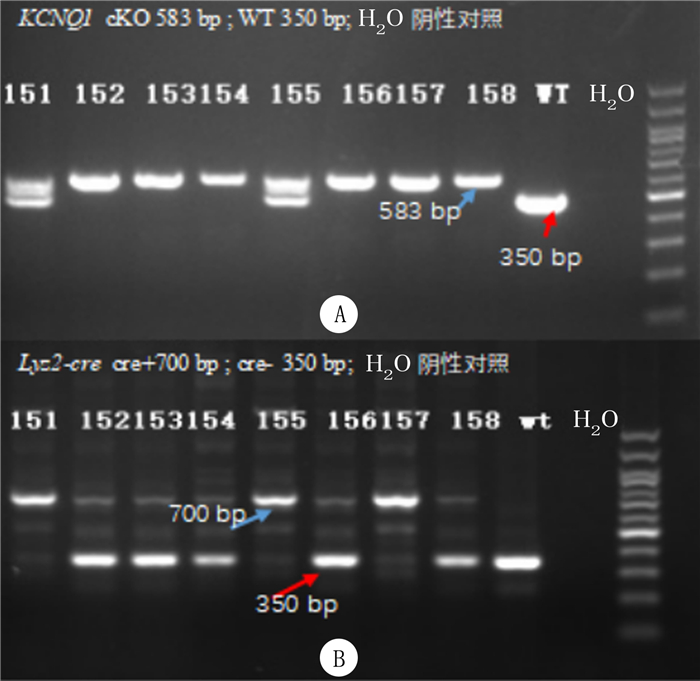 |
| A:KCNQ1基因鉴定条带;B:Lyz2-cre基因鉴定条带 图 1 KCNQ1flox/flox/Lyz2-cre+小鼠基因型鉴定 |
KCNQ1 cKO小鼠各项血生化指标与WT小鼠比较差异均无显著性(P>0.05)。见表 2。
| 表 2 KCNQ1 cKO小鼠和WT小鼠血生化指标比较(n=8,c/μmol·L-1,x±s) |
|
|
KCNQ1 cKO小鼠和WT小鼠血清IL-1β水平分别为(480.02±130.64)、(689.92±57.85)ng/L,KCNQ1 cKO小鼠血清IL-1β水平明显低于WT小鼠(t=3.622,P<0.05)。
3 讨论条件性基因敲除具有时间和空间可控性,可以实现体内特定种类器官或组织中的基因敲除,避免了因某些基因完全敲除所导致的胚胎死亡、发育畸形、早夭等问题[12-13]。条件性基因敲除小鼠广泛应用于人类疾病动物模型建立及人类疾病发病机制、基因功能鉴定和表型分析等研究[14]。本研究利用条件性基因敲除技术在国际上首次实现了单核细胞特异性KCNQ1基因条件性敲除。初步研究显示,基因敲除小鼠发育良好,并没有出现早期胚胎死亡、胚胎发育畸形等问题,生化指标正常。该动物模型的建立是条件性敲除技术在痛风功能基因研究领域中的一个重要应用。
KCNQ1基因位于染色体11p15.5区,所编码的电压门控性钾离子通道蛋白由676个氨基酸构成,包括6个跨膜结构域和1个具有离子选择性的p-loop结构域。KCNQ1基因广泛表达于人类组织中,该基因的突变及表达异常与人类多种疾病的发生密切相关[2-3, 15]。KCNQ1在心脏中表达水平最高,与KCNE共同形成慢性延迟整流性钾通道,参与心脏的复极过程。KCNQ1突变会导致许多与心律失常有关的疾病,如LQT综合征1型、JLN综合征1型和婴儿猝死综合征等,猝死率高达10%~20%[7, 16]。多项研究结果表明,KCNQ1基因多态性改变与2型糖尿病有关,KCNQ1危险等位基因变异影响胰岛β细胞分泌功能,导致胰岛素的分泌减少,影响正常的血糖调节,使2型糖尿病的发生概率增加了30%~40%[8, 17]。肾脏远曲小管分布有KCNQ1/KCNE3通道,参与K+分泌,调节机体的水电解质平衡,抑制KCNQ1基因表达会引起肾脏发育异常及滤过率降低[9]。KCNQ1在内耳、胃、胰腺等组织中也有一定的表达,KCNQ1基因突变或敲除的小鼠出现耳聋、胃肠发育异常、胰腺分泌异常等表型,但在人体中上述表型比较少见。本研究建立的单核细胞特异性KCNQ1基因条件性敲除小鼠模型发育良好,未出现上述表型,各血生化指标与WT小鼠比较差异均无显著性。分析原因可能为,该小鼠模型特异性敲除外周血单核细胞的KCNQ1基因,其心肌、胃肠、胰腺、肾脏等组织中KCNQ1基因表达正常,功能不受影响。
高尿酸血症是痛风发病的生化基础,临床上有10%~20%的高尿酸血症病人可以发展为痛风[18]。自然免疫系统被激活是高尿酸血症导致痛风的主要机制。尿酸浓度超过其在血中的饱和度(SUA>420 μmol/L)将形成尿酸盐结晶,沉积在关节及其周围组织等处。尿酸盐晶体在关节及其周围组织的沉积,导致单核细胞趋化并吞噬尿酸盐晶体,释放促炎因子,这些炎性递质会募集大量的单核细胞和中性粒细胞到达尿酸盐晶体所在部位,放大炎症级联反应,引起痛风的发作[19-22]。炎性通路中任何环节的异常均可导致痛风发作。研究表明,IL-1β是痛风发病过程中具有关键调控功能的细胞因子,它能引起中性粒细胞迁出至滑膜和关节液中,这是急性炎症反应的病理标志[23]。MARTIN等[24]的研究发现,尿酸盐晶体注入踝关节引起的炎症反应在IL-1受体敲除的小鼠中明显降低。本文研究结果显示,KCNQ1 cKO小鼠的血清IL-1β水平明显低于WT小鼠,表明KCNQ1可能通过调节单核细胞中IL-1β水平参与痛风的炎症反应过程。
综上所述,本研究成功建立了外周血单核细胞特异性KCNQ1基因条件性敲除小鼠模型;初步分析KCNQ1基因可能通过影响单核细胞的炎症反应参与痛风的发病过程,但具体机制尚不清楚。本研究为深入探讨KCNQ1参与痛风发病的机制,乃至后续的痛风精准医疗和痛风治疗药物的开发奠定了基础。
| [1] |
WANG Q, CURRAN M E, SPLAWSKI I, et al. Positional cloning of a novel potassium channel gene:KVLQT1 mutations cause cardiac arrhythmias[J]. Nature Genetics, 1996, 12(1): 17-23. DOI:10.1038/ng0196-17 |
| [2] |
景红娟, 何光源. KCNQ1通道的结构和功能[J]. 中国药理学通报, 2007, 23(12): 1548-1551. DOI:10.3321/j.issn:1001-1978.2007.12.007 |
| [3] |
SPLAWSKI I, SHEN J, TIMOTHY K W, et al. Genomic structure of three long QT syndrome genes:KVLQT1, HERG, and KCNE1[J]. Genomics, 1998, 51(1): 86-97. DOI:10.1006/geno.1998.5361 |
| [4] |
SEIDLER U, BACHMANN O, JACOB P, et al. Na+/HCO3- cotransport in normal and cystic fibrosis intestine[J]. JOP:Journal of the Pancreas, 2001, 2(4): 247-256. |
| [5] |
ABRAMOCHKIN D V, HASSINEN M, VORNANEN M. Transcripts of Kv7.1 and MinK channels and slow delayed rectifier K+ current (IKs) are expressed in zebrafish (Danio rerio) heart[J]. Pflugers Archiv, 2018, 470(12): 1573-1746. |
| [6] |
SONG P, GROOS S, RIEDERER B, et al. KCNQ1 is the luminal K+ recycling channel during stimulation of gastric acid secretion[J]. The Journal of Physiology, 2009, 587(15): 3955-3965. DOI:10.1113/jphysiol.2009.173302 |
| [7] |
MOSS A J, SHIMIZU W, WILDE A A, et al. Clinical aspects of type-1 long-QT syndrome by location, coding type, and biophysical function of mutations involving the KCNQ1 gene[J]. Circulation, 2007, 115(19): 2481-2489. DOI:10.1161/CIRCULATIONAHA.106.665406 |
| [8] |
LIU Y, ZHOU D Z, ZHANG D, et al. Variants in KCNQ1 are associated with susceptibility to type 2 diabetes in the po-pulation of mainland China[J]. Diabetologia, 2009, 52(7): 1315-1321. DOI:10.1007/s00125-009-1375-y |
| [9] |
LIU C T, GARNAAS M K, TIN A, et al. Genetic association for renal traits among participants of African ancestry reveals new loci for renal function[J]. PLoS Genetics, 2011, 7(9): e1002264. DOI:10.1371/journal.pgen.1002264 |
| [10] |
LI Changgui, LI Zhiqiang, LIU Shiguo, et al. Genome-wide association analysis identifies three new risk loci for gout arthritis in Han Chinese[J]. Nature Communications, 2015, 6: 7041. DOI:10.1038/ncomms8041 |
| [11] |
王静.原发性痛风易感基因KCNQ1基因的单核苷酸多态性对基因表达及单核细胞功能影响的研究[D].青岛: 青岛大学, 2017. https: //www.ixueshu.com/document/abba7189b6a751d105d245eaa5878b66.html
|
| [12] |
孔维健, 常宇鑫, 昝春芳, 等. 基于Cre-loxP系统条件性基因敲除小鼠的构建及其应用进展[J]. 中国实验诊断学, 2017, 21(12): 2208-2211. DOI:10.3969/j.issn.1007-4287.2017.12.057 |
| [13] |
SUN Xiaodong, FU Xiaoying, LI Jie, et al. Heterozygous deletion of Atbf1 by the Cre-loxP system in mice causes preweaning mortality[J]. Genesis, 2012, 50(11): 819-827. DOI:10.1002/dvg.22041 |
| [14] |
CASH-PADGETT T, SAWA A, JAARO-PELED H. Increased stereotypy in conditional Cxcr4 knockout mice[J]. Neuroscience Research, 2016, 105: 75-79. DOI:10.1016/j.neures.2015.10.001 |
| [15] |
FAN Haiyan, ZHANG Meng, LIU Wei. Hypermethylated KCNQ1 acts as a tumor suppressor in hepatocellular carcinoma[J]. Biochemical and Biophysical Research Communications, 2018, 503(4): 3100-3107. DOI:10.1016/j.bbrc.2018.08.099 |
| [16] |
SKINNER J R, WINBO A, ABRAMS D, et al. Channelopathies that lead to sudden cardiac death:clinicaland genetic aspects[J]. Heart Lung and Circulation, 2019, 28(1, SI): 22-30. DOI:10.1016/j.hlc.2018.09.007 |
| [17] |
BEEN L F, RALHAN S, WANDER G S, et al. Variants in KCNQ1 increase type Ⅱ diabetes susceptibility in South Asians:a study of 3, 310 subjects from India and the US[J]. BMC Medical Genetics, 2011, 12(1): 18. DOI:10.1186/1471-2350-12-18 |
| [18] |
RICHETTE P, BARDIN T. Gout[J]. Lancet, 2010, 375(9711): 318-328. DOI:10.1016/S0140-6736(09)60883-7 |
| [19] |
MARTIN W J, HARPER J L. Innate inflammation and resolution in acute gout[J]. Immunology and Cell Biology, 2010, 88(1): 15-19. DOI:10.1038/icb.2009.89 |
| [20] |
MARTIN W J, SHAW O, LIU X, et al. Monosodium urate monohydrate crystal-recruited noninflammatory monocytes differentiate into M1-like proinflammatory macrophages in a peritoneal murine model of gout[J]. Arthritis and Rheumatism, 2011, 63(5): 1322-1332. DOI:10.1002/art.30249 |
| [21] |
CHEN C J, SHI Y, HEARN A, et al. MyD88-dependent IL-1 receptor signaling is essential for gouty inflammation stimulated by monosodium urate crystals[J]. The Journal of Clinical Investigation, 2006, 116(8): 2262-2271. DOI:10.1172/JCI28075 |
| [22] |
ABHISHEK A, RODDY E, DOHERTY M. Gout-a guide for the general and acute physicians[J]. Clinical Medicine, 2017, 17(1): 54-59. DOI:10.7861/clinmedicine.17-1-54 |
| [23] |
LANDIS R C, HASKARD D O. Pathogenesis of crystal-induced inflammation[J]. Current Rheumatology Reports, 2001, 3(1): 36-41. DOI:10.1007/s11926-001-0049-7 |
| [24] |
MARTIN W J, WAITON M, HARPER J. Resident macrophages initiating and driving inflammation in a monosodium urate monohydrate crystal-induced murine peritoneal model of acute gout[J]. Arthritis Rheumatol, 2009, 60(1): 281-289. DOI:10.1002/art.24185 |
 2019, Vol. 55
2019, Vol. 55

