脑卒中作为一种常见的脑血管疾病,对病人的危害较大,可引起脑组织及远隔脏器损伤,其中肺损伤较为常见[1-2]。脑卒中相关性肺炎(SAP)是急性缺血性脑卒中的常见并发症,也是死亡原因之一[3]。脑卒中可导致炎症反应失衡,致使肺组织过度分泌炎症介质,造成肺组织受损[4]。因此,控制肺组织的炎症反应是改善脑卒中诱发肺部感染的关键。高迁移率族蛋白B1(HMGB1)是一种非常重要的炎症因子,与多种疾病有关[5],但HMGB1在SAP中的研究较少。甘草酸能抑制多种疾病的炎症反应,具有抗氧化、抗凋亡和抗炎等作用[6-7],但其在SAP中的作用尚不清楚。本研究旨在探讨甘草酸对SAP小鼠肺组织炎性损伤的影响,并初步探讨其可能的作用机制。
1 材料与方法 1.1 实验材料 1.1.1 实验动物SPF级C57BL/6J雄性小鼠31只,6~8周龄,体质量为18~20 g,购于济南朋悦实验动物繁育有限公司。小鼠在室温(23±2) ℃、相对湿度(45±15)%、12 h/12 h昼夜循环光照的环境下适应性喂养1周,期间可自由获取食物和饮水。动物实验获得青岛大学附属医院实验动物伦理委员会批准(AHQU-MAL20230512LSH)。
1.1.2 主要试剂甘草酸购自MedChemExpress公司;免疫组化染色试剂盒及苏木精-伊红(HE)染色试剂盒购自北京索莱宝科技有限公司;氯化钠注射液、二氨基联苯胺(DAB)显色剂和中性树胶封片剂购自武汉塞维尔生物科技有限公司。
1.2 实验方法 1.2.1 实验分组随机取8只小鼠作为假手术组,剩余23只小鼠用于模型组和甘草酸组造模。其中模型组12只,造模成功8只,死亡4只;甘草酸组11只,造模成功8只,死亡3只。最终假手术组、模型组、甘草酸组小鼠各8只。
1.2.2 SAP模型构建小鼠吸入体积分数为0.035的异氟醚麻醉后,以俯卧位固定于立体定位仪上[8]。以小鼠前卤门为基准点,进行皮肤消毒。于矢状缝附近建1个2 mm卒中窗口。光照前5 min腹腔注射孟加拉玫瑰红。将直径为4 mm光纤放入卒中窗口内并固定,小鼠的行程窗口暴露在绿色激发光下15 min。术后小鼠缝合皮肤,放回笼内,自由摄食和饮水。若造模后48 h内小鼠出现进食减少、饮水增多、耳缘静脉突起、毛发粗糙等症状,则判定为造模成功。假手术组只腹腔注射同等剂量孟加拉玫瑰红,不给予光照,其他操作同模型组;甘草酸组术前30 min给予小鼠腹腔注射50 mg/kg甘草酸,其余操作同模型组。
1.2.3 甘草酸预处理及标本采集在建立SAP模型前30 min,给予小鼠腹腔注射甘草酸50 mg/kg[9]。术后第3天,给予各组小鼠腹腔注射过量戊巴比妥钠深度麻醉,迅速取出肺组织。先对右肺进行快速洗涤,随后将其置于40 g/L多聚甲醛中固定,然后进行肺组织的病理学检查;左肺用于计算肺湿干质量比。
1.2.4 肺组织病理学观察取右肺上叶于40 g/L多聚甲醛中固定24 h,用石蜡包埋,切成4 μm厚的切片,按照HE染色试剂盒说明进行染色,用光学显微镜在400倍镜视野下收集图像,观察肺组织病理学的变化。
1.2.5 肺湿干质量比计算取左肺按照文献方法记录湿质量及干质量,计算肺湿干质量比[10]。
1.2.6 HMGB1蛋白的免疫组织化学检测按照文献方法进行操作[11]。在光学显微镜下拍照。收集400倍视野下的图像,用Image J软件对各组小鼠肺组织内HMGB1阳性面积占比进行量化。
1.3 统计学分析应用GraphPad Prism 10.1.2软件进行统计学分析。计量资料数据以x±s表示,多组数据比较采用单因素方差分析,组间两两比较采用Bonferroni检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组肺组织病理改变比较HE染色显示,假手术组小鼠肺泡结构完整,肺泡腔内没有炎性渗出物。与假手术组相比,模型组小鼠肺胞腔变窄、塌陷,肺泡壁增厚,部分肺泡受损及炎症细胞浸润,并伴有充血、出血等。与模型组相比,甘草酸组小鼠肺组织病理变化有一定程度的改善,如肺泡结构比较完整、组织结构清晰、炎性细胞浸润减少、红细胞渗出减少,表明甘草酸可以减轻SAP肺组织损伤。见图 1。
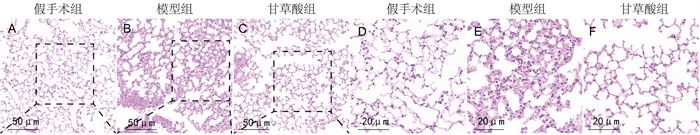 |
| 注:A、D为假手术组小鼠肺组织;B、E为模型组小鼠肺组织;C、F为甘草酸组小鼠肺组织。HE染色,其中A、B、C放大200倍,D、E、F放大400倍。 图 1 各组小鼠肺组织病理学观察 |
假手术组、模型组、甘草酸组的肺湿干质量比分别为2.61±0.27、6.23±0.60和4.21±1.01,3组间比较差异有统计学意义(F=20.53,P < 0.01)。两两比较结果显示,模型组小鼠肺湿干质量比较假手术组显著增高(P < 0.01),而甘草酸组小鼠肺湿干质量比较模型组显著降低(P < 0.05)。
2.3 各组肺组织HMGB1阳性面积占比比较免疫组化染色结果显示,假手术组HMGB1主要在肺组织细胞核内表达,模型组HMGB1主要在细胞质中表达。假手术组、模型组、甘草酸组小鼠肺组织内HMGB1的阳性面积占比分别为(1.05±0.40)%、(3.46±0.41)%和(2.35±0.42)% (n=3),3组间比较差异具有统计学意义(F=26.30,P < 0.01)。两两比较结果显示,模型组小鼠肺组织内HMGB1阳性面积占比较假手术组增高(P < 0.01),而甘草酸组小鼠肺组织内HMGB1阳性面积占比较模型组降低(P < 0.05)。见图 2。
 |
| 注:A、D为假手术组小鼠肺组织;B、E为模型组小鼠肺组织;C、F为甘草酸组小鼠肺组织。免疫组化染色,其中A、B、C放大200倍,D、E、F放大400倍。 图 2 各组小鼠肺组织HMGB1免疫组化染色观察 |
SAP会增加急性缺血性脑卒中病人的死亡风险、住院率和治疗费用等[12-13]。有研究表明,SAP可使脑卒中病人30 d病死率增加达3倍[14],并增加卒中后1年和3年的死亡风险[15-16]。目前,SAP的治疗主要包括一般治疗(化痰及痰液引流、氧疗及呼吸支持等)、早期营养支持、抗生素抗感染、中医中药治疗等[17],但治疗效果一般,难以达到令人满意的程度。目前缺乏良好的靶向治疗药物,这使得SAP的治疗面临着巨大的挑战。因此,迫切需要探寻有效的治疗药物来改善SAP病人的预后。甘草酸在许多疾病中都有研究,但在SAP中的研究相对较少。因此,本研究主要探讨甘草酸对SAP小鼠肺组织病理学变化的影响及其可能的作用靶点。
甘草酸是甘草根的主要活性成分,被广泛用于中医临床,具有很多重要作用,例如抗病毒、降低炎症反应、抗癌、抗氧化等作用[18-20]。本文研究结果表明,甘草酸可以改善SAP小鼠肺水肿程度和肺组织病理损伤,提示甘草酸可以减轻SAP小鼠肺组织的炎症反应,但其机制尚不清楚。
HMGB1是许多肺部疾病发病的生物标志物和炎症介质[21]。HMGB1是一种普遍存在的核蛋白,可调节许多肺部疾病发病相关基因的表达,还可调节染色质结构。HMGB1主要定位于正常细胞的细胞核中。当细胞受损或坏死时,细胞内的HMGB1会被激活并从细胞核释放到细胞质中。细胞外的HMGB1作为一种重要的炎症介质,可激活巨噬细胞和中性粒细胞等免疫细胞,引发炎症反应的级联放大。HMGB1可以与细胞表面受体(如晚期糖基化终末产物受体)结合,启动一系列信号转导通路,导致炎症细胞因子的释放,进一步加重肺部的炎性损伤[22]。无论是主动分泌还是被动释放,细胞外HMGB1都是可以触发炎症反应的危险信号[21, 23]。甘草酸作为HMGB1的抑制剂,可干扰HMGB1与细胞表面受体的相互作用,减少趋化因子和细胞因子介导的炎症级联反应,降低炎症因子的水平[24-25]。在以HMGB1为靶点的抑制剂中,甘草酸的应用最为广泛和有效[26],因此,本研究选择甘草酸作为干预药物,探讨其对SAP模型小鼠肺组织炎性损伤的影响及机制。本文研究结果显示,模型组小鼠肺组织中HMGB1阳性面积占比高于假手术组,且模型组小鼠的组织病理学损伤严重,肺水肿程度也高于假手术组;甘草酸组小鼠肺组织中HMGB1阳性面积占比较模型组降低,组织病理学损伤和肺水肿程度也较模型组有一定程度的改善。提示甘草酸可能通过抑制HMGB1的表达来减轻SAP模型小鼠肺部的炎症反应。
综上,甘草酸可以改善SAP小鼠肺组织的炎性损伤,这为SAP的治疗提供了新的线索。但本研究仍有许多问题需要进一步深入探讨。在后续的实验中,可以进一步检测肺组织中炎症因子及相关蛋白的表达,以更全面地了解甘草酸对SAP的治疗作用机制。同时,可以深入研究甘草酸抑制HMGB1表达的具体分子机制,包括信号通路的调节、基因表达的调控等多个层面。此外,还可以探讨甘草酸与其他治疗方法的联合应用,以提高治疗效果。对甘草酸在SAP中作用机制的深入研究,有望为SAP的治疗提供更充分的理论依据。
| [1] |
KALRA L, YU G, WILSON K, et al. Medical complications during stroke rehabilitation[J]. Stroke, 1995, 26(6): 990-994. DOI:10.1161/01.STR.26.6.990 |
| [2] |
SMITH CJ, KISHORE AK, VAIL A, et al. Diagnosis of stroke-associated pneumonia: recommendations from the pneumonia in stroke consensus group[J]. Stroke, 2015, 46(8): 2335-2340. DOI:10.1161/STROKEAHA.115.009617 |
| [3] |
LI T, SU X, LU P, et al. Bone marrow mesenchymal stem cell-derived dermcidin-containing migrasomes enhance LC3-associated phagocytosis of pulmonary macrophages and protect against post-stroke pneumonia[J]. Advanced Science, 2023, 10(22): e2206432. DOI:10.1002/advs.202206432 |
| [4] |
FAURA J, BUSTAMANTE A, MIRÓ-MUR F, et al. Stroke-induced immunosuppression: implications for the prevention and prediction of post-stroke infections[J]. Journal of Neuroinflammation, 2021, 18(1): 127. DOI:10.1186/s12974-021-02177-0 |
| [5] |
KANG R, CHEN R, ZHANG Q, et al. HMGB1 in health and disease[J]. Molecular Aspects of Medicine, 2014, 40: 1-116. DOI:10.1016/j.mam.2014.05.001 |
| [6] |
CHENG X, LIU Y W, QI B C, et al. Glycyrrhizic acid alleviated MI/R-induced injuries by inhibiting Hippo/YAP signaling pathways[J]. Cellular Signalling, 2024, 115: 111036. DOI:10.1016/j.cellsig.2024.111036 |
| [7] |
XIAO Y Y, ZHOU L L, TAO W K, et al. Preparation of paeoniflorin-glycyrrhizic acid complex transethosome gel and its preventive and therapeutic effects on Melasma[J]. Euro-pean Journal of Pharmaceutical Sciences, 2024, 192: 106664. DOI:10.1016/j.ejps.2023.106664 |
| [8] |
WATSON B D, DIETRICH W D, BUSTO R, et al. Induction of reproducible brain infarction by photochemically initiated thrombosis[J]. Annals of Neurology, 1985, 17(5): 497-504. DOI:10.1002/ana.410170513 |
| [9] |
LI C, PENG S, LIU X, et al. Glycyrrhizin, a direct HMGB1 antagonist, ameliorates inflammatory infiltration in a model of autoimmune thyroiditis via inhibition of TLR2-HMGB1 signaling[J]. Thyroid, 2017, 27(5): 722-731. DOI:10.1089/thy.2016.0432 |
| [10] |
CHEN H, LI N, ZHAN X, et al. Capsaicin protects against lipopolysaccharide-induced acute lung injury through the HMGB1/NF-κB and PI3K/AKT/mTOR pathways[J]. Journal of Inflammation Research, 2021, 14: 5291-5304. DOI:10.2147/JIR.S309457 |
| [11] |
赵眉眉, 姚璐, 姚景春, 等. 荆防颗粒抗感染性肺炎的靶点发现及分子机制研究[J]. 中国中药杂志, 2023, 48(3): 789-796. |
| [12] |
ELTRINGHAM S A, KILNER K, GEE M, et al. Factors associated with risk of stroke-associated pneumonia in patients with dysphagia: a systematic review[J]. Dysphagia, 2020, 35(5): 735-744. DOI:10.1007/s00455-019-10061-6 |
| [13] |
KISHORE A K, VAIL A, CHAMORRO A, et al. How is pneumonia diagnosed in clinical stroke research? A systematic review and meta-analysis[J]. Stroke, 2015, 46(5): 1202-1209. DOI:10.1161/STROKEAHA.114.007843 |
| [14] |
KATZAN I L, CEBUL R D, HUSAK S H, et al. The effect of pneumonia on mortality among patients hospitalized for acute stroke[J]. Neurology, 2003, 60(4): 620-625. DOI:10.1212/01.WNL.0000046586.38284.60 |
| [15] |
TEH W H, SMITH C J, BARLAS R S, et al. Impact of stroke-associated pneumonia on mortality, length of hospitalization, and functional outcome[J]. Acta Neurologica Scandinavica, 2018, 138(4): 293-300. DOI:10.1111/ane.12956 |
| [16] |
YU Y J, WENG W C, SU F C, et al. Association between pneumonia in acute stroke stage and 3-year mortality in patients with acute first-ever ischemic stroke[J]. Journal of Cli-nical Neuroscience, 2016, 33: 124-128. DOI:10.1016/j.jocn.2016.02.039 |
| [17] |
王拥军, 陈玉国, 吕传柱, 等. 卒中相关性肺炎诊治中国专家共识(2019更新版)[J]. 中国卒中杂志, 2019, 14(12): 1251-1262. |
| [18] |
MATSUMOTO Y, MATSUURA T, AOYAGI H, et al. Antiviral activity of glycyrrhizin against hepatitis C virus in vitro[J]. PLoS One, 2013, 8(7): e68992. DOI:10.1371/journal.pone.0068992 |
| [19] |
TSAO S M, YIN M C. Antioxidative and antiinflammatory activities of Asiatic acid, glycyrrhizic acid, and oleanolic acid in human bronchial epithelial cells[J]. Journal of Agricultural and Food Chemistry, 2015, 63(12): 3196-3204. DOI:10.1021/acs.jafc.5b00102 |
| [20] |
LIU Y B, GUO W F, LI M H. Diammonium glycyrrhizinate preparation for liver function recovery in ChronicHepatitis B in China: a meta-analysis with trial sequential analysis[J]. Current Pharmaceutical Design, 2022, 28(25): 2089-2112. DOI:10.2174/1381612828666220421134910 |
| [21] |
WANG M, GAUTHIER A, DALEY L, et al. The role of HMGB1, a nuclear damage-associated molecular pattern molecule, in the pathogenesis of lung diseases[J]. Antioxidants & Redox Signaling, 2019, 31(13): 954-993. |
| [22] |
LI J H, ZHU C S, HE L, et al. A two-decade journey in identifying high mobility group box 1 (HMGB1) and procathepsin L (pCTS-L) as potential therapeutic targets for sepsis[J]. Expert Opinion on Therapeutic Targets, 2023, 27(7): 575-591. DOI:10.1080/14728222.2023.2239495 |
| [23] |
CHEN R C, KANG R, TANG D L. The mechanism of HMGB1 secretion and release[J]. Experimental & Molecular Medicine, 2022, 54(2): 91-102. |
| [24] |
ZHU Z W, GUO Y N, LI X P, et al. Glycyrrhizic acid atte-nuates balloon-induced vascular injury through inactivation of RAGE signaling pathways[J]. Cardiovascular Innovations and Applications, 2020, 4(4): 239-249. |
| [25] |
HAZLETT L D, MCCLELLAN S, SOMAYAJULU M, et al. Targeting inflammation driven by HMGB1 in bacterial keratitis-a review[J]. Pathogens, 2021, 10(10): 1235. DOI:10.3390/pathogens10101235 |
| [26] |
NIU Z Y, LIN J S, HAO C F, et al. Glycyrrhizic acid atte-nuates pulmonary fibrosis of silicosis by inhibiting the interaction between HMGB1 and BRG1 through PI3K/Akt/mTOR pathway[J]. International Journal of Environmental Research and Public Health, 2022, 19(14): 8743. DOI:10.3390/ijerph19148743 |
 2024, Vol. 60
2024, Vol. 60

