2. 南阳市中心医院肿瘤内科,河南 南阳 473000;
3. 南阳市中心医院科研科,河南 南阳 473000
肺癌是世界上导致病人死亡的主要疾病之一,其进展机制一直是研究的重点,而研究表明趋化因子在肺癌的发生发展中扮演重要角色[1-4]。趋化因子是一类小细胞因子,趋化因子配体12(CXCL12)是趋化因子家族中研究最广泛的成员[5-6]。研究表明,CXCL12在肿瘤中广泛高表达,影响肿瘤的进展[7-8]。CXCL12与其特异性受体趋化因子受体4(CXCR4)相互作用后,诱导下游信号通路,促进细胞的迁移和侵袭[2, 6, 9]。CXCL12可以促进蛋白激酶B(AKT)的磷酸化,而AKT信号通路的激活可以诱导肿瘤细胞的自噬[10-12]。有研究结果表明,自噬可以促进肿瘤的自我更新和发展,但是在不同的肿瘤和环境中,自噬又可以抑制肿瘤的进展[13-16]。而CXCL12是否可以通过CXCR4/AKT诱导自噬影响肺癌细胞的侵袭和迁移尚不明确。本研究旨在探讨外源性CXCL12对肺癌细胞迁移的影响及其可能的作用机制。
1 材料与方法 1.1 实验材料实验细胞A549细胞购自武汉普诺赛生物科技有限公司。CXCR4抗体和兔二抗购自爱必信公司,磷酸化AKT(p-AKT)抗体和β-actin抗体购自CST公司,外源性CXCL12购自Peprotech公司,CXCR4抑制剂AMD3100购自Selleck公司,完全培养基购自普诺赛公司,胎牛血清购自依科赛公司,胰蛋白酶和青霉素-链霉素双抗购自索莱宝公司。
1.2 实验方法 1.2.1 细胞培养A549细胞使用含体积分数0.1胎牛血清和体积分数0.01青霉素-链霉素双抗的混合培养液培养。
1.2.2 药物作用使用AMD3100预处理A549细胞1 h,然后再加入0.1 mg/L的外源性CXCL12共同培养24 h。
1.2.3 划痕实验将A549细胞接种于6孔板中,待细胞长满后用200 μL的枪头在板中央划线,然后用PBS洗3遍,将漂浮的细胞洗去,此时作为0 h拍照。用含体积分数0.01胎牛血清的培养液继续培养,分别在培养24、48 h时拍照,然后计算愈合率。
1.2.4 自噬相关蛋白及CXCR4/AKT信号通路蛋白Western blot检测用RIPA裂解液、蛋白酶抑制剂和磷酸酶抑制剂的混合液裂解细胞0.5 h,在4 ℃下以20 000 r/min离心15 min,取蛋白上清。用BCA试剂盒测蛋白浓度后,将所有蛋白样本稀释至同一浓度,然后加上样缓冲液,沸水煮5 min。制备SDS聚丙烯酰胺凝胶,加入蛋白样本20 μg,电泳分离蛋白,然后使用PVDF膜300 mA湿转1 h。转膜后用含50 g/L脱脂牛奶的TBST溶液封闭2 h,以PBST洗3遍后加一抗4 ℃孵育过夜。吸去一抗,以PBST洗3遍,加入二抗常温孵育2 h,以PBST洗3遍,用ECL发光液显影。使用Image J软件分析蛋白条带的灰度值,蛋白表达水平以目的蛋白与内参蛋白灰度值的比值表示。
1.3 统计学处理使用GraphPad Prism 9.0软件进行统计学分析。计量资料结果以x±s表示,两组比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 CXCL12对A549细胞迁移的影响划痕实验结果显示,与对照组相比,加入外源性CXCL12组细胞的迁移能力增强,差异有统计学意义(t=3.949,P < 0.05)。见图 1。
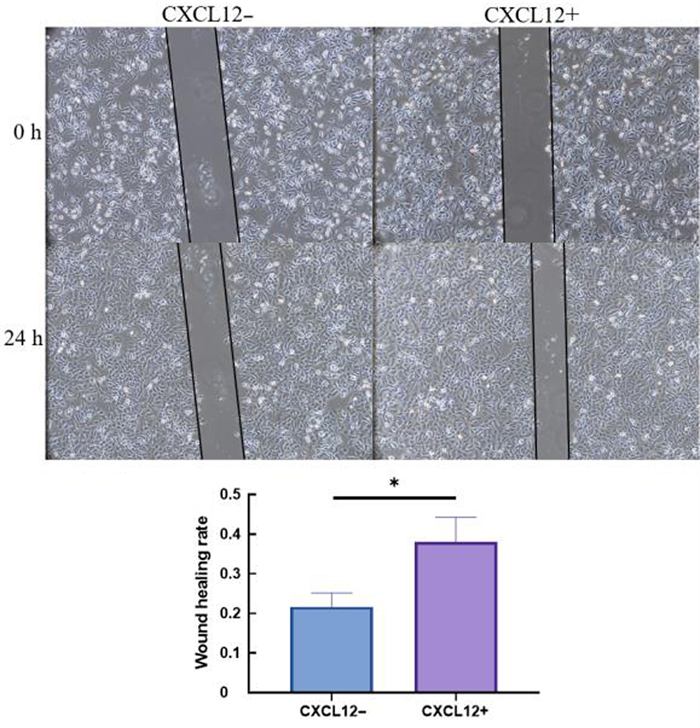 |
| 注:CXCL12-为对照组,CXCL12+为加入外源性CXCL12组;两组比较,*t=3.949,P < 0.05。 图 1 划痕实验检测细胞的迁移能力 |
Western blot实验结果显示,与对照组相比,加入外源性CXCL12组细胞自噬蛋白LC3B Ⅱ的表达增高,差异具有统计学意义(t=3.051,P < 0.05)。见图 2。
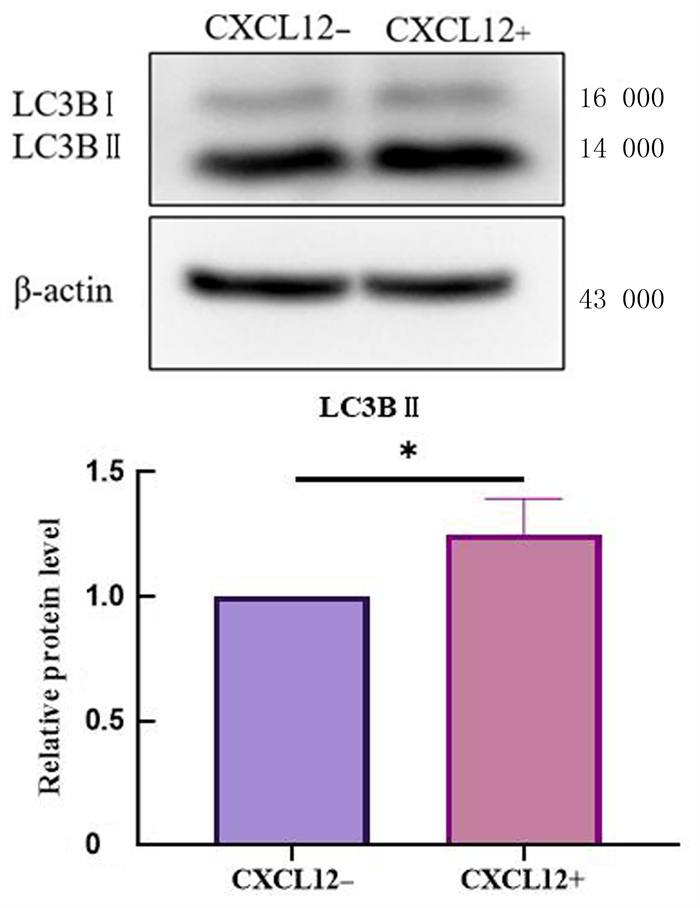 |
| 注:CXCL12-为对照组,CXCL12+为加入外源性CXCL12组;两组比较,*t=3.051,P < 0.05。 图 2 Western bot检测LC3B蛋白表达 |
Western blot实验结果显示,与对照组相比,加入外源性CXCL12组细胞CXCR4及p-AKT的表达增加,差异有统计学意义(t=2.974、4.307,P < 0.05)。见图 3。
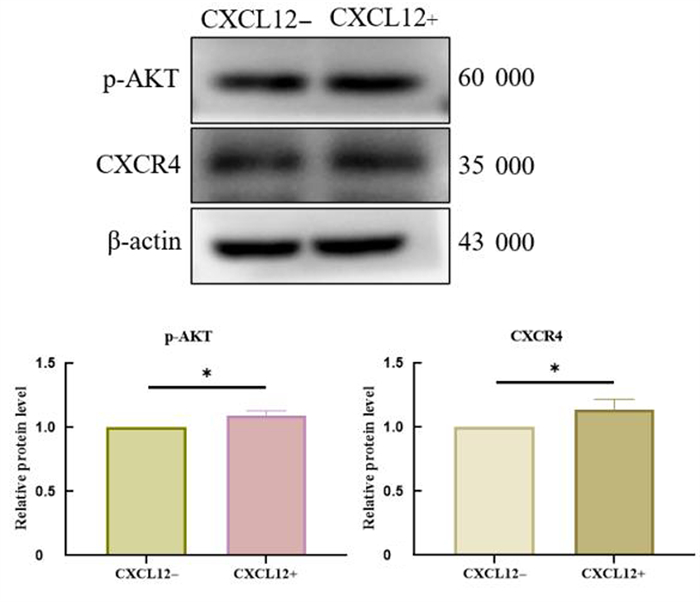 |
| 注:CXCL12-为对照组,CXCL12+为加入外源性CXCL12组;两组比较,*t=2.974、4.307,P < 0.05。 图 3 Western bot检测p-AKT、CXCR4蛋白表达 |
本实验使用外源性CXCL12作用于肺癌A549细胞,然后对细胞的迁移能力进行检测,结果显示,加入外源性CXCL12可以明显促进肺癌细胞的迁移。现有的研究发现,CXCL12可以调节骨髓的肿瘤微环境,利于肿瘤转移[17]。CXCL12可以明显促进乳腺癌向骨髓和其他部位的转移,并且CXCL12的表达还与乳腺癌向肝脏和肺部的转移密切相关[18-20]。此外,CXCL12可以通过激活ERK1/2信号通路维持食管癌干细胞高水平的转移特征,证明CXCL12是影响食管癌的潜在靶点之一[21-22]。这些研究结果与本研究结果相一致,表明CXCL12可以促进肿瘤的转移,是影响多种肿瘤转移的潜在分子。但是有研究结果显示,CXCL12可显著减缓胰腺癌在体外的生长,并且使体内肿瘤也明显变小,此外,CXCL12还导致肿瘤细胞在体外的黏附性和迁移性变差,在体内的转移性变弱[23]。这说明CXCL12对肿瘤转移的影响在不同肿瘤中扮演着不同的角色,尚需继续探究CXCL12在不同肿瘤转移中的具体作用和机制。目前已经确定CXCL12是影响肿瘤进展的一个重要分子,对CXCL12的继续研究可以为肿瘤的治疗提供新的策略。
目前的研究发现,外源性CXCL12在促进肺癌细胞迁移的同时,可以促进细胞的自噬。而自噬抑制剂氯喹可以抑制CXCL12介导的癌细胞迁移[24]。本实验结果显示,CXCL12可以促进自噬标志性蛋白LC3B Ⅱ的表达,提示CXCL12可能是通过诱导肺癌细胞的自噬促进细胞迁移。有研究结果表明,CXCL12可以与CXCR4结合,然后诱导细胞内信号传导,参与肿瘤的转移[25-29]。为了探究CXCL12是否是通过CXCR4激活AKT发挥作用,本实验在肺癌细胞中加入外源性CXCL12,对CXCR4的表达和AKT的磷酸化水平进行检测,结果显示,外源性CXCL12可以促进肺癌细胞CXCR4的表达和AKT的磷酸化。有研究结果表明,CXCL12/CXCR4可以通过激活AKT信号通路促进胶质母细胞瘤细胞的迁移[30],并且CXCR4的抑制剂AMD3100可以抑制CXCR4介导的骨肉瘤转移[31-32]。但是,目前尚无研究证明在肺癌中CXCL12可通过CXCR4/AKT信号通路诱导自噬促进肺癌的转移。所以,本研究首次对此进行了探讨,结果表明CXCL12可能通过CXCR4/AKT诱导自噬进而发挥促肺癌细胞迁移的作用。
综上,CXCL12可促进肺癌细胞的迁移和自噬,并且可促进CXCR4的表达和AKT的磷酸化,提示CXCL12可能通过CXCR4/AKT诱导自噬,进而促进肺癌细胞的迁移。本文结果为肺癌的治疗提供了新的研究方向。但本研究仅探讨了CXCL12诱导肺癌细胞自噬和迁移的相关性,两者的具体作用还有待进一步研究和探讨。
| [1] |
NASIM F, SABATH B F, EAPEN G A. Lung cancer[J]. The Medical Clinics of North America, 2019, 103(3): 463-473. DOI:10.1016/j.mcna.2018.12.006 |
| [2] |
CAVALLARO S. CXCR4/CXCL12 in non-small-cell lung cancer metastasis to the brain[J]. International Journal of Molecular Sciences, 2013, 14(1): 1713-1727. DOI:10.3390/ijms14011713 |
| [3] |
SPAKS A. Role of CXC group chemokines in lung cancer development and progression[J]. Journal of Thoracic Disease, 2017, 9(Suppl 3): S164-S171. |
| [4] |
HASHEMI S F, KHORRAMDELAZAD H. The cryptic role of CXCL17/CXCR8 axis in the pathogenesis of cancers: a review of the latest evidence[J]. Journal of Cell Communication and Signaling, 2023, 17(3): 409-422. DOI:10.1007/s12079-022-00699-7 |
| [5] |
ADAMS D H, LLOYD A R. Chemokines: leucocyte recruitment and activation cytokines[J]. Lancet (London, England), 1997, 349(9050): 490-495. DOI:10.1016/S0140-6736(96)07524-1 |
| [6] |
YANG Y, LI J, LEI W, et al. CXCL12-CXCR4/CXCR7 axis in cancer: from mechanisms to clinical applications[J]. International Journal of Biological Sciences, 2023, 19(11): 3341-3359. DOI:10.7150/ijbs.82317 |
| [7] |
ZHANG Z, YU Y, ZHANG Z, et al. Cancer-associated fibroblasts-derived CXCL12 enhances immune escape of bladder cancer through inhibiting P62-mediated autophagic degradation of PDL1[J]. Journal of Experimental & Clinical Cancer Research: CR, 2023, 42(1): 316. |
| [8] |
WANG D, WANG X, SONG Y, et al. Exosomal miR-146a-5p and miR-155-5p promote CXCL12/CXCR7-induced metastasis of colorectal cancer by crosstalk with cancer-associated fibroblasts[J]. Cell Death & Disease, 2022, 13(4): 380. |
| [9] |
WU X, QIANL, ZHAOH D, et al. CXCL12/CXCR4: an amazing challenge and opportunity inthe fight against fibrosis[J]. Ageing Research Reviews, 2023, 83: 101809. DOI:10.1016/j.arr.2022.101809 |
| [10] |
HASHIMOTO I, KOIZUMI K, TATEMATSU M, et al. Blocking on the CXCR4/mTOR signalling pathway induces the anti-metastatic properties and autophagic cell death in peritoneal disseminated gastric cancer cells[J]. European Journal of Cancer (Oxford, England: 1990), 2008, 44(7): 1022-1029. DOI:10.1016/j.ejca.2008.02.043 |
| [11] |
RONG L, LI Z, LENG X, et al. Salidroside induces apoptosis and protective autophagy in human gastric cancer AGS cells through the PI3K/Akt/mTOR pathway[J]. Biomedicine & Pharmacotherapy=Biomedecine & Pharmacotherapie, 2020, 122: 109726. |
| [12] |
ZHENG J Y, QU D N, WANG C, et al. Involvement of CXCL12/CXCR4 in the motility of human first-trimester endometrial epithelial cells through an autocrine mechanism by activating PI3K/AKT signaling[J]. BMC Pregnancy and Childbirth, 2020, 20(1): 87. DOI:10.1186/s12884-020-2788-3 |
| [13] |
HAN Y H, MUN J G, JEON H D, et al. Betulin inhibits lung metastasis by inducing cell cycle arrest, autophagy, and apoptosis of metastatic colorectal cancer cells[J]. Nutrients, 2019, 12(1): 66. DOI:10.3390/nu12010066 |
| [14] |
DEBNATH J, GAMMOH N, RYAN K M. Autophagy and autophagy-related pathways in cancer[J]. Nature Reviews Molecular Cell Biology, 2023, 24(8): 560-575. DOI:10.1038/s41580-023-00585-z |
| [15] |
MA Z, LOU S, JIANG Z. PHLDA2 regulates EMT and autophagy in colorectal cancer via the PI3K/AKT signaling pathway[J]. Aging, 2020, 12(9): 7985-8000. DOI:10.18632/aging.103117 |
| [16] |
SEYDI H, NOURI K, SHOKOUHIAN B, et al. MiR-29a-laden extracellular vesicles efficiently induced apoptosis through autophagy blockage inHCC cells[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2024, 203: 114470. DOI:10.1016/j.ejpb.2024.114470 |
| [17] |
SHI J, WEI Y, XIA J, et al. CXCL12-CXCR4 contributes to the implication of bone marrow in cancer metastasis[J]. Future Oncology (London, England), 2014, 10(5): 749-759. DOI:10.2217/fon.13.193 |
| [18] |
RAY P, STACER A C, FENNER J, et al. CXCL12-γ in primary tumors drives breast cancer metastasis[J]. Oncogene, 2015, 34(16): 2043-2051. DOI:10.1038/onc.2014.157 |
| [19] |
MARTINEZ-ORDOÑEZ A, SEOANE S, CABEZAS P, et al. Breast cancer metastasis to liver and lung is facilitated by Pit-1-CXCL12-CXCR4 axis[J]. Oncogene, 2018, 37(11): 1430-1444. DOI:10.1038/s41388-017-0036-8 |
| [20] |
NGUYEN K T P, DRUHAN L J, AVALOS B R, et al. CXCL12-CXCL4 heterodimerization prevents CXCL12-drivenbreast cancer cell migration[J]. Cellular Signalling, 2020, 66: 109488. DOI:10.1016/j.cellsig.2019.109488 |
| [21] |
WANG X, CAO Y, ZHANG S, et al. Stem cell autocrine CXCL12/CXCR4 stimulates invasion and metastasis of esophageal cancer[J]. Oncotarget, 2017, 8(22): 36149-36160. DOI:10.18632/oncotarget.15254 |
| [22] |
JIANG G C, XU S, MAI X B, et al. SAP deletion promotes malignant insulinoma progression by inducing CXCL12 secretion from CAFs via the CXCR4/p38/ERK signalling pathway[J]. Journal of Cellular and Molecular Medicine, 2024, 28(10): e18397. DOI:10.1111/jcmm.18397 |
| [23] |
ROY I, ZIMMERMAN N P, MACKINNON A C, et al. CXCL12 chemokine expression suppresses human pancreatic cancer growth and metastasis[J]. PloS one, 2014, 9(3): e90400. DOI:10.1371/journal.pone.0090400 |
| [24] |
YU F, LI J, XIE Y, et al. Polymeric chloroquine as an inhibitor of cancer cell migration and experimental lung metastasis[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2016, 244(Pt B): 347-356. |
| [25] |
TEICHER B A, FRICKER S P. CXCL12 (SDF-1)/CXCR4 pathway in cancer[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2010, 16(11): 2927-2931. DOI:10.1158/1078-0432.CCR-09-2329 |
| [26] |
MORTEZAEE K. CXCL12/CXCR4 axis in the microenvironment of solid tumors: a critical mediator of metastasis[J]. Life Sciences, 2020, 249: 117534. DOI:10.1016/j.lfs.2020.117534 |
| [27] |
RUSETSKA N, KOWALSKI K, ZALEWSKI K, et al. CXCR4/ACKR3/CXCL12 axis in the lymphatic metastasis of vulvar squamous cell carcinoma[J]. Journal of Clinical Pathology, 2022, 75(5): 324-332. DOI:10.1136/jclinpath-2020-206917 |
| [28] |
LIEKENS S, SCHOLS D, HATSE S. CXCL12-CXCR4 axis in angiogenesis, metastasis and stem cell mobilization[J]. Current Pharmaceutical Design, 2010, 16(35): 3903-3920. DOI:10.2174/138161210794455003 |
| [29] |
LIAO Y X, ZHOU C H, ZENG H, et al. The role of the CXCL12-CXCR4/CXCR7 axis in the progression and metastasis of bone sarcomas (Review)[J]. International Journal of Molecular Medicine, 2013, 32(6): 1239-1246. DOI:10.3892/ijmm.2013.1521 |
| [30] |
YIN X, XIA K, PENG S, et al. ABCF1/CXCL12/CXCR4 enhances glioblastoma cell proliferation, migration, and invasion by activating the PI3K/AKT signal pathway[J]. Developmental Neuroscience, 2023, 46(3): 210-220. |
| [31] |
LIAO Y X, FU Z Z, ZHOU C H, et al. AMD3100 reduces CXCR4-mediated survival and metastasis of osteosarcoma by inhibiting JNK and Akt, but not p38 or Erk1/2, pathways in in vitro and mouse experiments[J]. Oncology Reports, 2015, 34(1): 33-42. DOI:10.3892/or.2015.3992 |
| [32] |
LIAO Y X, LV J Y, ZHOU Z F, et al. CXCR4 blockade sensitizes osteosarcoma to doxorubicin by inducing autophagic cell death via PI3K-Akt-mTOR pathway inhibition[J]. International Journal of Oncology, 2021, 59(1): 49. DOI:10.3892/ijo.2021.5229 |
 2024, Vol. 60
2024, Vol. 60

