糖尿病性白内障(DC)是糖尿病的主要并发症,会导致视力障碍或失明[1-3]。高糖(HG)在DC的发展中发挥重要作用,并可通过诱导晶状体上皮细胞(LEC)的凋亡和氧化应激引发晶状体混浊[4-6]。在特定的条件下,自噬可以抑制细胞凋亡和氧化应激,清除LEC蛋白和降解的细胞器,维持晶状体的透明度[7-8]。因此,探索DC的发病机制对寻找有效的治疗方法至关重要。黄柏碱具有降血糖、抗氧化、抗炎、降压以及免疫调节等作用[9],它可以通过调节多种信号通路对抗糖尿病[10]。腺苷酸活化蛋白激酶(AMPK)可调节细胞和器官的生长,雷帕霉素靶蛋白(mTOR)是AMPK的关键下游靶标,可以调节细胞翻译、转录和自噬,AMPK信号通路参与调控DC的自噬[11-13]。此外,黄柏碱通过调节AMPK/mTOR通路促进自噬[14-16]。目前尚不清楚黄柏碱是否能通过调节AMPK/mTOR通路影响HG诱导的LEC自噬和凋亡。本研究探讨了黄柏碱对HG诱导的LEC自噬和凋亡的影响及其机制。
1 材料与方法 1.1 实验材料及仪器人LEC(HLEB3细胞系,美国ACCT细胞库);黄柏碱(纯度≥98%,成都植标化纯生物有限公司);DCFH-DA试剂盒以及Compound C(美国MedChemExpress公司);丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒(上海酶联生物公司);胎牛血清(FBS)、DEME培养液(美国Gibco公司);细胞计数(CCK-8)检测试剂盒、AnnexinV-FITC/PI检测试剂盒(上海碧云天公司);一抗蛋白B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、自噬蛋白Beclin-1、微管相关蛋白轻链3(LC3)-Ⅰ/Ⅱ、AMPK、p-AMPK、mTOR、p-mTOR和内参β-actin抗体(美国赛默飞公司);二抗山羊抗兔IgG(南京建成生物工程研究所)。流式细胞仪(北京安诺伦公司);透射电子显微镜(日本Olympus公司);荧光显微镜(德国徕卡公司);全自动酶标仪(美国Biotek公司)。
1.2 实验方法 1.2.1 细胞培养将HLEB3细胞置于37 ℃、含体积分数0.05 CO2和体积分数0.10 FBS的DMEM培养液中培养。当细胞复苏至80%时,用胰酶消化传代,每隔2~3 d传代1次。将复苏后的HLEB3细胞分为对照组(5.5 mmoL/L葡萄糖培养液培养)和HG组(30.0 mmoL/L葡萄糖培养液培养),分别培养至对数生长期。
1.2.2 黄柏碱最佳浓度筛选取对数生长期的对照组HLEB3细胞,以每孔1×104个细胞的密度接种至96孔板中,使用不同浓度的黄柏碱(0、1、3、5、7、9 mg/L)培养24 h;处于对数生长期的HG组HLEB3细胞处理同对照组,后在30.0 mmol/L葡萄糖培养液中培养24 h。每组重复3次,细胞处理完成后,每孔加入100 g/L CCK-8溶液(10 μL)在37 ℃孵育2 h,用酶标仪测量450 nm波长处的吸光度值,计算细胞活力。筛选出黄柏碱最佳浓度用于后续实验。
1.2.3 实验分组将HLEB3细胞分为对照组(A组)、HG组(B组)、黄柏碱组(C组)、Compound C(AMPK抑制剂)组(D组)。其中黄柏碱组细胞用筛选出的最佳浓度(5 mg/L)的黄柏碱处理24 h,在30.0 mmol/L的葡萄糖培养液中培养24 h;Compound C组细胞用10 mmol/L Compound C[17]和5 mg/L黄柏碱培养24 h,后在30.0 mmol/L葡萄糖培养液中培养。
1.2.4 CCK-8法检测细胞活力取各组细胞以每孔1×103个细胞密度接种于96孔板,培养24 h。然后每孔加入100 g/L CCK-8溶液(10 μL)在37 ℃孵育2 h,用酶标仪测量450 nm波长处的吸光度值,计算细胞活力。每组重复3次。
1.2.5 流式细胞术检测细胞凋亡取各组细胞以每孔1×105个细胞密度接种于6孔板中,培养12 h。按照AnnexinV-FITC/PI细胞凋亡双染试剂盒说明书逐步进行染色,用流式细胞仪检测细胞凋亡。
1.2.6 电镜超微结构观察将各组细胞置25 g/L戊二醛溶液中4 ℃固定过夜,后在室温下固定、脱水,环氧树脂包埋处理,切片染色,并在透射电镜下观察拍照。
1.2.7 氧化应激指标检测对各组细胞ROS、MDA、SOD水平进行检测,采用活性氧荧光探针(DCFH-DA)法检测细胞内ROS含量,并在荧光显微镜下观察拍照;MDA、SOD水平按照ELISA试剂盒说明书进行检测。
1.2.8 Western blot检测蛋白表达将各组细胞破碎后提取总蛋白,用BCA试剂盒进行浓度定量,按步骤将蛋白SDS-PAGE电泳、转膜,50 g/L脱脂奶粉封闭2 h,在4 ℃下加入一抗Bcl-2、Bax、Beclin-1、LC3-Ⅱ、LC3-Ⅰ、p-AMPK、AMPK、p-mTOR、mTOR(1∶2 000)和β-actin过夜孵育,清洗,在4 ℃下加入二抗山羊抗兔IgG(1∶1 000),孵育2 h。用ECL发光显影,观察拍照,各条带的灰度值应用Image J软件处理分析。
1.3 统计学处理采用SPSS 22.0和GraphPad Prism 8.0软件进行数据的统计学处理。计量资料以x±s形式表示,多组数据比较采用单因素设计方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 黄柏碱最佳浓度筛选在对照组HLEB3细胞中,与0 mg/L黄柏碱相比,1、3、5 mg/L黄柏碱干预对细胞活力无显著影响(P>0.05),7、9 mg/L黄柏碱干预显著抑制细胞活力(F=38.422,P<0.001)。见图 1。在HG诱导HLEB3细胞中,与0 mg/L黄柏碱相比较,1、3、5、7、9 mg/L黄柏碱干预显著提高了细胞活力(F=55.220,P<0.001),其中5 mg/L黄柏碱的干预效果最显著,故选择5 mg/L作为黄柏碱后续实验浓度。见图 2。
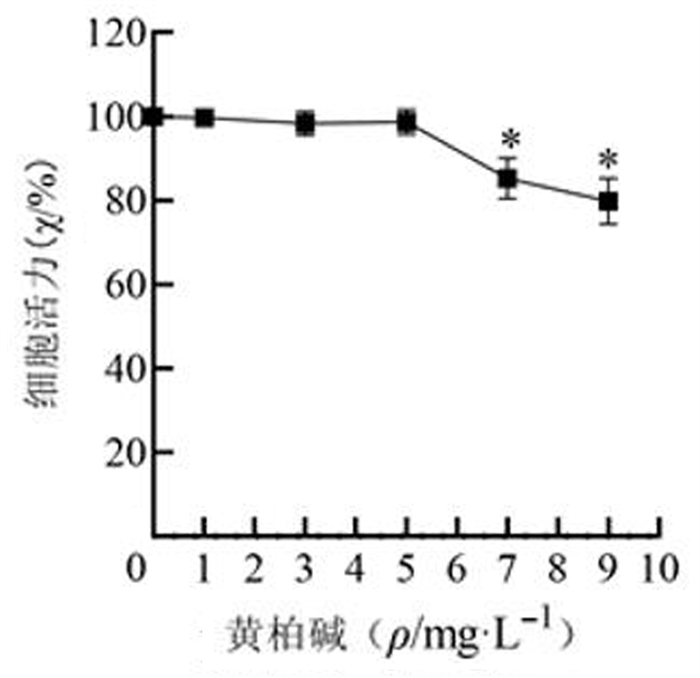 |
| 与0 mg/L黄柏碱比较,*P<0.05。 图 1 不同浓度黄柏碱对对照组HLEB3细胞活力的影响 |
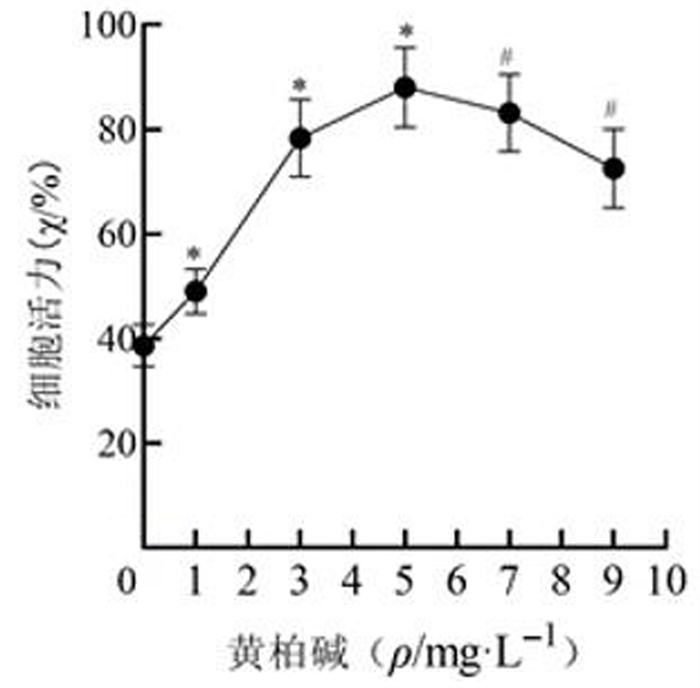 |
| 与0 mg/L黄柏碱比较,*P<0.05;与5 mg/L黄柏碱比较,#P<0.05。 图 2 不同浓度黄柏碱对HG诱导HLEB3细胞活力的影响 |
A~D组细胞活力分别为(100.00±0)%、(38.65±4.01)%、(83.07±8.26)%和(42.07±4.38)%,4组比较差异有显著性(F=213.971,P<0.001)。与A组相比,B组细胞活力显著降低(P<0.05);与B组相比,C组细胞活力显著升高(P<0.05);与C组相比,D组细胞活力显著降低(P<0.05)。
2.3 各组细胞凋亡率及凋亡蛋白表达比较本文4组细胞凋亡率、Bax和Bcl-2蛋白表达比较,差异均有显著性(F=19.111~156.780,P<0.001)。与A组相比,B组细胞凋亡率、Bax蛋白表达显著升高,Bcl-2蛋白表达显著降低(P<0.05);与B组相比,C组细胞凋亡率、Bax蛋白表达显著降低,Bcl-2蛋白表达显著升高(P < 0.05);与C组相比,D组细胞凋亡率、Bax蛋白表达显著升高,Bcl-2蛋白表达显著降低(P<0.05)。见图 3、4和表 1。
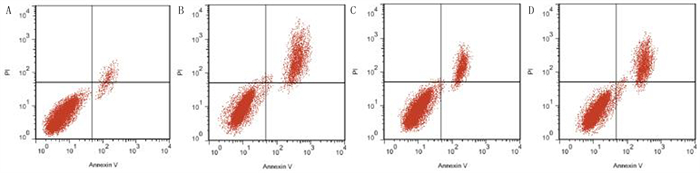 |
| A:对照组;B:HG组;C:黄柏碱组;D:Compound C组。 图 3 各组细胞凋亡流式细胞术检测 |
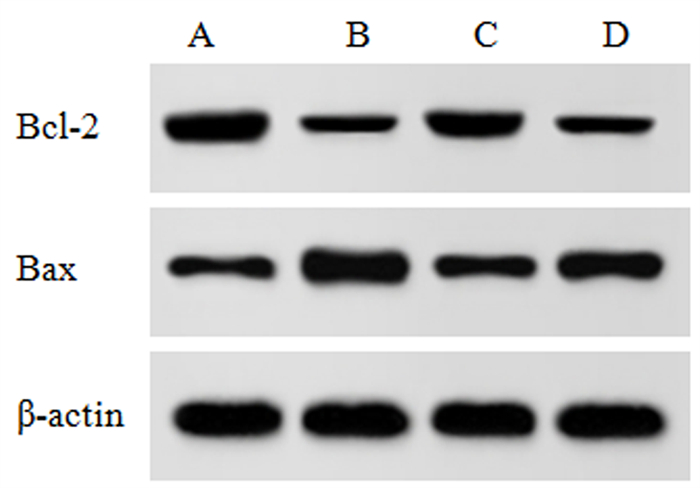 |
| A:对照组;B:HG组;C:黄柏碱组;D:Compound C组。 图 4 各组细胞Bcl-2和Bax蛋白表达Western blot检测 |
| 表 1 各组细胞凋亡率及凋亡蛋白表达比较(n=6,x±s) |
|
|
本文4组细胞自噬蛋白Beclin-1、LC3-Ⅱ/LC3-Ⅰ水平比较,差异均有统计学意义(F=48.125、48.467,P<0.001)。与A组相比,B组自噬体数量减少,Beclin-1、LC3-Ⅱ/LC3-Ⅰ水平显著降低(P<0.05);与B组相比,C组自噬体数量增加,Beclin-1、LC3-Ⅱ/LC3-Ⅰ水平显著升高(P<0.05);与C组相比,D组自噬体数量减少,Beclin-1、LC3-Ⅱ/LC3-Ⅰ水平显著降低(P<0.05)。见图 5、6和表 2。
 |
| A:对照组;B:HG组:C:黄柏碱组;D:Compound C组。透射电镜,放大10 000倍。 图 5 各组细胞超微结构电镜观察 |
 |
| A:对照组;B:HG组;C:黄柏碱组;D:Compound C组。 图 6 各组细胞自噬蛋白表达的Western blot检测 |
| 表 2 各组细胞自噬蛋白表达比较(n=6,x±s) |
|
|
本文4组细胞ROS、MDA、SOD水平比较,差异均有统计学意义(F=101.650~106.693,P<0.001)。与A组相比,B组细胞ROS、MDA水平显著升高,SOD水平显著降低(P<0.05);与B组相比,C组ROS、MDA水平显著降低,SOD水平显著升高(P<0.05);与C组相比,D组ROS、MDA水平显著升高,SOD水平显著降低(P<0.05)。见图 7、表 3。
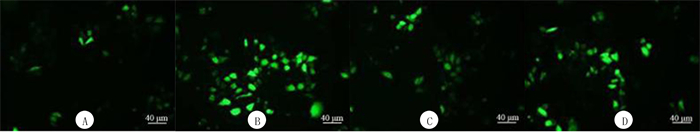 |
| A:对照组;B:HG组;C:黄柏碱组;D:Compound C组。 图 7 各组细胞ROS水平检测 |
| 表 3 各组细胞氧化应激指标比较(n=6,x±s) |
|
|
本文4组细胞的p-mTOR/mTOR、p-AMPK/AMPK水平比较,差异均具有统计学意义(F=33.882、30.857,P < 0.001)。与A组相比,B组细胞p-mTOR/mTOR显著升高,p-AMPK/AMPK显著降低(P < 0.05);与B组相比,C组细胞p-mTOR/mTOR显著降低,p-AMPK/AMPK显著升高(P < 0.05);与C组相比,D组细胞p-mTOR/mTOR显著升高,p-AMPK/AMPK显著降低(P < 0.05)。见图 8、表 4。
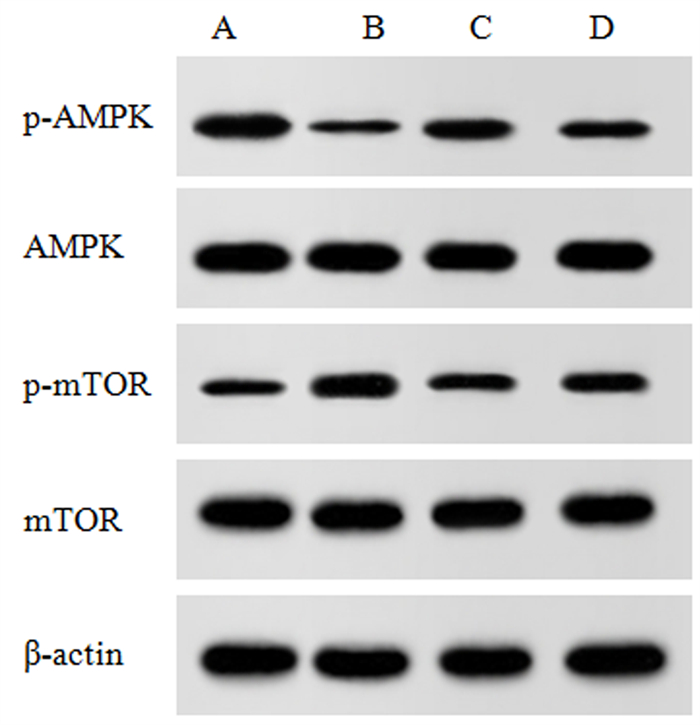 |
| A:对照组;B:HG组;C:黄柏碱组;D:Compound C组。 图 8 各组细胞AMPK/mTOR信号通路相关蛋白表达的Wes-tern blot检测 |
| 表 4 各组细胞AMPK/mTOR通路相关蛋白表达比较(n=6,x±s) |
|
|
LEC是晶状体代谢中最活跃的成分,可以产生晶状体纤维,维持整个晶状体的新陈代谢和透明度[18-19]。HG环境可通过改变晶状体渗透压引起LEC氧化应激失调和自噬,导致细胞凋亡和白内障[20-22]。因此,探讨HG诱导LEC损伤的机制对DC的预防和治疗具有重要意义。本研究以人LEC的HLEB3细胞系作为研究对象,结果显示,HG诱导的细胞活力和自噬水平显著下降,凋亡率和凋亡蛋白增加,并发生氧化应激。提示HG环境导致LEC氧化损伤、细胞凋亡和自噬抑制,从而导致白内障的形成。自噬对于维持细胞、组织和器官的稳态至关重要,包括在眼睛的角膜、视网膜和晶状体中发挥重要作用[23-24]。其中,LEC和纤维细胞中自噬通量受损可能导致先天性白内障、年龄相关性白内障和DC的形成[25-27]。LC3-Ⅱ蛋白是在自噬体形成过程中通过可溶性LC3-Ⅰ与脂质成分结合产生的,LC3-Ⅱ/Ⅰ比值是早期自噬活性的指标;Beclin-1是Ⅲ类磷酸肌醇3激酶复合物的组成成分,是自噬的主要调节因子[28-29]。在HG条件下,LEC自噬的表达受到抑制。本研究结果显示,HG组细胞自噬体数量减少,Beclin-1、LC3-Ⅱ/LC3-Ⅰ水平显著降低,提示HG可抑制LEC自噬。
HG可诱导氧化应激并降低LEC的抗氧化能力,导致DC形成[30-32]。其中,HG导致氧化还原失衡,产生过量的ROS,造成生物膜脂质氧化产生MDA;SOD属于抗氧化酶,可减轻细胞损伤[33-34]。此外,细胞的增殖和凋亡受自噬的影响。在应激条件下,自噬可以通过维持细胞稳态来防止细胞凋亡;在HG条件下,自噬的减少和氧化应激的发生均会引起LEC损伤和细胞凋亡[35]。Bax和Bcl-2是调节细胞凋亡的蛋白,其中Bax降低和Bcl-2升高表明细胞对凋亡的抵抗力增强[36]。本研究结果显示,HG组的细胞ROS、MDA水平以及凋亡率、Bax蛋白显著升高,而SOD和Bcl-2表达显著降低,提示HG可促进细胞凋亡和氧化应激的发生,从而引起白内障的发生。黄柏碱已被证实具有抗炎、抗氧化、抗凋亡、抗糖尿病等活性。研究显示,黄柏碱可通过抑制氧化应激和凋亡,改善脂多糖诱导的肾小管上皮细胞损伤[37]。此外,黄柏碱调节钙信号通路、cGMP-PKG信号通路和cAMP信号通路是其治疗糖尿病的核心机制[10]。本研究结果显示,5 mg/L黄柏碱可增加HG环境下LEC的活力,增加自噬体数量和Beclin-1、LC3-Ⅱ/LC3-Ⅰ、Bcl-2水平,降低凋亡率以及ROS、MDA、Bax水平,提示黄柏碱可能通过抑制细胞凋亡和氧化应激促进自噬,减少白内障的形成。
AMPK在调节葡萄糖、脂质、氨基酸代谢和内分泌等生理活动中发挥重要作用[38-40]。AMPK活性在糖尿病相关疾病中受到抑制,例如,WANG等[41]研究发现,糖尿病心肌病小鼠的AMPK活性和自噬水平均下降。mTOR是AMPK的关键下游靶标,AMPK磷酸化增加可降低mTOR水平,促进下游自噬信号蛋白的表达[42]。相关研究结果表明,调节AMPK-mTOR途径可通过促进自噬改善糖尿病引起的视网膜损伤和细胞凋亡,也可通过促进糖尿病小鼠足细胞自噬而减少细胞凋亡[43-44]。此外,AMPK/mTOR信号通路失调和自噬活性与白内障形成有关。既往有研究结果显示,通过促进AMPK活化和自噬通量恢复可以减轻氧化应激诱导的人LEC衰老[45];AMPK诱导的自噬在病人的LEC中下调[46]。本文研究结果显示,HG环境下LEC p-mTOR/mTOR水平显著升高,p-AMPK/AMPK水平降低,提示HG可能通过抑制AMPK活性、促进mTOR活化和抑制自噬参与白内障的形成。此外,黄柏碱可能通过激活AMPK/mTOR信号通路来促进自噬,改善溃疡性结肠炎[10]。本文研究结果显示,黄柏碱干预后,p-mTOR/mTOR水平显著降低,p-AMPK/AMPK水平升高,且AMPK抑制剂Compound C可逆转黄柏碱对HLEB3细胞自噬和凋亡的改善作用。推测黄柏碱可能通过AMPK/mTOR信号通路参与对HG诱导的LEC自噬和凋亡的调节。
综上所述,黄柏碱可减轻HG诱导的LEC氧化应激和细胞凋亡,促进细胞自噬,其作用机制可能与调节AMPK/mTOR信号通路有关。本研究为治疗DC中LEC自噬和凋亡提供了一种新方法,但其作用机制有待进一步研究。
| [1] |
XIE Q, XUE L D, CAO X, et al. Apoptosis of lens epithelial cells and expression of NLRP3-related proteins in patients with diabetes and cataract[J]. Ocular Immunology and Inflammation, 2023, 31(5): 1103-1110. DOI:10.1080/09273948.2022.2079537 |
| [2] |
ALABDULWAHHAB K M. Senile cataract in patients with diabetes with and without diabetic retinopathy: a community-based comparative study[J]. Journal of Epidemiology and Global Health, 2022, 12(1): 56-63. DOI:10.1007/s44197-021-00020-6 |
| [3] |
李娜, 黄海, 杨宇. 糖尿病性白内障患者2种眼科手术方法的临床疗效比较[J]. 实用临床医药杂志, 2023, 27(13): 111-113, 118. |
| [4] |
FU J M, HU X J. Simvastatin alleviates epithelial-mesenchymal transition and oxidative stress of high glucose-induced lens epithelial cells in vitro by inhibiting RhoA/ROCK signaling[J]. Experimental and Therapeutic Medicine, 2022, 23(6): 420. DOI:10.3892/etm.2022.11347 |
| [5] |
LIU G M, SHAO M T, LIU Y. Dichloroacetate ameliorates apoptosis, EMT and oxidative stress in diabetic cataract via inhibiting the IDO1-dependent p38 MAPK pathway[J]. Molecular and Cellular Endocrinology, 2024, 586: 112174. DOI:10.1016/j.mce.2024.112174 |
| [6] |
牛艳桃, 张丽, 谢文芳. MiR-155在过氧化氢诱导晶状体上皮细胞氧化应激损伤中的作用及靶向SIRT1调控机制[J]. 中华实验眼科杂志, 2022, 8(5): 404-413. |
| [7] |
LIU X M, ZHAO X W, CHENG R, et al. Autophagy attenuates high glucose-induced oxidative injury to lens epithelial cells[J]. Bioscience Reports, 2020, 40(4): BSR20193006. DOI:10.1042/BSR20193006 |
| [8] |
HU J H, LIU J X, CHEN S L, et al. Thioredoxin-1 regulates the autophagy induced by oxidative stress through LC3-Ⅱ in human lens epithelial cells[J]. Clinical and Experimental Pharmacology and Physiology, 2023, 50(6): 476-485. DOI:10.1111/1440-1681.13764 |
| [9] |
PATEL K, PATEL D K. Biological importance of phellodendrine in traditional and modern medicines: an update on therapeutic potential in medicine[J]. Current Drug Research Reviews, 2023. |
| [10] |
ZHANG F X, YUAN Y L L, CUI S S, et al. Characterization of metabolic fate of phellodendrine and its potential pharmacological mechanism against diabetes mellitus by ultra-high-performance liquid chromatography-coupled time-of-flight mass spectrometry and network pharmacology[J]. Rapid Communications in Mass Spectrometry: RCM, 2021, 35(18): e9157. DOI:10.1002/rcm.9157 |
| [11] |
ZHANG X Y, ZHANG L, CHEN Z, et al. Exogenous spermine attenuates diabetic kidney injury in rats by inhibiting AMPK/mTOR signaling pathway[J]. International Journal of Molecular Medicine, 2021, 47(3): 27. DOI:10.3892/ijmm.2021.4860 |
| [12] |
LI J N, SUN Q H, QIU X Z, et al. Downregulation of AMPK dependent FOXO3 and TFEB involves in the inhibition of autophagy in diabetic cataract[J]. Current Eye Research, 2022, 47(4): 555-564. DOI:10.1080/02713683.2021.2009516 |
| [13] |
潘勇娜, 常月锋, 郭璟静, 等. 雷公藤甲素调节AMPK/mTOR信号通路对葡萄糖干预的结肠癌细胞自噬和凋亡的影响[J]. 现代消化及介入诊疗, 2023, 28(1): 57-62. |
| [14] |
SU S, WANG X, XI X N, et al. Phellodendrine promotes autophagy by regulating the AMPK/mTOR pathway and treats ulcerative colitis[J]. Journal of Cellular and Molecular Medicine, 2021, 25(12): 5707-5720. DOI:10.1111/jcmm.16587 |
| [15] |
潘一鸣, 李蕊白, 黄子明, 等. 丹参酮Ⅱa通过AMPK/mTOR通路调节自噬促进急性白血病细胞凋亡作用机制研究[J]. 中国中医急症, 2021, 30(3): 415-418. |
| [16] |
GUO H R, OUYANG Y J, YIN H, et al. Induction of autophagy via the ROS-dependent AMPK-mTOR pathway protects copper-induced spermatogenesis disorder[J]. Redox Biology, 2022, 49: 102227. DOI:10.1016/j.redox.2021.102227 |
| [17] |
MEI R H, LOU P, YOU G C, et al. 17β-estradiol induces mitophagy upregulation to protect chondrocytes via the SIRT1-mediated AMPK/mTOR signaling pathway[J]. Frontiers in Endocrinology, 2020, 11: 615250. |
| [18] |
任若昕, 管怀进, 季敏. 晶状体上皮细胞葡萄糖代谢的研究进展[J]. 眼科新进展, 2023, 43(5): 412-416. |
| [19] |
刘亚军, 赵英迪, 张文文, 等. 吲哚菁绿对人晶状体上皮细胞生物学行为和转分化的抑制作用及其机制[J]. 中华实验眼科杂志, 2023, 41(12): 1160-1168. |
| [20] |
GREENBERG M J, BAMBA S. Diabetic cataracts[J]. Disease-a-month: DM, 2021, 67(5): 101134. |
| [21] |
ZENG K, XI W Q, QIAO Y J, et al. Paeoniflorin inhibits epithelial mesenchymal transformation and oxidative damage of lens epithelial cells in diabetic cataract via sirtuin 1 upregulation[J]. Bioengineered, 2022, 13(3): 5903-5914. |
| [22] |
刘文兰, 王莉, 杨扬, 等. MicroRNA-23b-3p对高糖诱导的人晶状体上皮细胞自噬和凋亡的抑制作用及其机制[J]. 中华实验眼科杂志, 2022, 40(9): 804-812. |
| [23] |
SUN Y, XIONG L, WANG X R, et al. Autophagy inhibition attenuates TGF-β2-induced epithelial-mesenchymal transition in lens epithelial cells[J]. Life Sciences, 2021, 265: 118741. |
| [24] |
BRENNAN L, COSTELLO M J, HEJTMANCIK J F, et al. Autophagy requirements for eye lens differentiation and transparency[J]. Cells, 2023, 12(3): 475. |
| [25] |
MA J Y, YE W, YANG Y S, et al. The interaction between autophagy and the epithelial-mesenchymal transition mediated by NICD/ULK1 is involved in the formation of diabetic cataracts[J]. Molecular Medicine, 2022, 28(1): 116. |
| [26] |
刘玉梅兰, 杜珊珊, 邵敬芝, 等. 晚期糖基化终末产物受体(RAGE)在糖尿病性白内障和年龄相关性白内障患者前囊膜及人晶状体上皮细胞中的表达[J]. 眼科新进展, 2020, 40(11): 1015-1019. |
| [27] |
李宁, 卜京丽, 李娟. 年龄相关性白内障晶状体上皮细胞中P53及SIRT1的表达及临床意义[J]. 淮海医药, 2022, 40(1): 5-8. |
| [28] |
CHEN P Z, YAO Z Y, HE Z H. Resveratrol protects against high glucose-induced oxidative damage in human lens epithelial cells by activating autophagy[J]. Experimental and Therapeutic Medicine, 2021, 21(5): 440. |
| [29] |
WEI S F, LIU X Y, HASAN K M F, et al. Extraction and purification of flavonoids from Buddleja officinalis maxim and their attenuation of H2O2-induced cell injury by modulating oxidative stress and autophagy[J]. Molecules, 2022, 27(24): 8985. |
| [30] |
陈晓娟, 曹鑫, 薛理丹, 等. 高迁移率族蛋白B1对高糖诱导的晶状体上皮细胞凋亡和自噬的影响[J]. 眼科新进展, 2023, 9(1): 13-18. |
| [31] |
牟琳, 刘苹, 李来, 等. MiR-29b通过靶向调节特异性蛋白1调控糖尿病性白内障晶状体上皮细胞间质转化的作用[J]. 眼科新进展, 2021, 7(12): 1116-1121. |
| [32] |
周米露, 赵锐, 王大庆, 等. 基于PI3K/AKT信号通路探讨Netrin-1对糖尿病性白内障大鼠晶状体上皮细胞的保护作用[J]. 解剖学研究, 2021, 43(6): 577-583. |
| [33] |
BAI J, JIANG G G, ZHAO M D, et al. Ghrelin mitigates high-glucose-induced oxidative damage and apoptosis in lens epithelial cells[J]. Journal of Diabetes Research, 2022, 2022: 1373533. |
| [34] |
GUO M, SU F F, CHEN Y, et al. Methyltransferase METTL3-mediated maturation of miR-4654 facilitates high glucose-induced apoptosis and oxidative stress in lens epithelial cells via decreasing SOD2[J]. Chemical Biology & Drug Design, 2024, 103(2): e14491. |
| [35] |
CHEN L H, CHEN Y Z, DING W, et al. Oxidative stress-induced TRPV2 expression increase is involved in diabetic cataracts and apoptosis of lens epithelial cells in a high-glucose environment[J]. Cells, 2022, 11(7): 1196. |
| [36] |
TIAN F, ZHAO J Z, BU S C, et al. KLF6 induces apoptosis in human lens epithelial cells through the ATF4-ATF3-CHOP axis[J]. Drug Design, Development and Therapy, 2020, 14: 1041-1055. |
| [37] |
杜威, 王栗莉, 李曼. 黄柏碱通过调控Semaphorin 3A抑制脂多糖诱导的肾小管上皮细胞氧化应激和凋亡[J]. 中国中西医结合肾病杂志, 2022, 23(7): 613-616. |
| [38] |
GE Y C, ZHOU M, CHEN C, et al. Role of AMPK mediated pathways in autophagy and aging[J]. Biochimie, 2022, 195: 100-113. |
| [39] |
魏姣姣, 刘师伟, 段瑞雪, 等. Vaspin通过AMPK/mTOR自噬信号通路影响2型糖尿病大鼠胰岛β细胞功能[J]. 协和医学杂志, 2023, 14(3): 543-552. |
| [40] |
刘汝霏, 吴萌, 尚杰. 单磷酸腺苷活化蛋白激酶通过调控能量代谢对肿瘤发挥双重作用的研究进展[J]. 中华肿瘤防治杂志, 2023, 30(17): 1069-1078. |
| [41] |
WANG H C, WANG L J, HU F L, et al. Neuregulin-4 attenuates diabetic cardiomyopathy by regulating autophagy via the AMPK/mTOR signalling pathway[J]. Cardiovascular Diabetology, 2022, 21(1): 205. |
| [42] |
KIM Y S, PARK B S, BAEK H S, et al. Metformin activates AMPK and mTOR to Inhibit RANKL-stimulated osteoclast formation[J]. European Review for Medical and Pharmacological Sciences, 2023, 27(18): 8795-8811. |
| [43] |
ZHANG X X, JI Y L, ZHU L P, et al. Arjunolic acid from Cyclocarya paliurus ameliorates diabetic retinopathy through AMPK/mTOR/HO-1 regulated autophagy pathway[J]. Journal of Ethnopharmacology, 2022, 284: 114772. |
| [44] |
SHENG H Q, ZHANG D, ZHANG J Q, et al. Kaempferol attenuated diabetic nephropathy by reducing apoptosis and promoting autophagy through AMPK/mTOR pathways[J]. Frontiers in Medicine, 2022, 9: 986825. |
| [45] |
CHEN M M, ZHANG C M, ZHOU N, et al. Metformin alleviates oxidative stress-induced senescence of human lens epithelial cells via AMPK activation and autophagic flux restoration[J]. Journal of Cellular and Molecular Medicine, 2021, 25(17): 8376-8389. |
| [46] |
鄢秀, 师朗, 陈景, 等. 小檗碱通过腺苷酸活化蛋白激酶、过氧化物酶体增殖物激活受体γ共激活因子-1α调节自噬减轻高糖环境下足细胞损伤的机制研究[J]. 中国糖尿病杂志, 2021, 29(7): 528-534. |
 2024, Vol. 60
2024, Vol. 60

