2. 青岛大学附属医院重症医学科
急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)是指肺泡上皮及肺毛细血管内皮弥漫性水肿损伤的危急重症[1-2]。ALI/ARDS预后较差[3],脓毒症是导致ALI/ARDS的常见原因,革兰阴性杆菌中脂多糖(LPS)是导致感染的主要成分[4]。肺泡上皮细胞是ALI发生的靶细胞[5],上皮细胞可以内吞LPS从而激活炎症[6]。因此,研究LPS诱导的肺部上皮细胞损伤的再生修复是ALI/ARDS早期治疗的新思路[7]。骨髓间充质干细胞(BMSC)可能通过多种机制促进肺损伤修复[8-10]。BMSC表达血清淀粉样蛋白A1(SAA1)可以改善LPS诱导的肺损伤,分泌角质细胞生长因子(KGF)[11-12],降低内毒素、炎症因子水平[13-14]。晚期糖基化终末产物受体(RAGE)具有多种配体,应用阻断细胞表面RAGE的抗RAGE单抗或可溶性RAGE均有修复ALI/ARDS肺损伤的作用[15-16]。但目前BMSC旁分泌KGF对RAGE的调节,以及对ALI/ARDS肺上皮细胞的保护作用尚未明确,本文对此进行了实验研究,以期为ALI/ARDS治疗提供新思路。现将结果报告如下。
1 材料与方法 1.1 实验材料 1.1.1 实验细胞小鼠肺上皮细胞MLE12和小鼠骨髓间充质干细胞(mBMSC)均购自美国模式培养物集存库(ATCC)。本研究经青岛大学医学院实验伦理委员会批准。
1.1.2 主要试剂DMEM培养液、胎牛血清、DMEM/F12 1∶1培养液、双抗(链霉素及青霉素溶液)和胰蛋白酶购自美国GIBCO BRL公司;LPS购自美国Sigma-Aldrich公司;小鼠角质细胞生长因子-7(KGF7)酶联免疫试剂盒、小鼠默克可酶联免疫试剂盒购自中国Elabscience公司;抗小鼠RAGE多克隆抗体购自美国R&D Systems公司;小鼠KGF购自以色列ProSpec公司;RAGE抗体、闭锁小带蛋白-1(ZO-1)抗体购自英国Abcam公司。MSC培养液是含体积分数0.10胎牛血清和体积分数0.01双抗的DMEM/F12 1∶1培养液;MLE12培养液是含体积分数0.02胎牛血清和体积分数0.01双抗的DMEM/F12 1∶1培养液。
1.2 实验方法 1.2.1 LPS诱导MLE12细胞损伤模型构建应用胰蛋白酶消化MLE12细胞,调整细胞密度为1×107/L,然后向培养液中加入100 μg/L的LPS构建MLE12细胞损伤模型[17],观察MLE12细胞的形态、生长情况及存活率。
1.2.2 mBMSC与MLE12细胞体外间接共培养实验模型构建分别将mBMSC细胞、MLE12细胞消化,并用不含血清的DMEM培养液重悬,调整两种细胞密度均为1×107/L。将1.5 mL的mBMSC细胞悬液,接种在六孔板每孔底部的载玻片上,将六孔板放入37 ℃的CO2培养箱中孵育待细胞贴壁。然后在六孔板每孔中放入直径24 mm、孔径0.4 μm的Transwell小室,将1 mL MLE12细胞悬液接种在Transwell小室中与mBMSC细胞共培养。将六孔板放入37 ℃的CO2培养箱中孵育待细胞贴壁,然后加入LPS(100 μg/L)或等量的生理盐水干预1 d或7 d。观察细胞的形态、生长情况及存活率。
1.2.3 实验分组实验共分6组。control组:MLE12细胞单独培养,加入等量生理盐水;LPS组:MLE12细胞加入LPS(100 μg/L)孵育;MSC-control组:MLE12细胞与MSC间接共培养,加入等量生理盐水;MSC-LPS组:MLE12细胞与MSC间接共培养,加入LPS(100 μg/L)孵育;KGF组:MLE12细胞加入LPS(100 μg/L)孵育,同时加入KGF(10 μg/L);anti-RAGE组:MLE12细胞与MSC共培养,加入LPS(100 μg/L)孵育,同时加入抗RAGE抗体(10 mg/L)。
1.2.4 酶联免疫吸附试验(ELISA)和蛋白质印迹(Western blot)法检测蛋白表达水平各组细胞接种在六孔板中,培养1、7 d后收集不同时间点的培养液,使用酶标仪(Bio-Rad,美国),采用ELISA法测定各组细胞条件培养液中KGF及RAGE蛋白含量;收集各组以及小室下层的MLE12细胞,采用Western blot法测定MLE12细胞表面的RAGE(一抗1/1 000,acbam,批号ab216329)及ZO-1(一抗1/1 000,acbam,批号ab276131)蛋白含量,二抗均为山羊抗兔IgG(1/2 000,acbam,ab6721)。
1.3 统计分析采用SPSS 17.0统计学软件进行统计分析。计量资料以x±s表示,多组均数的比较采用单因素方差分析,组间两两比较采用Bonferroni法,每组内7 d与1 d结果比较采用配对t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 BMSC对LPS损伤上皮细胞ZO-1蛋白表达的影响单因素方差分析结果显示,1 d时6组ZO-1的表达差异有统计学意义(F=172.40,P < 0.001),两两比较结果显示,除control组与MSC-control组、MSC-LPS组比较差异无统计学意义(P>0.05)外,其余两两比较差异均有统计学意义(P < 0.05)。7 d时6组ZO-1的表达比较差异有统计学意义(F=146.80,P < 0.001),两两比较结果显示,除control组与LPS组、MSC-control组与MSC-LPS组比较差异无统计学意义(P>0.05)外,其余两两比较差异均有统计学意义(P < 0.05)。除anti-RAGE组下降外(t=9.34,P < 0.05),7 d时其余各组ZO-1表达均较1 d时升高(t=14.91~67.40,P < 0.05)。见图 1。
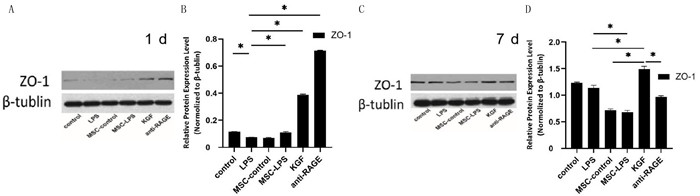 |
| A、B:1 d时ZO-1水平Western blot检测结果;C、D:7 d时ZO-1水平Western blot检测结果。n=3,*P < 0.05。 图 1 BMSC对LPS损伤MLE12细胞ZO-1表达的影响 |
单因素方差分析结果显示,1 d时6组的KGF表达差异有统计学意义(F=45.51,P < 0.001),两两比较结果显示,除MSC-LPS组与control组、LPS组比较以及control组与LPS组比较差异无统计学意义(P>0.05)外,其余两两比较差异均有显著性(P < 0.05)。7 d时,6组的KGF表达差异有统计学意义(F=2 359.00,P < 0.001),任意两组间差异均有统计学意义(P < 0.05)。除control组外,7 d时其余各组KGF水平与1 d时比较差异均有统计学意义(t=14.87~73.25,P < 0.05),control组、MSC-LPS组7 d时的KGF水平较1 d时下降。见图 2。
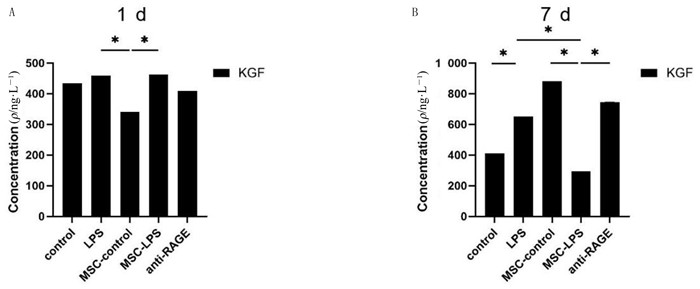 |
| A、B分别为1、7 d时各组KGF表达水平比较;n=3,*P < 0.05。 图 2 BMSC对LPS损伤MLE12细胞条件培养液中KGF表达的影响 |
单因素方差分析,1 d时6组的RAGE表达差异有统计学意义(F=49.90,P < 0.001),两两比较结果显示,除MSC-control组与KGF组比较差异无显著性(P>0.05)外,其余各组间比较差异均有显著性(P < 0.05)。7 d时6组的RAGE表达比较差异有显著性(F=275.60,P < 0.001),任意两组间的差异均有显著性(P < 0.05)。除anti-RAGE组外,其余各组7 d时RAGE水平均较1 d时升高(t=17.20~57.84,P < 0.05)。见图 3。
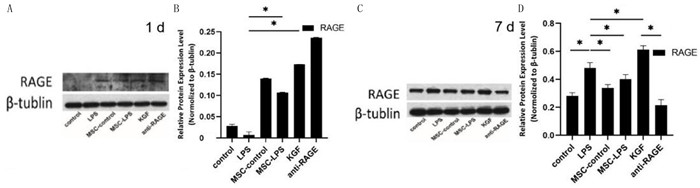 |
| A、B:1 d时RAGE水平Western blot检测结果;C、D:7 d时RAGE水平Western blot检测结果。n=3,*P < 0.05。 图 3 BMSC对LPS损伤MLE12细胞RAGE表达的影响 |
单因素方差分析显示,1 d时6组的RAGE表达差异有统计学意义(F=233.00,P < 0.001),两两比较结果显示,除control组与MSC-control组、MSC-LPS组与anti-RAGE组比较差异无统计学意义(P>0.05)外,其余各组间比较差异均有统计学意义(P < 0.05)。7 d时6组RAGE表达水平差异有统计学意义(F=228.20,P < 0.001),两两比较结果显示,除control组与MSC-LPS组、control组与KGF组、MSC-LPS组与KGF组比较差异无统计学意义(P>0.05)外,其余各组间比较差异均有统计学意义(P < 0.05)。除LPS组外,其余各组7 d时RAGE水平与1 d时比较差异均有统计学意义(t=11.02~27.08,P < 0.05),MSC-LPS组7 d时的RAGE水平较1 d时升高,其余各组RAGE水平均下降。见图 4。
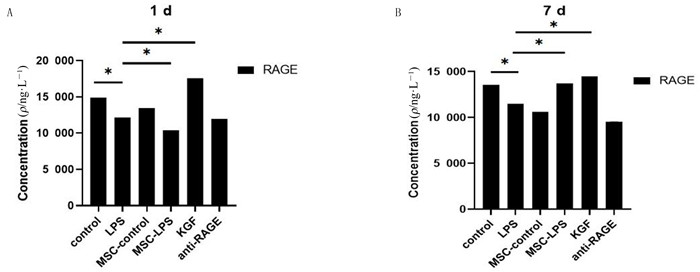 |
| A、B分别为1、7 d时各组RAGE水平的比较;n=3,*P < 0.05。 图 4 BMSC对LPS损伤MLE12细胞条件培养液中RAGE表达的影响 |
ALI/ARDS通过多种机制导致炎症反应失调,且肺泡上皮及肺毛细血管内皮弥漫性损伤,在重症监护危急重症病人中的发病率为10%,病死率为40%[18]。HUANG等[19]报道,轻度和重度ARDS病人的患病率为9.7%和47.4%。该病目前尚无有效治疗药物,创新ARDS的治疗方案迫在眉睫。维持肺泡上皮细胞的数量和功能,促进受损肺泡上皮细胞的有效修复是ARDS治疗的关键。其中,ALI/ARDS的毛细血管通透性改变主要是由于紧密连接的破坏,细胞紧密连接组成包括Claudin蛋白家族以及ZO-1。
WONG等[20]应用MSC治疗肺损伤模型动物,发现MSC可定向迁移至肺上皮损伤部位,转化为肺上皮细胞,参与损伤气道的修复。肺上皮屏障破坏与紧密连接关键蛋白的表达降低有关,其中ZO-1是构成细胞紧密连接的重要组成部分,ZO-1蛋白水平降低提示细胞通透性增加,紧密连接受损。本研究结果显示,MSC可以改善LPS诱导的损伤,提高ZO-1水平,在1 d时KGF、anti-RAGE对LPS损伤的肺上皮细胞有修复作用;7 d时,MSC对LPS诱导的MLE12细胞损伤有修复作用,可修复受损细胞ZO-1为主的紧密连接的细胞结构,在上皮细胞损伤后期MSC修复作用减弱,甚至有加重细胞损伤的风险,可能与修复相关的细胞因子分泌量不足、MSC恶性转化有关,MSC细胞与MLE12细胞之间的相互作用仍需要进一步探讨。KGF对LPS损伤的MLE12细胞具有更强的修复作用,anti-RAGE组ZO-1仅在1 d时具有显著表达差异,随着时间推移ZO-1表达平缓,推测抑制RAGE表达可能不是调节ZO-1的关键环节。
GALIACY等[21]证实,KGF通过多种机制参与细胞移植和损伤保护,对肺上皮修复有重要作用。GOOLAER等[22]研究发现,KGF可上调肺上皮细胞中钠通道的基因表达,从而增强Na+-K+-ATP酶活性,改善肺泡液体转运能力,改变受损肺泡上皮屏障的通透性从而修复受损细胞。本研究结果提示:MSC旁分泌KGF可能需要时间累积,可能与细胞种板密度、细胞之间的相互作用相关;anti-RAGE有利于分泌KGF从而发挥对肺上皮细胞的保护作用,而LPS刺激损伤肺上皮细胞的同时,随着时间增加可能也会影响MSC的旁分泌作用,从而降低KGF的分泌,对于MSC对KGF的调控存在正负调控,而其中anti-RAGE可促进KGF表达,可能参与肺保护作用;KGF可能参与LPS诱导的MLE12细胞损伤。SHAO等[23]发现,经KGF-2预处理后,油酸诱导的ALI大鼠中Claudin-5、ZO-1和血管内皮钙黏蛋白的表达增加,认为KGF-2可通过维持肺微血管内皮屏障来减轻油酸诱导的ALI[24],其作用机制与下调Wnt/β-catenin信号通路中Wnt5a、β-catenin和抗原呈递细胞表达有关[23]。但也有研究结果表明,KGF对肺泡上皮细胞屏障功能的保护作用是由于增加顶端周围的F-actin环,通过调节肌动蛋白骨架增强肺泡屏障功能,而在实验中没有观察到Claudin和ZO-1水平的显著改变。
RAGE是具有多种配体的受体,与不同配体结合,激活的细胞内信号转导途径也不同[15]。RAGE的膜结合形式是炎症、代谢功能障碍和血管损伤的关键媒介[25]。有研究表明,阻断RAGE可以改善ALI的炎症反应[26]。抑制RAGE通过直接抑制肺泡上皮细胞的自噬凋亡来缓解LPS诱导的肺损伤[27]。但同时,循环的可溶性形式的RAGE已被证明是一种诱饵受体,是RAGE的天然拮抗剂,可能对阻塞性气道疾病的发展具有保护作用[26]。ZHANG等[28]发现,重组小鼠可溶性RAGE表达增加,使RAGE信号传递受到抑制,减少炎症因子释放,从而降低肺通透性并减轻细胞凋亡水平,最终改善LPS诱导的小鼠ALI。本研究发现,LPS诱导MLE12细胞炎症后会导致RAGE表达减少,MSC具有更强的分泌RAGE的能力,KGF也会促进RAGE分泌,anti-RAGE需要7 d后才可以达到抑制RAGE表达的效果;LPS损伤肺上皮细胞会导致培养液中RAGE含量降低,MSC可以增高RAGE含量,可以逆转LPS诱导的炎症反应,其机制可能与旁分泌KGF有关。在心肌梗死大鼠模型中发现,MSC可以分泌可溶性晚期糖基化终末产物,可以减少心肌梗死面积以及改善心肌纤维化,MSC具有修复LPS诱导损伤的MLE12细胞的功能,是治疗心肌梗死的潜在疗法[29]。
综上所述,BMSC通过旁分泌产生KGF,能早期减轻ALI/ARDS时肺泡上皮细胞的进一步炎症损伤,促进上皮细胞增殖,减少上皮间质转分化,从而维持ALI/ARDS时肺泡上皮细胞的数量和功能,促进肺泡上皮的修复,上皮细胞的RAGE可能是该调节作用的关键分子。BMSC治疗ALI/ARDS的机制还有待进一步的研究来探讨。
| [1] |
MATTHAY M A, ZIMMERMAN G A, ESMON C, et al. Future research directions in acute lung injury: summary of a National Heart, Lung, and Blood Institute working group[J]. American Journal of Respiratory and Critical Care Medicine, 2003, 167(7): 1027-1035. DOI:10.1164/rccm.200208-966WS |
| [2] |
马晓春, 王辰, 方强, 等. 急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)[J]. 中国危重病急救医学, 2006(12): 706-710. |
| [3] |
CROSS L J, MATTHAY M A. Biomarkers in acute lung injury: insights into the pathogenesis of acute lung injury[J]. Critical Care Clinics, 2011, 27(2): 355-377. DOI:10.1016/j.ccc.2010.12.005 |
| [4] |
姜琴, 张文凯. 脂多糖致急性肺损伤机制研究进展及还原型谷胱甘肽保护作用[J]. 中华临床医师杂志(电子版), 2017, 11(4): 645-649. DOI:10.3877/cma.j.issn.1674-0785.2017.04.023 |
| [5] |
王慧敏, 蔡施霞, 周震, 等. lncRNA XIST靶向miR-150对LPS诱导的小鼠肺上皮MLE-12细胞凋亡和炎症因子分泌的影响[J]. 西安交通大学学报(医学版), 2021, 42(4): 522-528. |
| [6] |
SCHROEDER T H, LEE M M, YACONO P W, et al. CFTR is a pattern recognition molecule that extracts Pseudomonas aeruginosa LPS from the outer membrane into epithelial cells and activates NF-kappa B translocation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(10): 6907-6912. |
| [7] |
FRANK A J, THOMPSON B T. Pharmacological treatments for acute respiratory distress syndrome[J]. Current Opinion in Critical Care, 2010, 16(1): 62-68. DOI:10.1097/MCC.0b013e328334b151 |
| [8] |
SEGUIN A, BACCARI S, HOLDER-ESPINASSE M, et al. Tracheal regeneration: evidence of bone marrow mesenchymal stem cell involvement[J]. The Journal of Thoracic and Cardiovascular Surgery, 2013, 145(5): 1297-1304.e2. DOI:10.1016/j.jtcvs.2012.09.079 |
| [9] |
MATTHAY M A, THOMPSON B T, READ E J, et al. Therapeutic potential of mesenchymal stem cells for severe acute lung injury[J]. Chest, 2010, 138(4): 965-972. DOI:10.1378/chest.10-0518 |
| [10] |
LIU X, GAO C J, WANG Y, et al. BMSC-derived exosomes ameliorate LPS-induced acute lung injury by miR-384-5p-controlled alveolar macrophage autophagy[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 9973457. |
| [11] |
MOLDES M, ZUO Y, MORRISON R F, et al. Peroxisome-proliferator-activated receptor gamma suppresses Wnt/beta-catenin signalling during adipogenesis[J]. The Biochemical Journal, 2003, 376(Pt 3): 607-613. |
| [12] |
LI J W, HUANG S, WU Y, et al. Paracrine factors from mesenchymal stem cells: a proposed therapeutic tool for acute lung injury and acute respiratory distress syndrome[J]. International Wound Journal, 2014, 11(2): 114-121. DOI:10.1111/iwj.12202 |
| [13] |
LV Z, DUAN S X, ZHOU M, et al. Mouse bone marrow mesenchymal stem cells inhibit sepsis-induced lung injury in mice via exosomal SAA1[J]. Molecular Pharmaceutics, 2022, 19(11): 4254-4263. DOI:10.1021/acs.molpharmaceut.2c00542 |
| [14] |
XIU G H, SUN J, LI X L, et al. The role of HMGB1 in BMSC transplantation for treating MODS in rats[J]. Cell and Tissue Research, 2018, 373(2): 395-406. DOI:10.1007/s00441-018-2823-0 |
| [15] |
CREAGH-BROWN B C, QUINLAN G J, EVANS T W, et al. The RAGE axis in systemic inflammation, acute lung injury and myocardial dysfunction: an important therapeutic target?[J]. Intensive Care Medicine, 2010, 36(10): 1644-1656. DOI:10.1007/s00134-010-1952-z |
| [16] |
LUTZ W, STETKIEWICZ J. High mobility group box 1 protein as a late-acting mediator of acute lung inflammation[J]. International Journal of Occupational Medicine and Environmental Health, 2004, 17(2): 245-254. |
| [17] |
郎旭宇, 王选桐, 朱惠瑞, 等. 冬凌草甲素对脂多糖诱导小鼠肺泡上皮细胞炎症因子的抑制作用及其机制研究[J]. 中国药物与临床, 2021, 21(24): 3949-3953. |
| [18] |
BATTAGLINI D, FAZZINI B, SILVA P L, et al. Challenges in ARDS definition, management, and identification of effective personalized therapies[J]. Journal of Clinical Medicine, 2023, 12(4): 1381. DOI:10.3390/jcm12041381 |
| [19] |
HUANG X, ZHANG R Y, FAN G H, et al. Incidence and outcomes of acute respiratory distress syndrome in intensive care units of mainland China: a multicentre prospective longitudinal study[J]. Critical Care, 2020, 24(1): 515. DOI:10.1186/s13054-020-03112-0 |
| [20] |
WONG A P, DUTLY A E, SACHER A, et al. Targeted cell replacement with bone marrow cells for airway epithelial regeneration[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2007, 293(3): L740-L752. DOI:10.1152/ajplung.00050.2007 |
| [21] |
GALIACY S, PLANUS E, LEPETIT H, et al. Keratinocyte growth factor promotes cell motility during alveolar epithelial repair in vitro[J]. Experimental Cell Research, 2003, 283(2): 215-229. DOI:10.1016/S0014-4827(02)00049-6 |
| [22] |
GOOLAERTS A, PELLAN-RANDRIANARISON N, LARGHERO J, et al. Conditioned media from mesenchymal stromal cells restore sodium transport and preserve epithelial permeability in an in vitro model of acute alveolar injury[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2014, 306(11): L975-L985. DOI:10.1152/ajplung.00242.2013 |
| [23] |
SHAO T H, CHEN N, WANG S H, et al. Keratinocyte growth factor-2 reduces inflammatory response to acute lung injury induced by oleic acid in rats by regulating key proteins of the Wnt/β-catenin signaling pathway[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2020, 2020: 8350579. |
| [24] |
TENGHAO S, SHENMAO M, ZHAOJUN W, et al. Keratinocyte growth factor-2 is protective in oleic acid-induced acute lung injury in rats[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2019, 2019: 9406580. |
| [25] |
HAIDER S H, OSKUEI A, CROWLEY G, et al. Receptor for advanced glycation end-products and environmental exposure related obstructive airways disease: a systematic review[J]. European Respiratory Review: an Official Journal of the European Respiratory Society, 2019, 28(151): 180096. DOI:10.1183/16000617.0096-2018 |
| [26] |
JOHNSON L L, TEKABE Y, ZELONINA T, et al. Blocking RAGE expression after injury reduces inflammation in mouse model of acute lung injury[J]. Respiratory Research, 2023, 24(1): 21. DOI:10.1186/s12931-023-02324-6 |
| [27] |
XIONG X, DOU J Y, SHI J Y, et al. RAGE inhibition alleviates lipopolysaccharides-induced lung injury via directly suppressing autophagic apoptosis of type Ⅱ alveolar epithelial cells[J]. Respiratory Research, 2023, 24(1): 24. DOI:10.1186/s12931-023-02332-6 |
| [28] |
ZHANG H Y, TASAKA S, SHIRAISHI Y, et al. Role of soluble receptor for advanced glycation end products on endotoxin-induced lung injury[J]. American Journal of Respiratory and Critical Care Medicine, 2008, 178(4): 356-362. DOI:10.1164/rccm.200707-1069OC |
| [29] |
BAYARSAIKHAN D, BAYARSAIKHAN G, LEE J, et al. A study on the protective effect of sRAGE-MSCs in a rodent reperfusion model of myocardial infarction[J]. International Journal of Molecular Sciences, 2021, 23(24): 15630. |
 2023, Vol. 59
2023, Vol. 59

