2. 青岛大学附属妇女儿童医院普外科,山东 青岛 266034
动脉粥样硬化(AS)是以脂质蓄积和炎症细胞浸润为主要特征的慢性炎症性过程,是冠心病、心肌梗死、脑卒中等众多心脑血管事件的病理基础[1-3]。AS发病机制复杂,与多种因素密切相关,其中内皮细胞功能障碍是AS发生发展的始动环节[4]。内皮细胞功能障碍有利于氧化低密度脂蛋白(ox-LDL)浸润至内皮下层,同时选择性招募单核细胞进入内皮下层转变为巨噬细胞,通过吞噬经理化修饰的脂蛋白形成泡沫细胞引发局部炎症反应,从而诱导AS的发生发展[3, 5]。铁死亡是近年发现的一种铁依赖的新型细胞死亡方式,其特征是铁依赖的活性氧(ROS)和脂质过氧化物的蓄积、谷胱甘肽(GSH)的耗竭以及谷胱甘肽过氧化物酶4(GPX4)的失活等[1-2]。多项研究结果表明,铁死亡是内皮细胞功能障碍的重要原因,在推动AS进展中发挥了重要作用[3-4]。白藜芦醇为一种天然植物多酚,主要存在于葡萄、花生、虎杖、大豆等多种植物中,具有抗炎、抗肿瘤、抗病毒、延缓衰老等功效[6-7]。近年来研究发现,白藜芦醇可通过调节血脂水平、抗血小板聚集、抗炎、抑制低密度脂蛋白氧化修饰、抑制斑块内新生血管等作用发挥抗AS作用[8-10]。但有关白藜芦醇对血管内皮细胞铁死亡的影响尚未见报道。因此,本研究利用铁死亡诱导剂ox-LDL建立人脐静脉内皮细胞(HUVECs)铁死亡模型,探讨白藜芦醇对血管内皮细胞铁死亡的影响及机制,从而为明确中医药治疗AS疾病作用机制提供新的科学依据。
1 材料与方法 1.1 主要材料HUVECs购自武汉普诺赛生命科技有限公司;内皮细胞培养液购自美国Sciencell公司;ox-LDL购自美国默克公司;白藜芦醇,分子式为C14H12O3,分子量228.24,纯度99.94%,购自美国MedChemExpress公司;ROS检测试剂盒购自中国白鲨生物有限公司;亚铁离子(Fe2+)检测试剂盒购自中国赛默飞世尔公司;GSH及丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;CCK-8溶液购自武汉Proteintech公司;兔抗GPX4以及鼠抗β-肌动蛋白(β-actin)单克隆抗体购自英国Abcam公司;兔抗铁蛋白重链(FTH1)单克隆抗体购自Abmart公司;兔抗溶质载体家族7成员11(SLC7A11)单克隆抗体、山羊抗兔lgG-HRP及山羊抗鼠lgG-HRP二抗购自美国Proteintech公司。
1.2 实验方法 1.2.1 细胞培养及分组HUVECs置于37 ℃、含体积分数0.05 CO2培养箱中,用内皮细胞培养液培养。将正常的HUVECs随机分为对照组(A组)、ox-LDL组(B组)及白藜芦醇低、中、高剂量组(C、D、E组)。A组在正常生长条件下培养,B组加入含有100 mg/L ox-LDL的内皮细胞培养液培养24 h,C、D、E组分别用白藜芦醇5、10、20 μmol/L预处理4 h后,更换为含有100 mg/L ox-LDL的内皮细胞培养液培养24 h。
1.2.2 CCK-8法检测细胞存活率取对数生长期HUVECs,以每孔5 000个接种于96孔板中,待细胞贴壁、按照实验分组加入相应药物处理后,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h,应用酶标仪在450 nm波长下检测各孔的光密度(OD)值。然后计算细胞存活率,细胞存活率=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。每组设4个复孔,实验独立重复3次。
1.2.3 细胞中Fe2+、ROS、MDA和GSH含量检测将HUVECs按每孔2×105个接种于6孔板内,在37 ℃、含体积分数0.05 CO2培养箱中培养24 h后,按照实验分组加入相应药物进行处理。收集各组细胞,使用Fe2+、ROS、GSH、MDA检测试剂盒测定细胞内Fe2+、ROS、GSH、MDA含量,实验步骤严格按照说明书进行。每组设3个复孔,实验独立重复3次。
1.2.4 免疫印迹法检测细胞内GPX4、SLC7A11和FTH1蛋白表达将HUVECs接种于6孔板,按照实验分组加入相应药物处理。收集各组细胞并提取总蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳反应后,转膜、封闭,加入一抗(β-actin、GPX4、FTH1和SLC7A11,以1∶1 000抗体稀释液稀释)4 ℃孵育过夜,加入羊抗兔二抗(以1∶5 000抗体稀释液稀释)和羊抗鼠二抗(以1∶10 000抗体稀释液稀释)室温孵育1 h,洗去二抗,用ECL试剂盒显色,在凝胶成像仪上显影并拍照,用Image J软件分析条带灰度值。结果以目的蛋白与β-actin灰度值的比值表示。实验独立重复3次。
1.2.5 免疫荧光法检测细胞内GPX4、SLC7A11和FTH1表达将HUVECs按每孔2×103个接种于24孔板内,在37 ℃、含体积分数0.05 CO2培养箱中培养24 h后,按实验分组加入相应药物处理。用40 g/L多聚甲醛室温固定15 min,PBS浸洗,5 g/L Triton X-100透膜15 min,50 g/L BSA封闭1 h,去除封闭液,加入GPX4(应用1∶200抗体稀释液稀释)、SLC7A11(应用1∶200抗体稀释液稀释)以及FTH1(以1∶100抗体稀释液稀释)一抗4 ℃孵育过夜。用PBS洗净一抗后,加入荧光标记的羊抗兔二抗(以1∶200抗体稀释液稀释)室温避光孵育1 h。用PBS洗净二抗后,以DAPI染核10 min,用含抗荧光淬灭剂的封片液封片。荧光显微镜下观察并采集图像。应用Image J软件分析记录每张图片的平均荧光强度。实验独立重复3次。
1.3 统计学方法应用SPSS 26.0软件进行数据的统计分析,计量资料数据以x±s表示,多组比较采用单因素方差分析和SNK-q检验。以P<0.05为差异有统计学意义。
2 结果 2.1 ox-LDL和白藜芦醇对HUVECs存活率影响CCK-8实验结果显示,ox-LDL浓度为50、100、150、200 mg/L逐渐升高时,HUVECs存活率逐渐降低。当ox-LDL浓度为100 mg/L时,与对照相比,细胞存活率为54.30%,差异具有统计学意义(F=655.08,P<0.01)。因此,为保证有足够活力的细胞进行后续实验,本研究选择100 mg/L ox-LDL干预24 h作为诱导细胞铁死亡的条件。见图 1。与对照相比,5、10、20 μmol/L浓度的白藜芦醇对细胞存活率无明显影响(P>0.05),说明本实验中所用不同剂量的白藜芦醇对HUVECs无损伤作用。见图 2。
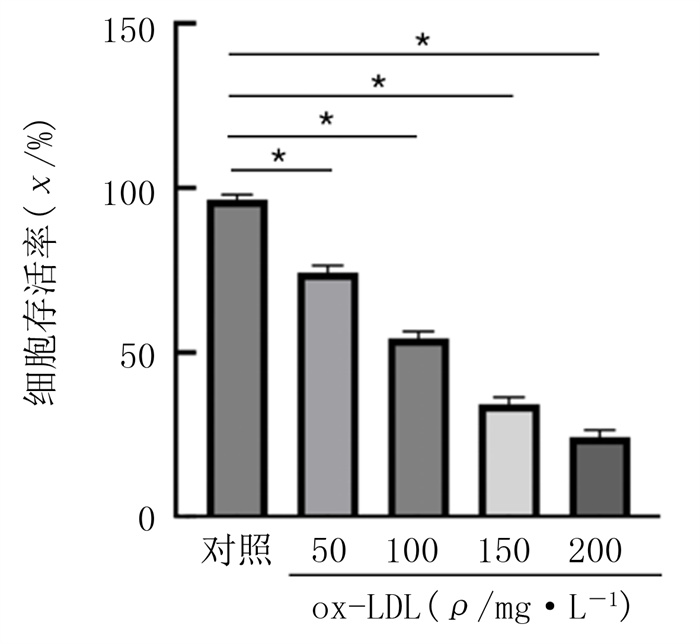 |
| 注:n=4,*P<0.01。 图 1 不同浓度ox-LDL对HUVECs存活率的影响 |
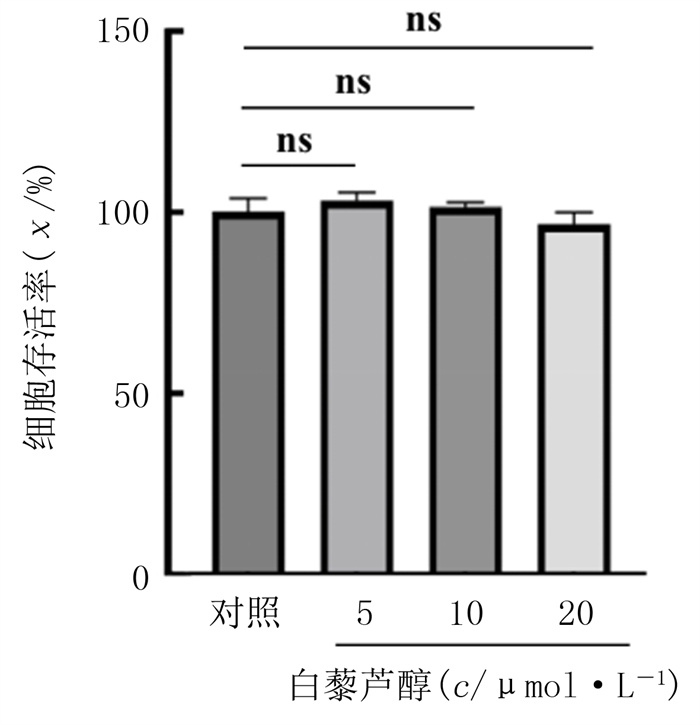 |
| 注:n=4,ns表示P>0.05。 图 2 不同浓度白藜芦醇对HUVECs存活率的影响 |
CCK-8实验结果显示,各组HUVECs存活率差异具有统计学意义(F=200.00,P<0.01)。B组细胞存活率较A组显著降低(P<0.01);而经低、中、高剂量白藜芦醇预处理可减轻ox-LDL诱导的HUVECs损伤,并呈剂量依赖性,与B组比较,C、D、E组细胞存活率显著升高,差异具有统计学意义(P<0.01)。见图 3。
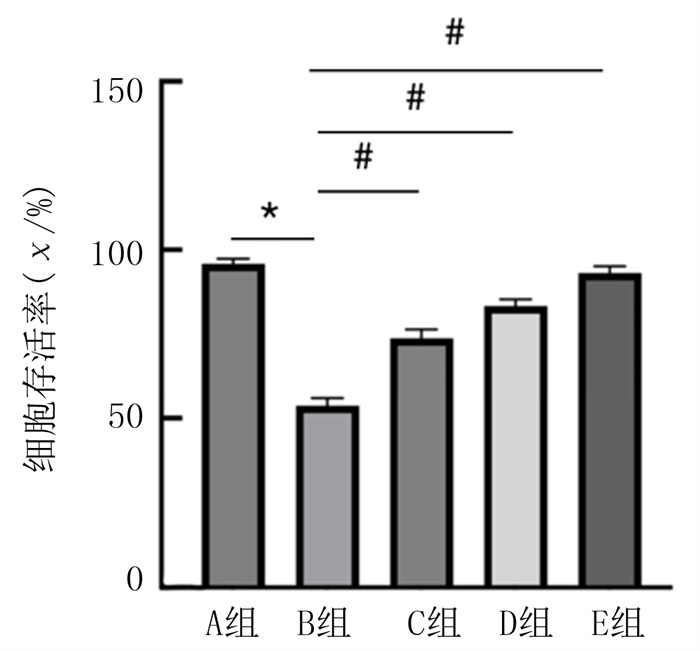 |
| 注:n=4;与A组相比,*P<0.01;与B组相比,#P<0.01。 图 3 各组HUVECs存活率的比较 |
各组HUVECs中ROS、MDA、GSH和Fe2+含量比较,差异均有统计学意义(F=30.26~415.07,P<0.05)。与A组相比,B组HUVECs中ROS、MDA和Fe2+含量显著增加,而GSH含量显著降低(P<0.05);与B组相比较,C、D、E组HUVECs中ROS、MDA和Fe2+含量显著降低,GSH含量显著升高(P<0.05)。见表 1。
| 表 1 各组HUVECs中GSH、MDA、Fe2+和ROS含量的比较(n=3,x±s) |
|
|
免疫印迹法检测结果显示,各组HUVECs中GPX4、FTH1和SLC7A11蛋白表达比较,差异均具有统计学意义(F=58.62~88.92,P<0.05)。与A组相比较,B组HUVECs中GPX4、FTH1以及SLC7A11蛋白的表达显著降低(P<0.05);与B组相比较,C、D、E组HUVECs中GPX4、FTH1和SLC7A11蛋白的表达显著增加(P<0.05)。见图 4和表 2。
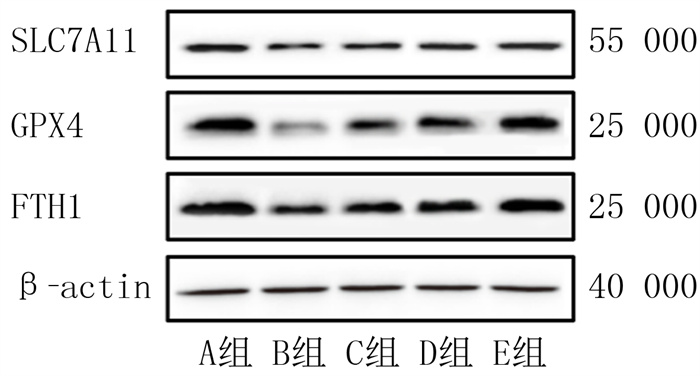 |
| 图 4 免疫印迹法检测各组细胞中GPX4、FTH1和SLC7A11蛋白表达 |
| 表 2 各组HUVECs中GPX4、FTH1和SLC7A11蛋白表达的比较(n=3,x±s) |
|
|
免疫荧光法检测结果显示,各组HUVECs中GPX4、FTH1和SLC7A11表达比较,差异均有统计学意义(F=62.18~722.16,P<0.05)。与A组相比,B组HUVECs中GPX4、FTH1和SLC7A11蛋白表达显著降低(P<0.05);与B组相比,E组HUVECs中GPX4、FTH1和SLC7A11表达显著增加(P<0.05)。见图 5和表 3。
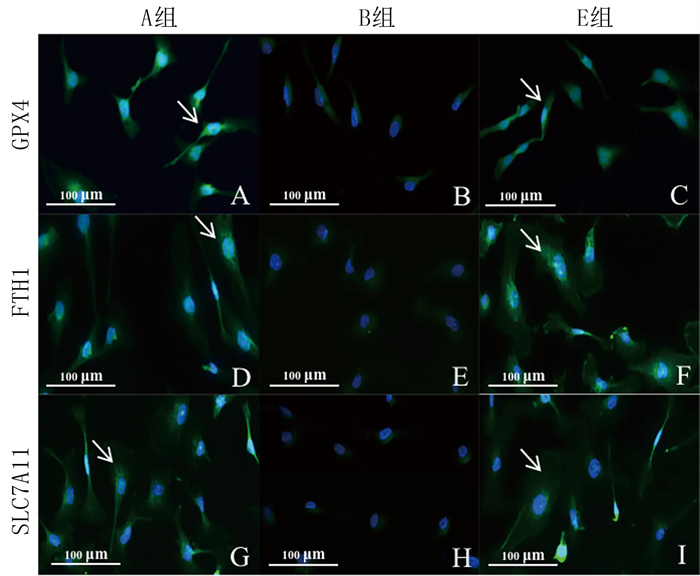 |
| A、B、C分别示A组、B组和E组GPX4的表达,绿色为GPX4染色,蓝色为DAPI荧光染色下的细胞核;D、E、F分别示A组、B组和E组FTH1的表达,绿色为FTH1染色,蓝色为DAPI荧光染色下的细胞核;G、H、I分别示A组、B组和E组SLC7A11的表达,绿色为SLC7A11染色,蓝色为DAPI荧光染色下的细胞核。白色箭头示目的蛋白表达区域。免疫荧光染色,100倍。 图 5 各组HUVECs中GPX4、FTH1和SLC7A11表达的免疫荧光检测 |
| 表 3 各组HUVECs中GPX4、FTH1和SLC7A11表达的比较(n=3,AU,x±s) |
|
|
随着社会老龄化加重及居民不健康生活方式增加,我国AS诱发的多种心血管疾病发病率、死亡率持续升高。AS发病机制复杂,主要与内皮细胞功能障碍、炎症反应、氧化应激、血栓形成及脂质浸润等密切相关[1-3]。目前逆转AS严重后果的疗法仍然有限。白藜芦醇作为多酚类植物化合物的代表,可以通过调节脂质代谢、抑制ROS生成、维持内皮功能稳定等来发挥抗AS作用。但白藜芦醇的具体作用机制至今尚未完全阐明。因此,本研究从铁死亡的角度来探讨白藜芦醇对AS的作用及其潜在机制。有研究表明,血管内皮细胞用ox-LDL处理后表现出铁死亡的特征,使用铁死亡抑制剂则明显逆转了细胞的死亡[11]。因此,本研究使用ox-LDL诱导HUVECs发生铁死亡。本文结果显示,ox-LDL处理后内皮细胞活力明显下降,出现铁死亡;经白藜芦醇(5、10、20 μmol/L)预处理可以降低细胞铁死亡,减少ROS和MDA产生,显著提高内皮细胞活力,且该效应随着白藜芦醇剂量增加而增强。这表明白藜芦醇对ox-LDL诱导的铁死亡有拮抗作用,从而可以延缓AS病程进展。
内皮细胞损伤是AS早期病理改变。有研究表明,铁死亡通过多种生理机制参与AS的内皮细胞损伤,如铁过载可以促进ROS产生并且激活局部肾素-血管紧张素系统,诱导血管内皮细胞中氧化应激水平升高,导致内皮损伤,增加AS斑块的不稳定性[12];铁死亡抑制剂通过减轻铁死亡引起的内皮细胞氧化损伤而发挥抗AS作用[3]。由此可见,铁死亡已成为调节内皮细胞功能的关键角色。
铁死亡是一种铁依赖的可调节的氧化性细胞死亡方式[13],在生物化学方面表现为细胞内抗氧化系统GSH/GPX4失活,过量的Fe2+通过芬顿反应产生大量的ROS,与细胞膜上的多不饱和脂肪酸发生氧化应激反应,导致脂质过氧化物积累,使MDA生成增多。本研究经ox-LDL处理的HUVECs中,Fe2+、ROS和MDA含量增加,FTH1和GSH水平下降;而白藜芦醇干预可降低细胞内Fe2+、ROS和MDA含量,提高FTH1和GSH的水平。MDA是ROS介导脂质过氧化生成的一种不饱和醛类物质,由于它与亲核化合物的反应性以及在没有活性的情况下,能使蛋白质和DNA发生反应,生成特殊的加合物而产生细胞毒性[14]。相关研究表明,MDA可以促进巨噬细胞产生炎症因子,从而加重血管周围的炎症反应并损伤血管内皮细胞,破坏内皮结构完整性并造成内皮功能障碍,促进AS的发生[15]。因此,MDA被认为是造成血管功能障碍的介质之一。GSH是体内的非酶抗氧化剂,可以作为硒依赖性GPX4的辅因子和底物来减少脂质过氧化物,在降低氧化应激水平中起着关键作用[16-19]。由此可见,白藜芦醇通过提高HUVECs抗氧化能力和降低MDA含量来减轻ox-LDL诱导产生的细胞损伤。铁蛋白为细胞提供了一种以氧化还原非活性形式锁住过量铁的手段,以防止铁介导的细胞和组织损伤。铁蛋白由铁蛋白轻链和FTH1构成,是一种储铁蛋白复合体,可调控储存的铁离子。FTH1在铁蛋白结构中起到关键作用,也是铁死亡发生的标志性蛋白,可催化Fe2+氧化发挥储铁功能进而减少细胞内Fe2+。FTH1水平降低导致体内Fe2+水平升高,过量的Fe2+会引起脂质代谢紊乱,导致ROS水平升高,促进铁死亡发生[18, 20]。本研究结果表明,白藜芦醇能够通过调节氧化应激清除过量的Fe2+,抑制铁死亡的发生。
GPX4作为细胞内唯一可直接降低磷脂过氧化的抗氧化酶,是铁死亡的重要调节因子[21]。GPX4以GSH为还原剂,催化过氧化物的过氧键转变为羟基,将过氧化物转变为类脂醇,使其失去氧化活性,进而抑制铁死亡[16, 22]。GSH和GXP4被认为是细胞发生铁死亡的标志物[23-24]。本研究结果显示,ox-LDL组HUVECs存活率降低,GSH含量降低,GPX4蛋白的表达下调;给予白藜芦醇预处理后,细胞存活率升高,GSH含量升高,GPX4蛋白表达上调,提示白藜芦醇可以减轻HUVECs铁死亡。
SLC7A11是胱氨酸/谷氨酸交换转运体(System Xc-)的底物特异性亚基,在抗氧化剂GSH的生物合成中起着核心作用。SLC7A11的活性被抑制会导致GSH合成减少,引发氧化损伤,最终导致铁死亡的发生。研究表明,System Xc-和GPX4的活性状态是调节铁死亡的关键机制[25]。有文献报道,高良姜素通过激活SLC7A11/GPX4轴抑制铁死亡,从而对脑缺血再灌注后沙鼠的海马神经元发挥保护作用;淫羊藿苷通过调节SLC7A11/GPX4信号通路抑制高糖诱导的小胶质细胞铁死亡;鹿红方通过SLC7A11/GPX4信号通路减轻心肌缺血再灌注损伤引起的心肌细胞铁死亡[26-33]。本研究结果显示,ox-LDL组HUVECs中,GPX4和SLC7A11蛋白的表达显著降低;而给予白藜芦醇预处理后,细胞中GPX4和SLC7A11蛋白的表达显著升高。由此推测,白藜芦醇可能通过激活SLC7A11/GPX4轴来对抗ox-LDL诱导的铁死亡。
综上所述,调控铁死亡可能为白藜芦醇治疗AS的重要机制,本研究结果为深入挖掘中医药治疗AS疾病作用机制提供了新思路。但本研究仅在细胞层面初步探讨了白藜芦醇对ox-LDL诱导铁死亡的可能作用机制,存在一定的局限性,后续将深入研究白藜芦醇调节铁死亡的直接机制和作用靶点。
| [1] |
MOU Y H, WANG J, WU J C, et al. Ferroptosis, a new form of cell death: opportunities and challenges in cancer[J]. Journal of Hematology & Oncology, 2019, 12(1): 34. |
| [2] |
YAN N, ZHANG J J. Iron metabolism, ferroptosis, and the links with Alzheimer's disease[J]. Frontiers in Neuroscience, 2020, 13: 1443. DOI:10.3389/fnins.2019.01443 |
| [3] |
BAI T, LI M X, LIU Y F, et al. Inhibition of ferroptosis alleviates atherosclerosis through attenuating lipid peroxidation and endothelial dysfunction in mouse aortic endothelial cell[J]. Free Radical Biology & Medicine, 2020, 160: 92-102. |
| [4] |
YANG K, SONG H J, YIN D L. PDSS2 inhibits the ferroptosis of vascular endothelial cells in atherosclerosis by activating Nrf2[J]. Journal of Cardiovascular Pharmacology, 2021, 77(6): 767-776. DOI:10.1097/FJC.0000000000001030 |
| [5] |
GIMBRONE M A Jr, GARCÍA-CARDEÑA G. Endothelial cell dysfunction and the pathobiology of atherosclerosis[J]. Circulation Research, 2016, 118(4): 620-636. DOI:10.1161/CIRCRESAHA.115.306301 |
| [6] |
MENG T T, XIAO D F, MUHAMMED A, et al. Anti-inflammatory action and mechanisms of resveratrol[J]. Molecules, 2021, 26(1): 229. DOI:10.3390/molecules26010229 |
| [7] |
BREUSS J M, ATANASOV A G, UHRIN P. Resveratrol and its effects on the vascular system[J]. International Journal of Molecular Sciences, 2019, 20(7): 1523. DOI:10.3390/ijms20071523 |
| [8] |
GUO S T, ZHOU Y, XIE X J. Resveratrol inhibiting TGF/ERK signaling pathway can improve atherosclerosis: backgrounds, mechanisms and effects[J]. Biomedicine & Pharmacotherapy, 2022, 155: 113775. |
| [9] |
ZHANG X H, JIANG L P, CHEN H B, et al. Resveratrol protected acrolein-induced ferroptosis and insulin secretion dysfunction via ER-stress-related PERK pathway in MIN6 cells[J]. Toxicology, 2022, 465: 153048. DOI:10.1016/j.tox.2021.153048 |
| [10] |
KHALIL A, BERROUGUI H. Mechanism of action of resveratrol in lipid metabolism and atherosclerosis[J]. Clinical Lipidology, 2009, 4(5): 527-531. DOI:10.2217/clp.09.53 |
| [11] |
WUNDERER F, TRAEGER L, SIGURSLID H H, et al. The role of hepcidin and iron homeostasis in atherosclerosis[J]. Pharmacological Research, 2020, 153: 104664. DOI:10.1016/j.phrs.2020.104664 |
| [12] |
MARQUES V B, NASCIMENTO T B, RIBEIRO R F Jr, et al. Chronic iron overload in rats increases vascular reactivity by increasing oxidative stress and reducing nitric oxide bioavai-lability[J]. Life Sciences, 2015, 143: 89-97. DOI:10.1016/j.lfs.2015.10.034 |
| [13] |
XIE Y, HOU W, SONG X, et al. Ferroptosis: process and function[J]. Cell Death & Differentiation, 2016, 23(3): 369-379. |
| [14] |
KILLER H E, LAENG H R, FLAMMER J, et al. Architecture of arachnoid trabeculae, Pillars, and septa in the su-barachnoid space of the human optic nerve: anatomy and clinical considerations[J]. The British Journal of Ophthalmology, 2003, 87(6): 777-781. DOI:10.1136/bjo.87.6.777 |
| [15] |
BÄUERLE J, SCHUCHARDT F, SCHROEDER L, et al. Reproducibility and accuracy of optic nerve sheath diameter assessment using ultrasound compared to magnetic resonance imaging[J]. BMC Neurology, 2013, 13: 187. DOI:10.1186/1471-2377-13-187 |
| [16] |
YANG W S, SRIRAMARATNAM R, WELSCH M E, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2): 317-331. DOI:10.1016/j.cell.2013.12.010 |
| [17] |
KOPPULA P, ZHANG Y L, ZHUANG L, et al. Amino acid transporter SLC7A11/xCT at the crossroads of regulating re-dox homeostasis and nutrient dependency of cancer[J]. Cancer Communications, 2018, 38(1): 12. |
| [18] |
ZHANG Y, XIN L Y, XIANG M, et al. The molecular me-chanisms of ferroptosis and its role in cardiovascular disease[J]. Biomedecine & Pharmacotherapie, 2022, 145: 112423. |
| [19] |
FENG H Z, STOCKWELL B R. Unsolved mysteries: how does lipid peroxidation cause ferroptosis ?[J]. PLoS Biology, 2018, 16(5): e2006203. DOI:10.1371/journal.pbio.2006203 |
| [20] |
HENTZE M W, MUCKENTHALER M U, GALY B, et al. Two to tango: regulation of Mammalian iron metabolism[J]. Cell, 2010, 142(1): 24-38. DOI:10.1016/j.cell.2010.06.028 |
| [21] |
IMAI H, NAKAGAWA Y. Biological significance of phospholipid hydroperoxide glutathione pe-roxidase (PHGPx, GPx4) in mammalian cells[J]. Free Radical Biology & Medicine, 2003, 34(2): 145-169. |
| [22] |
MORINOBU S, KUMAGAI S. Glutathione, glutathione pe-roxidase (GPx), glutathione S-transferase (GST)[J]. Nihon Rinsho Japanese Journal of Clinical Medicine, 2004, 62(Suppl 11): 557-559. |
| [23] |
ZHANG Y L, SWANDA R V, NIE L T, et al. mTORC1 couples cyst(e)ine availability with GPX4 protein synthesis and ferroptosis regulation[J]. Nature Communications, 2021, 12(1): 1589. DOI:10.1038/s41467-021-21841-w |
| [24] |
URSINI F, MAIORINO M. Lipid peroxidation and ferroptosis: the role of GSH and GPx4[J]. Free Radical Biology & Medicine, 2020, 152: 175-185. |
| [25] |
WANG K, CHEN X Z, WANG Y H, et al. Emerging roles of ferroptosis in cardiovascular diseases[J]. Cell Death Discove-ry, 2022, 8(1): 394. DOI:10.1038/s41420-022-01183-2 |
| [26] |
GUAN X, LI Z H, ZHU S, et al. Galangin attenuated cerebral ischemia-reperfusion injury by inhibition of ferroptosis through activating the SLC7A11/GPX4 axis in gerbils[J]. Life Sciences, 2021, 264: 118660. DOI:10.1016/j.lfs.2020.118660 |
| [27] |
FU C, WU Y F, LIU S J, et al. Rehmannioside A improves cognitive impairment and alleviates ferroptosis via activating PI3K/AKT/Nrf2 and SLC7A11/GPX4 signaling pathway after ischemia[J]. Journal of Ethnopharmacology, 2022, 289: 115021. DOI:10.1016/j.jep.2022.115021 |
| [28] |
YU P, ZHANG J, DING Y, et al. Dexmedetomidine post-conditioning alleviates myocardial ischemia-reperfusion injury in rats by ferroptosis inhibition via SLC7A11/GPX4 axis activation[J]. Human Cell, 2022, 35(3): 836-848. DOI:10.1007/s13577-022-00682-9 |
| [29] |
LIU T Y, CUI Y T, DONG S S, et al. Treadmill training reduces cerebral ischemia-reperfusion injury by inhibiting ferroptosis through activation of SLC7A11/GPX4[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 8693664. |
| [30] |
王瑶, 陈士坤, 段晨阳, 等. Sirt6通过调控P53/SLC7A11/GPX4通路抑制骨骼肌细胞铁死亡[J]. 中国病理生理杂志, 2023, 39(2): 335-344. |
| [31] |
芮玲, 王文静, 倪海莱, 等. 银杏素调节Nrf2、SLC7A11、GPX4信号通路对卵巢癌细胞及铁死亡的影响[J]. 中国计划生育学杂志, 2022, 30(12): 2677-2682. |
| [32] |
蔡婉, 周华, 徐基杰, 等. 鹿红方通过SLC7A11/GPX4信号通路减轻心肌缺血再灌注损伤的机制研究[J]. 上海中医药大学学报, 2022, 36(S1): 137-142. |
| [33] |
高世龙, 蔡钦钦, 金小健, 等. 淫羊藿苷调节Nrf2/SLC7A11/GPX4信号通路对高糖诱导的小胶质细胞铁死亡的影响[J]. 中国药师, 2022, 25(11): 1878-1883. |
 2023, Vol. 59
2023, Vol. 59

