弥漫性胶质瘤是最常见的中枢神经系统恶性肿瘤,占中枢神经系统恶性肿瘤的80%[1]。世界卫生组织(WHO)根据其组织学和分子特征将它们归类为Ⅰ~Ⅳ级[2]。Ⅳ级胶质母细胞瘤(GBM)最具侵袭性,且中位生存期较差[3]。p53被认为是一个关键的肿瘤抑制基因,其功能障碍对肿瘤发生具有重要影响[4]。p53基因发生突变的肿瘤约占人类肿瘤的50%,一些p53突变体具有促进肿瘤发生发展的特性[5]。缝隙连接由连接蛋白组成,连接蛋白是一种跨膜蛋白,可组装成质膜中的通道[6]。缝隙连接信号负责相当大比例的细胞通讯,通过与相邻细胞形成的缝隙连接,可向邻近细胞递送和交换小分子肽、离子、内源核酸和其他细胞代谢物。因此,缝隙连接的异常表达可以改变细胞的新陈代谢,影响肿瘤的发生和进展[7]。连接蛋白43(Connexin 43)是目前发现细胞膜上表达最丰富的连接蛋白[8]。它能调节包括增殖在内的多种细胞功能活动[9],其表达异常会引起癌症等多种病理变化[10]。有研究表明,Connexin 43可以促进胶质母细胞瘤的侵袭[11]。但胶质母细胞瘤中p53突变和Connexin 43的调节关系目前尚不明确。本实验选用p53野生型的U87细胞[12]和p53突变型的U251细胞[13],检测Connexin 43的表达,旨在探讨p53基因突变对胶质母细胞瘤细胞Connexin 43表达的影响。
1 材料与方法 1.1 实验材料本实验所用细胞为人胶质母细胞瘤U87细胞与U251细胞,均为贴壁生长的细胞,其中U87细胞为p53野生型细胞,而U251细胞则为p53突变型细胞。高糖DMEM细胞培养液购于以色列Biological Industries公司,胎牛血清购于北京全式金生物技术有限公司,青链霉素合剂购于北京索莱宝公司,p53抗体、Connexin 43抗体和GAPDH抗体均购于美国CST公司,羊抗兔IgG-HRP购于上海爱必信生物科技有限公司。
1.2 实验方法 1.2.1 细胞培养将U87与U251细胞分别接种于含体积分数0.01青链霉素合剂和体积分数0.10胎牛血清的高糖DMEM培养液中,置于37 ℃、含体积分数0.05 CO2的培养箱中培养,待细胞融合度达80%~90%时,用胰酶消化2~3 min,加入等量的完全培养液终止消化,收集到15 mL的离心管中,以1 000 r/min离心5 min后丢弃上清液,加入新的完全培养液,用吸管轻轻吹打50~80次后充分悬浮细胞,转移到新的培养瓶中进行培养。
1.2.2 Western blotting检测p53和Connexin 43蛋白的表达将U87细胞和U251细胞悬液按照每孔1×108/L的密度分别接种于6孔板中,待细胞融合度达到80%左右时将6孔板从培养箱中取出,每孔加入100 μL裂解液在冰上裂解30 min后提取两种细胞的蛋白。加入5×Loading Buffer,在水中煮沸10 min变性后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)。每个凝胶孔的蛋白上样量为20 μg,用90 V的稳定电压进行电泳,用300 mA的稳定电流转膜90 min,根据所需目的蛋白的分子量对PVDF膜进行剪裁,然后以10 g/L的脱脂奶粉封闭90 min,分别加入p53抗体(1∶1 000)、Connexin 43抗体(1∶1 000)以及GAPDH抗体(1∶10 000)4 ℃孵育过夜。用TBST溶液漂洗3次(每次10 min)之后加入二抗(1∶10 000)室温孵育60 min,再用TBST溶液漂洗3次。用ECL化学发光液进行显影并拍照。使用Image J软件分析p53、Connexin 43和GAPDH条带的灰度值,目的蛋白的表达水平以p53、Connexin 43与GAPDH的比值表示。
1.3 统计学方法利用GraphPad Prism软件对数据进行统计学分析,计量资料以x±s表示,两组比较采用两独立样本t检验,P < 0.05认为差异具有统计学意义。
2 结果 2.1 两种细胞中p53蛋白表达的比较Western blotting结果显示,U87和U251细胞中p53蛋白的相对表达水平分别为1.280±0.227和0.570±0.080(n=6)。与U87细胞相比较,U251细胞中p53蛋白的表达水平明显降低,差异具有统计学意义(t=2.948,P < 0.05)。见图 1。
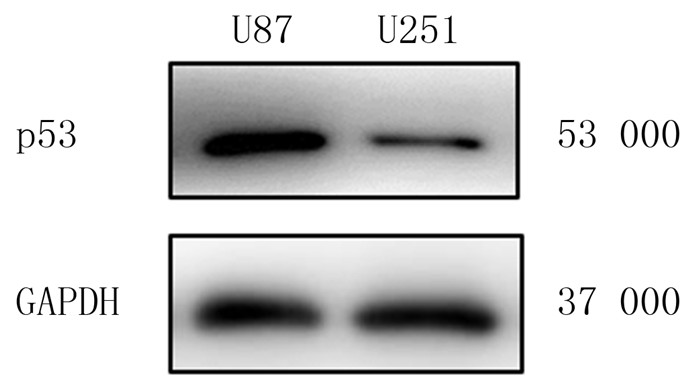 |
| 图 1 Western blotting检测两种细胞内p53蛋白的表达 |
Western blotting检测结果显示,U87细胞和U251细胞中Connexin 43蛋白的相对表达水平分别为0.370±0.096和0.820±0.131(n=6)。与U87细胞相比较,U251细胞中Connexin 43蛋白的表达水平明显升高,差异具有统计学意义(t=2.771,P < 0.05)。见图 2。
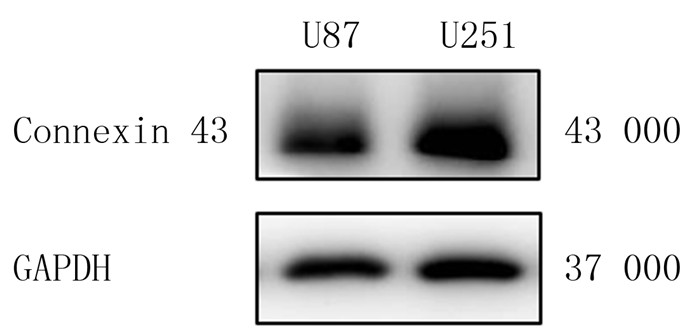 |
| 图 2 Western blotting检测两种细胞内Connexin 43蛋白的表达 |
胶质母细胞瘤是目前最常见和最具侵袭性的成人脑肿瘤,容易复发而且预后较差,5年生存率仅为5%[14],主要原因是由于肿瘤的广泛浸润、细胞异质性以及放化疗抗性[15-17]。p53是如今研究最广泛的肿瘤抑制因子之一,它能调节各种细胞过程,包括细胞的侵袭与增殖[18]。在正常情况下,p53的活性维持在基础水平,但这种活性可能会在不同的应激条件下增加,例如不同类型的DNA损伤和致癌性损伤[19]。所以p53通路的失调被认为是肿瘤发生中的关键事件,在大多数的人类癌症中,p53出现下调或突变[5]。
有研究表明,在人类前列腺癌细胞中,Connexin 43蛋白的表达随着肿瘤细胞恶性程度的增加而升高,其在肿瘤内的分布发生变化,并与细胞侵袭之间存在相关性[20]。但也有研究发现,在胰腺导管腺癌细胞中,p53突变体可以通过促进Connexin 43蛋白的降解来增强细胞的迁移侵袭能力[21]。而在胶质母细胞瘤细胞中,Connexin 43的表达增加可以增强细胞的侵袭能力,敲除U87细胞中的Connexin 43则会显著降低细胞的侵袭能力[22]。因此,胶质母细胞瘤细胞中依赖于Connexin 43的细胞通讯,可能是促进胶质母细胞瘤侵袭的一个重要因素。本实验结果显示,与U87细胞相比,U251细胞中Connexin 43蛋白的表达显著升高,表明p53基因的突变可能会导致胶质母细胞瘤细胞中Connexin 43蛋白的表达升高。有研究显示,U251细胞在体内比U87细胞具有更强的侵袭性和浸润性[23],该特性是否与Connexin 43表达上调有关有待进一步研究。本研究后续将探讨p53突变调控Connexin 43的机制及与胶质瘤发展的关系,以期为靶向治疗胶质母细胞瘤提供实验数据。
| [1] |
OSTROM Q T, GITTLEMAN H, FULOP J, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2008—2012[J]. Neuro-oncology, 2015, 17(Suppl 4): iv1-iv62. DOI:10.1093/neuonc/nov189 |
| [2] |
LOUIS D N, PERRY A, REIFENBERGER G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathologica, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [3] |
BLEEKER F E, MOLENAAR R J, LEENSTRA S. Recent advances in the molecular understanding of glioblastoma[J]. Journal of Neuro-Oncology, 2012, 108(1): 11-27. DOI:10.1007/s11060-011-0793-0 |
| [4] |
ASCHAUER L, MULLER P A J. Novel targets and interaction partners of mutant p53 Gain-Of-Function[J]. Biochemical Society Transactions, 2016, 44(2): 460-466. DOI:10.1042/BST20150261 |
| [5] |
MULLER P A J, VOUSDEN K H. p53 mutations in cancer[J]. Nature Cell Biology, 2013, 15(1): 2-8. DOI:10.1038/ncb2641 |
| [6] |
HERVÉ J C, BOURMEYSTER N, SARROUILHE D, et al. Gap junctional complexes: from partners to functions[J]. Progress in Biophysics and Molecular Biology, 2007, 94(1-2): 29-65. DOI:10.1016/j.pbiomolbio.2007.03.010 |
| [7] |
POYET C, BUSER L, ROUDNICKY F, et al. Connexin 43 expression predicts poor progression-free survival in patients with non-muscle invasive urothelial bladder cancer[J]. Journal of Clinical Pathology, 2015, 68(10): 819-824. DOI:10.1136/jclinpath-2015-202898 |
| [8] |
GOODENOUGH D A, PAUL D L. Gap junctions[J]. Cold Spring Harbor Perspectives in Biology, 2009, 1(1): a002576. |
| [9] |
POINTIS G, GILLERON J, CARETTE D, et al. Physiological and physiopathological aspects of connexins and communicating gap junctions in spermatogenesis[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2010, 365(1546): 1607-1620. DOI:10.1098/rstb.2009.0114 |
| [10] |
ISMAIL R, RASHID R, ANDRABI K, et al. Pathological implications of Cx43 down-regulation in human colon cancer[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(7): 2987-2991. DOI:10.7314/APJCP.2014.15.7.2987 |
| [11] |
LIN J H C, TAKANO T, COTRINA M L, et al. Connexin 43 enhances the adhesivity and mediates the invasion of malignant glioma cells[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2002, 22(11): 4302-4311. DOI:10.1523/JNEUROSCI.22-11-04302.2002 |
| [12] |
LEE S W, KIM H K, LEE N H, et al. The synergistic effect of combination temozolomide and chloroquine treatment is dependent on autophagy formation and p53 status in glioma cells[J]. Cancer Letters, 2015, 360(2): 195-204. DOI:10.1016/j.canlet.2015.02.012 |
| [13] |
BRÁZDOVÁ M, QUANTE, TÖGEL L, et al. Modulation of gene expression in U251 glioblastoma cells by binding of mutant p53 R273H to intronic and intergenic sequences[J]. Nucleic Acids Research, 2009, 37(5): 1486-1500. DOI:10.1093/nar/gkn1085 |
| [14] |
BATASH R, ASNA N, SCHAFFER P, et al. Glioblastoma multiforme, diagnosis and treatment; recent literature review[J]. Current Medicinal Chemistry, 2017, 24(27): 3002-3009. |
| [15] |
DE GOOIJER M C, GUILLÉN NAVARRO M, BERNARDS R, et al. An experimenter's guide to glioblastoma invasion pathways[J]. Trends in Molecular Medicine, 2018, 24(9): 763-780. DOI:10.1016/j.molmed.2018.07.003 |
| [16] |
WICK W, KESSLER T. New glioblastoma heterogeneity atlas-a shared resource[J]. Nature Reviews Neurology, 2018, 14(8): 453-454. DOI:10.1038/s41582-018-0038-3 |
| [17] |
KIM Y, KIM K H, LEE J, et al. Wnt activation is implicated in glioblastoma radioresistance[J]. Laboratory Investigation, 2012, 92(3): 466-473. DOI:10.1038/labinvest.2011.161 |
| [18] |
WAWRYK-GAWDA E, CHYLIÑSKA-WRZOS P, LIS-SOCHOCKA M, et al. P53 protein in proliferation, repair and apoptosis of cells[J]. Protoplasma, 2014, 251(3): 525-533. DOI:10.1007/s00709-013-0548-1 |
| [19] |
LOWE S W. Activation of p53 by oncogenes[J]. Endocrine-Related Cancer, 1999, 6(1): 45-48. |
| [20] |
ZHANG A, HITOMI M, BAR-SHAIN N, et al. Connexin 43 expression is associated with increased malignancy in prostate cancer cell lines and functions to promote migration[J]. Oncotarget, 2015, 6(13): 11640-11651. DOI:10.18632/oncotarget.3449 |
| [21] |
MUKHERJEE S, MADDALENA M, LV Y Q, et al. Cross-talk between mutant p53 and p62/SQSTM1 augments cancer cell migration by promoting the degradation of cell adhesion proteins[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(17): e2119644119. |
| [22] |
MCCUTCHEON S, SPRAY D C. Glioblastoma-astrocyte connexin 43 gap junctions promote tumor invasion[J]. Molecular Cancer Research: MCR, 2022, 20(2): 319-331. DOI:10.1158/1541-7786.MCR-21-0199 |
| [23] |
SCHULZ J A, RODGERS L T, KRYSCIO R J, et al. Characterization and comparison of human glioblastoma models[J]. BMC Cancer, 2022, 22(1): 844. DOI:10.1186/s12885-022-09910-9 |
 2023, Vol. 59
2023, Vol. 59

