胃腺癌是一种威胁人类健康的常见的恶性肿瘤。在我国,胃腺癌是癌症相关性死亡的第二大原因[1]。不同地区的胃腺癌发病率有较大差异,其中发病率最高的是东北亚(如日本、韩国和中国)的男性,每10万人中有69例罹患胃腺癌[2]。由于胃腺癌早期症状不明显而且侵袭转移能力较强,因此预后较差[2-4]。胃腺癌的发生发展及浸润转移过程涉及一系列分子机制的改变,但其具体机制目前尚不十分明确。因此,探讨胃腺癌发生发展及浸润转移的可能机制,以及寻找预后评估的有效标志物具有重要的临床意义。
Anosmin-1(ANOS-1)是一种由KAL1基因编码的细胞外基质(ECM)相关分泌糖蛋白,在早期脑发育过程中促进促性腺激素释放激素(GnRH)神经元从嗅觉基板向下丘脑迁移,影响初级和次级嗅觉处理区域的发育[5]。有研究结果表明,ANOS-1与多种恶性肿瘤,如结肠癌、肺癌和卵巢癌等密切相关,其异常表达与肿瘤细胞的生长、转移及预后不良有关[6-8]。有研究表明,进展期胃腺癌病人癌组织中ANOS-1 mRNA和血清中ANOS-1的表达水平明显高于正常人群[9-10]。但该蛋白在进展期胃腺癌组织中的表达情况及与病人预后的关系尚未见报道。本研究应用免疫组织化学方法,检测ANOS-1蛋白在进展期胃腺癌及相应淋巴结转移灶组织中的表达水平,分析其表达与病人临床病理特征的关系及对生存预后的影响,旨在探讨ANOS-1在胃腺癌发生发展过程及预后评估中的作用。
1 材料与方法 1.1 标本及其来源于青岛大学附属医院病理科选取2014—2015年的胃腺癌及相应癌旁组织(距肿瘤边缘≥5 cm,其中慢性浅表性胃炎74例,慢性萎缩性胃炎44例)标本118例,其中进展期胃腺癌标本99例;另从中随机选取40例有淋巴结转移的进展期胃腺癌病人相应淋巴结转移灶组织。所有入选病例临床病理资料均完整,术前均未接受过放化疗及其他相关治疗。临床分期按AJCC第八版分期标准,肿瘤分化程度按世界卫生组织(WHO)分级标准进行评判。对所有99例进展期胃腺癌病人定期进行生存随访,随访时间截至2020年12月31日。本研究经青岛大学附属医院伦理委员会批准且所有病人及家属均知情同意。
1.2 组织芯片制作所有胃腺癌及相应癌旁组织的切片经两名病理医师复诊确认后,在对应的蜡块上选择明确的癌组织及相应癌旁组织的部位;用孔径为2 mm细针对受体蜡块进行打孔,在供体蜡块标记的相应部位采集组织芯,将其移至受体蜡块的孔中,构建含有118例胃腺癌及相应癌旁组织的组织阵列蜡块,按4 μm厚度对组织阵列蜡块进行连续切片。组织芯片经苏木精-伊红(HE)染色后,再由病理医师确认。
1.3 免疫组织化学染色采用PV-6000法对组织芯片切片进行染色。蜡块切片、脱蜡、水化后,灭活内源性过氧化物酶,高压热抗原修复(EDTA,pH值=8.0),滴加ANOS-1抗体(ABN486,Millipore,Darmstadt,Germany, 1∶100),37 ℃孵育2 h,滴加二抗(PV-6000购于北京中杉金桥生物技术有限公司),37 ℃孵育30 min,二氨基联苯胺(DAB)显色,苏木精复染,封片。以ANOS-1阳性的脑组织作为阳性对照,以磷酸盐缓冲溶液(PBS)代替一抗作为阴性对照。
1.4 结果判断ANOS-1的阳性表达定位于细胞质,判读方法和标准参考相关文献[11-12]。按胞质染色强度和阳性细胞百分比进行计分,两者分值的乘积为总评分。总评分≤2分为低表达,>2分为高表达。
1.5 统计学处理采用SPSS 23.0软件对数据进行统计学分析。胃腺癌组织与相应癌旁组织之间以及原发灶与淋巴结转移灶之间ANOS-1的表达比较采用Wilcoxon秩和检验;采用χ2检验分析ANOS-1表达与病人临床病理特征的关系;采用Kaplan-Meier生存分析法(Log-rank检验)进行生存分析;进展期胃腺癌病人独立预后因素分析应用Cox回归模型,变量筛选方法采用向前步进法(LR)。以P < 0.05为差异有统计学意义。
2 结果 2.1 ANOS-1在胃腺癌组织及相应癌旁组织中的表达比较胃腺癌及相应癌旁组织中ANOS-1主要表达于细胞质(图 1)。在118例胃腺癌组织中,ANOS-1高表达者75例,低表达者43例;而在相应癌旁组织中,3例呈高表达,115例呈低表达。与相应癌旁组织相比,ANOS-1在胃腺癌组织中的表达水平升高,差异具有统计学意义(Z=-8.278,P < 0.001)。在74例慢性浅表性胃炎癌旁组织中,ANOS-1高表达者1例,低表达者73例;在44例慢性萎缩性胃炎癌旁组织中,2例ANOS-1呈高表达,42例ANOS-1呈低表达。ANOS-1在不同类型癌旁组织中的表达差异无显著性(P>0.05)。
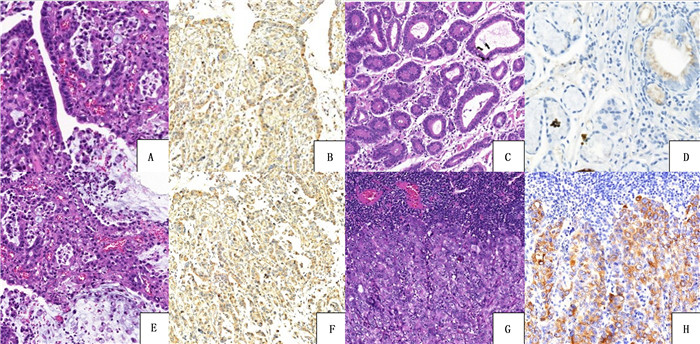 |
| A~D:进展期胃腺癌组织(A、B)及其相应癌旁组织(C、D);E~H:进展期胃腺癌原发灶组织(E、F)及其相应淋巴结转移灶组织(G、H)。其中A、C、E、G为HE染色,B、D、F、H为免疫组化染色,200倍。 图 1 ANOS-1在进展期胃腺癌及相应癌旁组织和淋巴结转移灶中的表达 |
选取40例有淋巴结转移的进展期胃腺癌标本,其中24例ANOS-1在原发灶中呈高表达,31例在淋巴结转移灶中呈高表达,二者表达差异具有统计学意义(Z=-5.786,P < 0.001)。见图 1。
2.3 进展期胃腺癌组织中ANOS-1表达与病人临床病理特征的关系浸润深度为T3~T4、有淋巴结转移、有脉管侵犯、TNM分期为Ⅲ~Ⅳ期的进展期胃腺癌病人癌组织中ANOS-1高表达率分别显著高于浸润深度为T2、无淋巴结转移、无脉管侵犯、TNM分期为Ⅱ期的病人(χ2=6.558~26.455,P < 0.05),ANOS-1表达水平与病人的性别、年龄、肿瘤大小和分化程度无关(P>0.05)。见表 1。
| 表 1 进展期胃腺癌组织中ANOS-1表达与病人临床病理特征的关系(例(χ/%)) |
|
|
对99例进展期胃腺癌病人进行生存分析,结果显示,ANOS-1高表达病人的总生存期、无病生存期中位数分别为35、20个月,低表达病人分别为43、35个月,ANOS-1高表达病人总生存期和无病生存期较低表达者更短(P=0.004、0.002)(图 2A~B)。在TNM分期为Ⅲ~Ⅳ期的病人中,ANOS-1高表达病人的总生存期中位数为32个月,低表达病人为43个月,ANOS-1表达水平越高总生存期越短(P=0.003)(图 2C);而在浸润深度为T3~T4的病人中,ANOS-1高表达病人的总生存期中位数为35个月,低表达病人的总生存期中位数为46个月,ANOS-1表达水平越高总生存期越短(P=0.030)(图 2D);在脉管侵犯阴性的病人中,ANOS-1高表达病人的总生存期中位数为40个月,低表达病人的总生存期中位数为44个月,ANOS-1表达水平越高总生存期越短(P=0.020)(图 2E)。
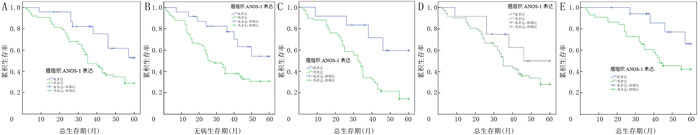 |
| A:ANOS-1表达与进展期胃腺癌病人总生存期的关系;B:ANOS-1表达与进展期胃腺癌病人无病生存期的关系;C:ANOS-1表达与Ⅲ~Ⅳ期进展期胃腺癌病人总生存期的关系;D:ANOS-1表达与浸润深度T3~T4进展期胃腺癌病人总生存期的关系;E:ANOS-1表达与脉管侵犯阴性进展期胃腺癌病人总生存期的关系。 图 2 ANOS-1表达与进展期胃腺癌病人术后生存时间的关系 |
将进展期胃腺癌病人的性别(女=参照)、年龄(< 60岁=参照)、分化程度(中分化=参照)、肿瘤大小(直径 < 5 cm=参照)、浸润深度(T2=参照)、TNM分期(Ⅱ期=参照)、淋巴结转移(阴性=参照)、脉管侵犯(阴性=参照)以及ANOS-1表达(低表达=参照)等临床病理特征纳入Cox回归模型,进行独立预后影响因素分析。单因素回归分析结果表明,ANOS-1表达、TNM分期、淋巴结转移、浸润深度、脉管侵犯和分化程度对进展期胃腺癌病人总生存期的影响差异有统计学意义,ANOS-1表达、TNM分期、淋巴结转移、分化程度、脉管侵犯对进展期胃腺癌病人无病生存期的影响差异有统计学意义。多因素回归分析结果表明,ANOS-1表达水平和TNM分期是影响进展期胃腺癌病人总生存期和无病生存期的独立预后因素,ANOS-1高表达病人的死亡风险和复发风险为低表达病人的3.658倍和4.769倍,TNM分期为Ⅲ~Ⅳ期病人的死亡风险和复发风险是TNM分期为Ⅱ期病人的6.749倍和7.294倍。见表 2、3。
| 表 2 Cox回归模型分析进展期胃腺癌病人总生存期的影响因素 |
|
|
| 表 3 Cox回归模型分析进展期胃腺癌病人无病生存期的影响因素 |
|
|
ANOS-1的编码基因KAL1定位于人染色体Xp22.3上,全长67 kbp,最早由LEGOUIS等[13]于1991年在Kallmann综合征病人体细胞中发现,其编码的蛋白质产物为ANOS-1,主要定位于细胞质内,分子量为76 000[14]。在分子结构上,ANOS-1由1个包含N端信号肽、富半胱氨酸区、乳清酸性蛋白样四-二硫核心的结构域,4个相邻的纤连蛋白样Ⅲ型结构域以及1个富含组氨酸的C端组成[15]。ANOS-1高表达于大脑嗅球表面的嗅神经层,在视网膜、脊髓和肾脏中也有一定程度表达[5-6, 16-17]。在早期脑发育过程中ANOS-1促进了GnRH神经元及嗅球表面嗅鞘细胞的分化成熟,调控GnRH神经元及嗅鞘细胞从嗅觉基板向下丘脑的迁移,从而影响初级和次级嗅觉处理区域的发育[6, 14, 16-18]。
ANOS-1与肿瘤关系的相关研究较少。2009年有研究显示,ANOS-1在结肠癌、肺癌和卵巢癌组织中的表达明显上调[6];2015年KANDA等[10]研究表明,进展期胃腺癌组织ANOS-1 mRNA的表达水平明显高于相应癌旁组织,但该蛋白在进展期胃腺癌组织中的表达情况及其与病人预后的关系尚未见报道。本研究应用免疫组织化学方法检测结果显示,ANOS-1蛋白在胃腺癌组织中的表达水平显著高于相应癌旁组织,与上述研究结果相一致,提示ANOS-1过表达可能是胃腺癌进展过程中发生的一个特定分子事件。
有研究结果显示,ANOS-1在进展期结肠癌中的表达随着临床分期的提高而逐步增加,在低氧条件下结肠癌细胞的ANOS-1表达水平也明显提高,并且随着其表达水平的提高,肿瘤细胞的迁移数量增加[6]。有研究结果表明,ANOS-1的相关基因与ITGAV、FOXC2以及NODAL等基因存在着共表达[9-10],而上述基因的蛋白产物是介导肿瘤细胞失黏附过程的重要转录因子[19-22]。QI等[8]的研究也发现,ANOS-1蛋白的高表达会刺激结肠癌细胞的增殖、侵袭和迁移[23-24]。上述结果表明,ANOS-1可以增强肿瘤细胞的侵袭与迁移能力。本研究结果显示,ANOS-1在进展期胃腺癌组织中的表达与肿瘤浸润深度、淋巴结转移、脉管侵犯及TNM分期等临床病理特征存在显著相关性,在肿瘤浸润深度为T3~T4、有淋巴结转移、有脉管侵犯以及TNM分期晚的病人中ANOS-1的表达水平更高。本研究还分析了ANOS-1在进展期胃腺癌原发灶与淋巴结转移灶中的表达情况,结果显示,与进展期胃腺癌原发灶相比,相应淋巴结转移灶中ANOS-1的表达水平显著升高。这些结果提示,ANOS-1在胃腺癌侵袭和淋巴结转移过程中发挥了重要作用,参与了胃腺癌的进展过程。但是ANOS-1影响胃腺癌侵袭转移的可能分子机制仍需在今后的研究中进一步探讨。
本研究结果显示,进展期胃腺癌病人中ANOS-1蛋白高表达者的总生存期及无病生存期较低表达者更短。KANDA等[9]的研究结果也显示,胃腺癌病人血清ANOS-1表达水平明显高于正常人群,且表达水平越高的病人总生存期及无病生存期越短。本研究结果还显示,在TNM分期为Ⅲ~Ⅳ期、浸润深度为T3~T4以及脉管侵犯阴性的进展期胃腺癌病人中,ANOS-1表达水平越高,总生存期越短。提示在TNM分期为Ⅲ~Ⅳ期、浸润深度为T3~T4以及脉管侵犯阴性的进展期胃腺癌病人中,ANOS-1高表达者可能较低表达者有着更差的预后,ANOS-1的表达水平可能有助于临床工作中对有不同临床病理特征的胃腺癌病人的预后情况做出较准确的判断。Cox回归模型分析结果显示,ANOS-1表达水平和肿瘤的TNM分期是影响进展期胃腺癌病人术后总生存期和无病生存期的独立预后因素。以上结果提示,癌组织中ANOS-1的高表达与进展期胃腺癌预后差密切相关。因此,ANOS-1可能成为一种用于评估进展期胃腺癌病人术后生存期的潜在分子标志物。
综上所述,ANOS-1在进展期胃腺癌的发展过程中可能发挥着重要作用,其高表达与病人术后预后不良相关,ANOS-1在判断胃腺癌病人的预后方面有潜在应用价值。但是由于本实验仅在蛋白层面上对ANOS-1的表达情况与进展期胃腺癌病人临床病理特征以及预后的关系进行探讨,并不能对ANOS-1在胃腺癌发生发展中所发挥的具体生物学作用及其分子机制作出更深层次的说明,因此仍需要通过分子生物学的实验方法在分子病理层面进行进一步研究,以便提供新的理论依据更好地指导胃腺癌的诊断和靶向治疗。
| [1] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. International Journal of Cancer, 2019, 144(8): 1941-1953. DOI:10.1002/ijc.31937 |
| [3] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA: A Cancer Journal for Clinicians, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [4] |
FERNÁNDEZ-FERNÁNDEZ F J, SESMA P. Gastric cancer[J]. Lancet (London, England), 2009, 374(9701): 1594-1595. |
| [5] |
GONZÁLEZ-MARTÍNEZ D, KIM S H, HU Y L, et al. Anosmin-1 modulates fibroblast growth factor receptor 1 signaling in human gonadotropin-releasing hormone olfactory neuroblasts through a heparan sulfate-dependent mechanism[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2004, 24(46): 10384-10392. DOI:10.1523/JNEUROSCI.3400-04.2004 |
| [6] |
JIAN B X, NAGINENI C N, MELETH S, et al. Anosmin-1 involved in neuronal cell migration is hypoxia inducible and cancer regulated[J]. Cell Cycle, 2009, 8(22): 3770-3776. DOI:10.4161/cc.8.22.10066 |
| [7] |
KIM H C, KIM Y S, OH H W, et al. Collagen triple helix repeat containing 1 (CTHRC1) acts via ERK-dependent induction of MMP9 to promote invasion of colorectal cancer cells[J]. Oncotarget, 2014, 5(2): 519-529. DOI:10.18632/oncotarget.1714 |
| [8] |
QI L, ZHANG W J, CHENG Z Q, et al. Study on molecular mechanism of ANOS1 promoting development of colorectal cancer[J]. PLoS One, 2017, 12(8): e0182964. DOI:10.1371/journal.pone.0182964 |
| [9] |
KANDA M, SUH Y S, PARK D J, et al. Serum levels of ANOS1 serve as a diagnostic biomarker of gastric cancer: a prospective multicenter observational study[J]. Gastric Cancer, 2020, 23(2): 203-211. DOI:10.1007/s10120-019-00995-z |
| [10] |
KANDA M, SHIMIZU D, FUJII T, et al. Function and diagnostic value of Anosmin-1 in gastric cancer progression[J]. International Journal of Cancer, 2016, 138(3): 721-730. DOI:10.1002/ijc.29803 |
| [11] |
KANDA M, SUGIMOTO H, NOMOTO S, et al. Clinical utility of PDSS2 expression to stratify patients at risk for recurrence of hepatocellular carcinoma[J]. International Journal of Oncology, 2014, 45(5): 2005-2012. DOI:10.3892/ijo.2014.2637 |
| [12] |
KANDA M, SUGIMOTO H, NOMOTO S, et al. B-cell translocation gene 1 serves as a novel prognostic indicator of hepatocellular carcinoma[J]. International Journal of Oncology, 2015, 46(2): 641-648. DOI:10.3892/ijo.2014.2762 |
| [13] |
LEGOUIS R, HARDELIN J P, LEVILLIERS J, et al. The candidate gene for the X-linked Kallmann syndrome encodes a protein related to adhesion molecules[J]. Cell, 1991, 67(2): 423-435. DOI:10.1016/0092-8674(91)90193-3 |
| [14] |
MACCOLL G, BOULOUX P, QUINTON R. Kallmann syndrome: adhesion, afferents, and anosmia[J]. Neuron, 2002, 34(5): 675-678. DOI:10.1016/S0896-6273(02)00720-1 |
| [15] |
CHOY C, KIM S H. Biological actions and interactions of anosmin-1[J]. Frontiers of Hormone Research, 2010, 39: 78-93. |
| [16] |
CHOY C T, KIM H, LEE J Y, et al. Anosmin-1 contributes to brain tumor malignancy through integrin signal pathways[J]. Endocrine-Related Cancer, 2014, 21(1): 85-99. |
| [17] |
MATSUSHIMA S, SHIMIZU A, KONDO M, et al. Anosmin-1 activates vascular endothelial growth factor receptor and its related signaling pathway for olfactory bulb angiogenesis[J]. Scientific Reports, 2020, 10(1): 188. DOI:10.1038/s41598-019-57040-3 |
| [18] |
HU Y L, BUTTS T, POOPALASUNDARAM S, et al. Extracellular matrix protein anosmin-1 modulates olfactory ensheathing cell maturation in chick olfactory bulb development[J]. European Journal of Neuroscience, 2019, 50(9): 3472-3486. DOI:10.1111/ejn.14483 |
| [19] |
GOLDEN D, CANTLEY L G. Casein kinase 2 prevents mesenchymal transformation by maintaining Foxc2 in the cytoplasm[J]. Oncogene, 2015, 34(36): 4702-4712. DOI:10.1038/onc.2014.395 |
| [20] |
HOLLIER B G, TINNIRELLO A A, WERDEN S J, et al. FOXC2 expression links epithelial-mesenchymal transition and stem cell properties in breast cancer[J]. Cancer Research, 2013, 73(6): 1981-1992. DOI:10.1158/0008-5472.CAN-12-2962 |
| [21] |
KONG B, WANG W B, ESPOSITO I, et al. Increased expression of Nodal correlates with reduced patient survival in pancreatic cancer[J]. Pancreatology: Official Journal of the International Association of Pancreatology (IAP), 2015, 15(2): 156-161. DOI:10.1016/j.pan.2015.02.001 |
| [22] |
DE SOUZA VIANA L, AFFONSO R J Jr, SILVA S R M, et al. Relationship between the expression of the extracellular matrix genes SPARC, SPP1, FN1, ITGA5 and ITGAV and clinicopathological parameters of tumor progression and colorectal cancer dissemination[J]. Oncology, 2013, 84(2): 81-91. DOI:10.1159/000343436 |
| [23] |
YANG X M, YOU H Y, LI Q, et al. CTHRC1 promotes human colorectal cancer cell proliferation and invasiveness by activating Wnt/PCP signaling[J]. International Journal of Clinical and Experimental Pathology, 2015, 8(10): 12793-12801. |
| [24] |
TAN F, LIU F, LIU H, et al. CTHRC1 is associated with peritoneal carcinomatosis in colorectal cancer: a new predictor for prognosis[J]. Medical Oncology (Northwood, London, England), 2013, 30(1): 473. DOI:10.1007/s12032-013-0473-3 |
 2023, Vol. 59
2023, Vol. 59

