缺血性卒中是由原位血栓或来自另一个动脉或心脏的栓塞的动脉梗阻引起的,是全球第三大死亡原因[1]。考虑到溶栓和手术治疗缺血性卒中的效果有限而且预后不佳,需要新的治疗方式来改善卒中的预后。低氧诱导因子-1(HIF-1)是由β亚基和α亚基组成的异二聚体。泛素依赖性蛋白酶根据氧气含量调节α亚基水平[2-3]。研究表明,HIF-1α有一定神经保护作用[4]。乙酸钠(NaAc)是一种短链脂肪酸。已有研究表明,含有醋酸酯的短链脂肪酸有抑制炎症作用[5]。NaAc在缺血性脑卒中动物及细胞模型中作用研究甚少。本研究利用大脑中动脉闭塞(MCAO)模型及氧糖剥夺(OGD)处理的皮质神经元作为脑缺血模型,探究NaAc对脑缺血再灌注损伤后神经元损伤的作用及HIF-1α水平的影响。
1 材料与方法 1.1 实验材料 1.1.1 实验动物雄性SD大鼠30只,体质量为250~ 300 g,购自青岛大仁福成牧业有限公司。大鼠分笼饲养,每笼2~3只。饲养条件:光照/黑暗周期为12/12 h,房间温度23~25 ℃,自由获取食物和水。实验前适应喂养3 d。
1.1.2 主要的实验试剂NaAc购自上海埃彼化学试剂有限公司;二甲基草酰甘氨酸(DMOG)购自CSNpharm公司;兔来源抗HIF-1α多克隆抗体、抗MAP2多克隆抗体购自CST公司;HIF-1α抑制剂(LW6)、乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自上海碧云天生物技术有限公司;CCK-8试剂盒购自北京Bioss生物技术有限公司;2, 3, 5-氯化三苯基四氮唑(TTC)购自美国Sigma公司。
1.2 实验方法 1.2.1 原代神经元培养采用相关文献的方法[6], 原代培养6批神经元,分别用于Western blot检测、免疫荧光染色、细胞存活实验(CCK-8)和乳酸脱氢酶(LDH)释放实验。
1.2.2 氧糖剥夺/复氧模型(OGD/R模型)的制备根据相关文献方法[7],采用OGD/R处理神经元,以其作为OGD/R模型。
1.2.3 缺血再灌注损伤模型制备及TTC染色采用线栓梗死技术制备大鼠缺血再灌注损伤模型[8]。将SD大鼠分为Sham组(假手术对照)、MCAO组(制备缺血再灌注损伤模型)、MCAO+NaAc组(制备缺血再灌注损伤模型并腹腔注射NaAc),各6只。观察各组大鼠脑梗死体积。
1.2.4 Western blot检测采用相关文献方法[8]。将原代培养神经元分为3批,第1批分为Sham组(未做处理)和NaAc组(加入NaAc),观察NaAc对HIF-1α蛋白水平的影响;第2批分为Sham组(未做处理)和OGD/R 6 h组(给予神经元OGD/R处理),观察OGD后神经元内HIF-1α蛋白水平的变化;第3批分为Sham组(未做处理)、OGD组(给予神经元OGD处理)、OGD+NaAc组(神经元OGD后加入NaAc),观察NaAc对OGD后HIF-1α蛋白水平的影响。每组实验重复6次。
1.2.5 免疫荧光染色采用相关文献方法[8],将原代培养神经元分为Sham组(未做处理)、OGD组(给予神经元OGD处理)和OGD+NaAc组(神经元OGD后加入NaAc),观察NaAc对OGD后神经元存活的影响。
1.2.6 CCK-8比色法以及LDH释放实验采用相关文献的方法[8],将神经元分为2批,第1批分为Control组(未做处理)、Control+NaAc组(加入NaAc)、OGD组(给予神经元OGD处理)、OGD+NaAc组(神经元OGD后加入NaAc),观察NaAc对OGD后神经元存活的影响;第2批分为Control组(未做处理)、OGD组(给予神经元OGD处理)、OGD+NaAc组(神经元OGD之后加入NaAc处理)、OGD+NaAc+DMOG组(神经元OGD后加入NaAc和DMOG)、OGD+NaAc+LW6组(神经元OGD后加入NaAc和LW6),观察HIF-1α表达对NaAc调节的损伤神经元存活的影响。每组实验均重复6次。
1.3 统计学分析应用Graph Pad Prism 8.0软件进行统计学分析。计量资料以x±s表示,两组比较采用两独立样本比较t检验;多组均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 NaAc对缺血损伤后大鼠脑梗死体积的影响TTC染色结果示,Sham组、MCAO组、MCAO+ NaAc组大鼠脑梗死体积分别为0、32.89±5.05、19.36±3.57,各组比较差异有显著性(F=107.20,P < 0.05),MCAO+NaAc组脑梗死体积明显小于MCAO组(t=5.988,P < 0.05)。见图 1。
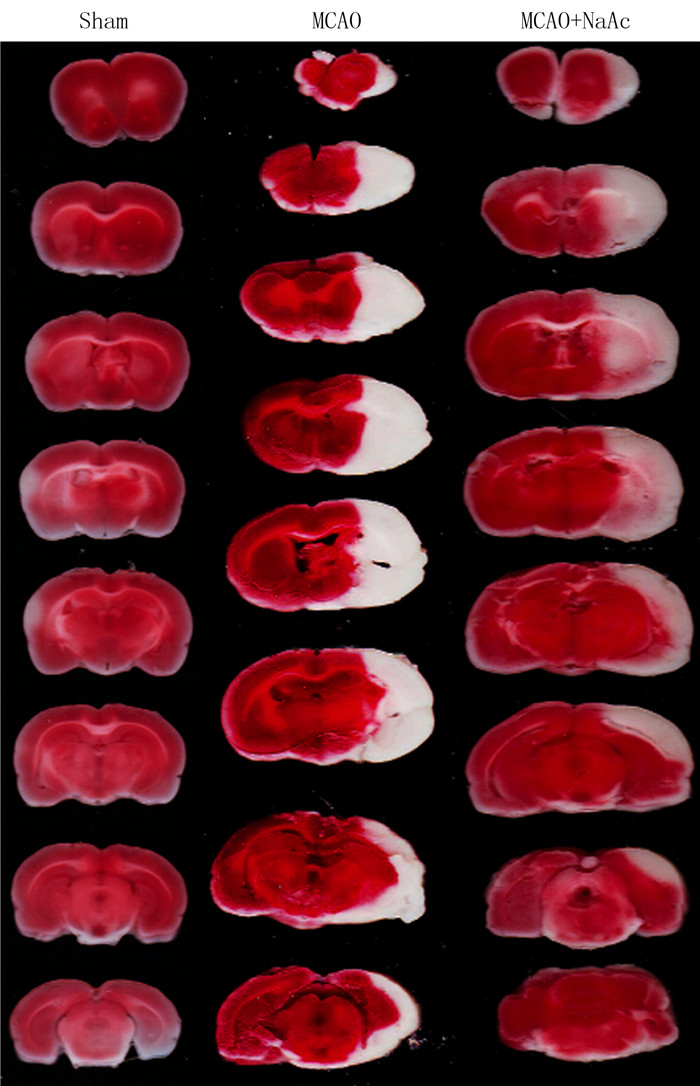 |
| 图 1 各组大鼠脑梗死TTC染色观察 |
CCK-8比色检测显示,各组神经元存活率差异有显著性(F=98.80,P < 0.05)。与Control组相比,OGD组细胞存活率降低(t=14.29,P < 0.05);与OGD组相比,OGD+NaAc组细胞存活率增加(t=5.94,P < 0.05)。LDH释放实验显示,各组LDH释放率差异具有统计学意义(F=72.62,P < 0.05)。与Control组相比,OGD组LDH释放率明显升高(t=11.35,P < 0.05);与OGD组相比较,OGD+NaAc组LDH释放率降低(t=2.75,P < 0.05)。见表 1。
| 表 1 各组神经元存活率及LDH释放率比较(n=6,χ/%, x±s) |
|
|
NaAc组的HIF-1α蛋白表达水平较Sham组明显下降(t=7.84,P < 0.05)。见图 2。
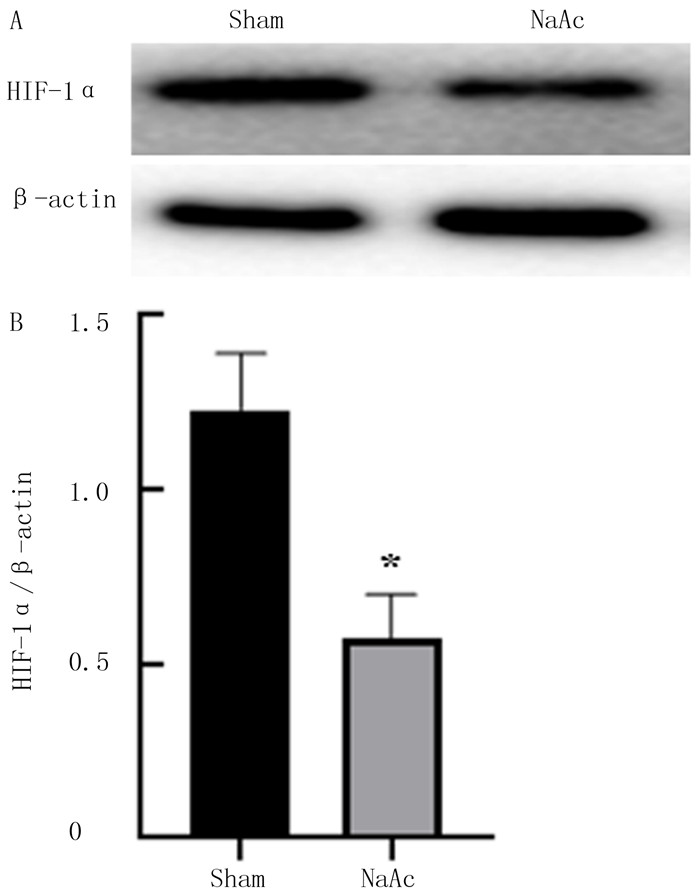 |
| A:HIF-1α蛋白表达的Western blot检测;B:HIF-1α蛋白表达柱状图,与Sham组比较,*P < 0.05。 图 2 NaAc对正常神经元内HIF-1α蛋白表达的影响 |
Western blot检测结果表明,与Sham组相比较,OGD/R 6 h组HIF-1α蛋白表达明显上升(t=9.96,P < 0.05)。见图 3。
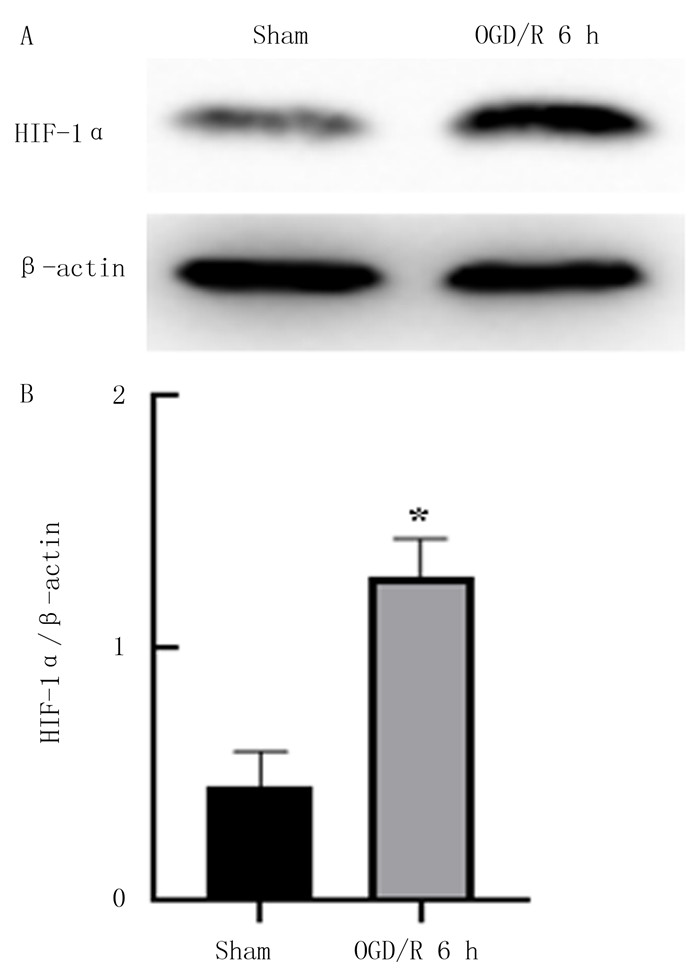 |
| A:HIF-1α蛋白表达的Western blot检测;B:HIF-1α蛋白表达柱状图,与Sham组比较,*P < 0.05。 图 3 OGD/R 6 h后神经元内HIF-1α蛋白表达的检测 |
Western blot检测结果显示,与Sham组相比较,OGD组HIF-1α蛋白表达水平明显升高(F=74.74,t=11.62,P < 0.05);与OGD组相比,OGD+NaAc组HIF-1α蛋白表达水平明显降低(t=9.11,P < 0.05)。见图 4。
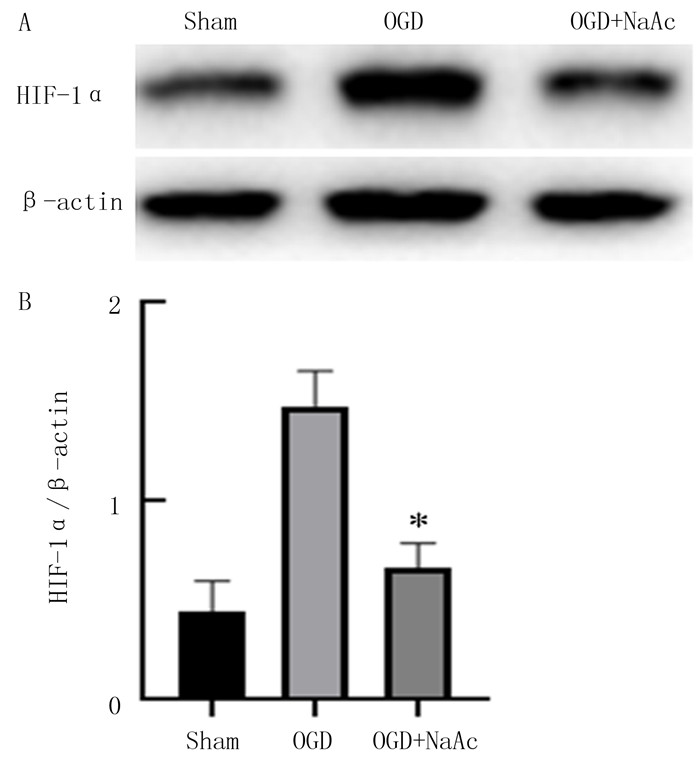 |
| A:HIF-1α蛋白表达的Western blot检测;B:HIF-1α蛋白表达柱状图,与OGD组比较,*P < 0.05。 图 4 OGD/R 6 h后加入NaAc对皮质神经元内HIF-1α蛋白表达影响 |
CCK-8比色及LDH释放实验显示,与OGD+NaAc组相比较,OGD+NaAc+DMOG组细胞存活率降低(F=43.57,t=10.12,P < 0.05),LDH释放率增高(F=97.52,t=3.28,P < 0.05);而OGD+NaAc+LW6组的细胞存活率升高(t=4.49,P < 0.05),LDH释放率降低(t=3.37,P < 0.05)。见表 2。
| 表 2 HIF-1α蛋白表达对NaAc调节的损伤神经元存活的影响(n=6, χ/%, x±s) |
|
|
缺血性脑卒中可直接造成大脑不可逆的细胞损伤,或在半暗带引起一系列病理生理过程,引起细胞死亡,导致损伤后梗死体积增加[10]。
短链脂肪酸是厌氧细菌发酵的主要代谢产物,被认为是微生物群与宿主组织之间的纽带[11]。胃肠道和血液中脂肪酸浓度的改变可能会诱发或预防病理性疾病,如癌症、糖尿病等。NaAc是由不可消化的食物残渣和肠道内内源性上皮源性黏液厌氧发酵产生的。肠腔中释放的短链脂肪酸很容易被结肠细胞吸收并用作能量来源。正常情况下,人血清中的乙酸盐水平较低[12],而在低氧或葡萄糖缺乏状态下,乙酸盐可能成为乙酰辅酶A重要来源。乙酸盐是一种新的、有效的胶质瘤治疗途径[13]。已有研究表明,补充乙酸盐可增强小鼠抵抗应激的能力[14];NaAc通过促进p53的升高,可抑制肿瘤细胞的存活[15]。本文动物实验结果显示,NaAc可以减小大鼠脑梗死体积;细胞模型研究显示,OGD损伤后加入NaAc可减轻神经元损伤。因此,NaAc可能是缺血性脑卒中新的潜在治疗靶点。
HIF-1由HIF-1α和HIF-1β亚单位组成。每个亚单位都包含基本的bHLH-PAS结构域,该结构域介导异源二聚和DNA结合[16]。HIF-1α的转录活性确定了HIF-1α在细胞功能中具有重要的作用[17]。代谢调节是HIF-1α的主要和原始功能。在低氧条件下,HIF-1α可通过调节PDK1、LDHA、BNIP3和BNIP3L介导氧化代谢到糖酵解代谢的转变。PDK1编码丙酮酸脱氢酶(PDH)激酶1,其磷酸化可使PDH失活,从而抑制丙酮酸转化为乙酰辅酶A进入三羧酸循环[18]。本文研究结果显示,OGD损伤后神经元HIF-1α蛋白表达增加,NaAc通过抑制HIF-1α蛋白的表达促进神经元存活。因此,在缺血再灌注早期,抑制HIF-1α对缺血再灌注损伤具有保护作用。
已有研究结果显示,NaAc可自由穿过血-脑脊液屏障和细胞膜,并且可以增加蛋白的乙酰化[13]。NaAc能通过促进p53的表达,抑制HIF-1α的转录,进而降低HIF-1α的表达;而增多的HIF-1α可以抑制血管生成,调节糖代谢、线粒体功能、细胞存活等相关基因的表达。另有研究表明,HIF-1α升高加重对缺血性卒中的损伤,抑制HIF-1α表达可以减轻炎症反应,抑制M1微噬细胞、iNOS和COX2的促炎活性;此外,HIF-1α还与PKM2相关基因相互作用,促进糖酵解[19]。补充NaAc可能通过促进p53的表达,发挥神经保护作用[20-21]。NaAc还有很多其他作用,如抑制炎症,促进细胞自主代谢调节,从而在细胞发生缺血再灌注损伤时发挥重要保护作用[22]。本研究通过构建大鼠MCAO及原代神经元培养OGD模型,探讨NaAc对缺血再灌注损伤的作用及其机制。结果显示,缺血再灌注损伤后,大脑内神经元中HIF-1α蛋白表达上调,补充NaAc可抑制HIF-1α的表达,促进神经元的存活;应用HIF-1α激动剂和抑制剂研究显示,NaAc可通过抑制HIF-1α蛋白表达发挥神经保护作用。因此,NaAc可能是通过抑制HIF-1α表达进而抑制炎症反应,对大脑缺血再灌注损伤产生保护作用。
综上所述,NaAc通过抑制HIF-1α蛋白的表达,在脑缺血再灌注损伤中发挥神经保护作用。
| [1] |
YUAN M Z, LI F, FANG Q, et al. Research on the cause of death for severe stroke patients[J]. Journal of Clinical Nur-sing, 2018, 27(1-2): 450-460. DOI:10.1111/jocn.13954 |
| [2] |
RASHID M, ZADEH L R, BARADARAN B, et al. Up-down regulation of HIF-1α in cancer progression[J]. Gene, 2021, 798: 145796. DOI:10.1016/j.gene.2021.145796 |
| [3] |
LI H S, ZHOU Y N, LI L, et al. HIF-1α protects against oxidative stress by directly targeting mitochondria[J]. Redox Biology, 2019, 25: 101109. DOI:10.1016/j.redox.2019.101109 |
| [4] |
ZHU T N, ZHAN L X, LIANG D H, et al. Hypoxia-indu-cible factor 1α mediates neuroprotection of hypoxic postconditioning against global cerebral ischemia[J]. Journal of Neuropathology and Experimental Neurology, 2014, 73(10): 975-986. DOI:10.1097/NEN.0000000000000118 |
| [5] |
PANDEY S K, YADAV S, TEMRE M K, et al. Tracking acetate through a journey of living world: evolution as alternative cellular fuel with potential for application in cancer therapeutics[J]. Life Sciences, 2018, 215: 86-95. DOI:10.1016/j.lfs.2018.11.004 |
| [6] |
BREWER G J, TORRICELLI J R, EVEGE E K, et al. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination[J]. Journal of Neuroscience Research, 1993, 35(5): 567-576. DOI:10.1002/jnr.490350513 |
| [7] |
LIU B S, LIAO M X, MIELKE J G, et al. Ischemic insults direct glutamate receptor subunit 2-lacking AMPA receptors to synaptic sites[J]. The Journal of Neuroscience, 2006, 26(20): 5309-5319. DOI:10.1523/JNEUROSCI.0567-06.2006 |
| [8] |
XU X Y, CUI Y, LI C Q, et al. SETD3 downregulation me-diates PTEN upregulation-induced ischemic neuronal death through suppression of actin polymerization and mitochondrial function[J]. Molecular Neurobiology, 2021, 58(10): 4906-4920. DOI:10.1007/s12035-021-02459-x |
| [9] |
CHEN S F, PAN M X, TANG J C, et al. Arginine is neuroprotective through suppressing HIF-1α/LDHA-mediated inflammatory response after cerebral ischemia/reperfusion injury[J]. Molecular Brain, 2020, 13(1): 63. DOI:10.1186/s13041-020-00601-9 |
| [10] |
LY J V, ZAVALA J A, DONNAN G A. Neuroprotection and thrombolysis: combination therapy in acute ischaemic stroke[J]. Expert Opinion on Pharmacotherapy, 2006, 7(12): 1571-1581. DOI:10.1517/14656566.7.12.1571 |
| [11] |
SONG X Y, SUN X M, OH S F, et al. Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis[J]. Nature, 2020, 577(7790): 410-415. DOI:10.1038/s41586-019-1865-0 |
| [12] |
MATHEW R, ARUN P, MADHAVARAO C N, et al. Progress toward acetate supplementation therapy for Canavan di-sease: glyceryl triacetate administration increases acetate, but not N-acetylaspartate, levels in brain[J]. The Journal of Pharmacology and Experimental Therapeutics, 2005, 315(1): 297-303. DOI:10.1124/jpet.105.087536 |
| [13] |
LONG P M, TIGHE S W, DRISCOLL H E, et al. Acetate supplementation as a means of inducing glioblastoma stem-like cell growth arrest[J]. Journal of Cellular Physiology, 2015, 230(8): 1929-1943. DOI:10.1002/jcp.24927 |
| [14] |
HUANG W B, HU W M, CAI L L, et al. Acetate supplementation produces antidepressant-like effect via enhanced histone acetylation[J]. Journal of Affective Disorders, 2021, 281: 51-60. DOI:10.1016/j.jad.2020.11.121 |
| [15] |
PANDEY S K, YADAV S, GOEL Y, et al. Cytotoxic action of acetate on tumor cells of thymic origin: role of MCT-1, pH homeostasis and altered cell survival regulation[J]. Biochimie, 2019, 157: 1-9. DOI:10.1016/j.biochi.2018.10.022 |
| [16] |
JIANG B H, RUE E, WANG G L, et al. Dimerization, DNA binding, and transactivation properties of hypoxia-inducible factor 1[J]. The Journal of Biological Chemistry, 1996, 271(30): 17771-17778. DOI:10.1074/jbc.271.30.17771 |
| [17] |
SEMENZA G L. Hypoxia-inducible factors in physiology and medicine[J]. Cell, 2012, 148(3): 399-408. DOI:10.1016/j.cell.2012.01.021 |
| [18] |
KIM J W, TCHERNYSHYOV I, SEMENZA G L, et al. HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia[J]. Cell Metabolism, 2006, 3(3): 177-185. DOI:10.1016/j.cmet.2006.02.002 |
| [19] |
GRÜNING N M, RINNERTHALER M, BLUEMLEIN K, et al. Pyruvate kinase triggers a metabolic feedback loop that controls redox metabolism in respiring cells[J]. Cell Metabolism, 2011, 14(3): 415-427. DOI:10.1016/j.cmet.2011.06.017 |
| [20] |
BLAGOSKLONNY M V, AN W G, ROMANOVA L Y, et al. p53 inhibits hypoxia-inducible factor-stimulated transcription[J]. The Journal of Biological Chemistry, 1998, 273(20): 11995-11998. DOI:10.1074/jbc.273.20.11995 |
| [21] |
SUZUKI H, TOMIDA A, TSURUO T. Dephosphorylated hypoxia-inducible factor 1alpha as a mediator of p53-dependent apoptosis during hypoxia[J]. Oncogene, 2001, 20(41): 5779-5788. DOI:10.1038/sj.onc.1204742 |
| [22] |
BOSE S, RAMESH V, LOCASALE J W. Acetate metabolism in physiology, cancer, and beyond[J]. Trends in Cell Biology, 2019, 29(9): 695-703. DOI:10.1016/j.tcb.2019.05.005 |
 2023, Vol. 59
2023, Vol. 59

