2. 青岛大学附属医院肝脏内科, 山东 青岛 266003
原发性肝癌的发病率在我国常见恶性肿瘤中居第4位,肿瘤致死病因中居第2位,其中85%~90%是肝细胞癌,其治疗方法包括肝切除术、局部消融、经肝动脉化疗栓塞、肝移植等[1]。肝移植是肝癌根治的有效手段之一。我国肝细胞癌肝移植受者90%以上合并乙型病毒性肝炎[2],肝移植在根治肝脏恶性肿瘤的同时也治愈了肝炎、肝硬化等肝脏基础疾病。研究表明,炎症细胞因子在肿瘤的发生、增殖、侵袭、转移中有重要作用[3-5]。系统免疫炎症指数(SII)是基于外周血血小板与淋巴细胞、中性粒细胞比值的指标,其与食管癌、小细胞肺癌、胃癌、肝癌等恶性肿瘤的不良预后有关[6-9],但SII与肝细胞癌肝移植病人预后相关性尚缺乏研究。本研究探讨术前SII对肝细胞癌病人肝移植预后的预测价值。
1 资料与方法 1.1 研究对象回顾性分析2014年1月1日—2020年9月1日在青岛大学附属医院行肝移植手术的263例肝细胞癌病人的临床资料,其中男227例,女36例;平均年龄(53.24±8.91)岁。纳入标准:①组织病理学诊断为肝细胞癌;②年龄≥18周岁;③首次接受同种异体全肝移植。排除标准:①来源于其他组织的恶性肿瘤;②年龄不足18周岁;③劈离式肝移植;④多次肝移植或多器官联合移植;⑤围手术前期进行有创治疗和(或)患有急性感染性和(或)风湿免疫性疾病;⑥临床资料不完整。本研究获得青岛大学附属医院医学伦理委员会批准。
1.2 数据收集收集病人的年龄、性别、体质量指数(BMI)、饮酒史、甲胎蛋白(AFP)水平、Child-Pugh分级、无肝期时间、术中失血量、病理分化类型、肿瘤数目、最大肿瘤直径、微血管癌栓(MVI)、肝组织炎症坏死分级、纤维化分期、肝移植术前1周内的中性粒细胞计数(NE)、淋巴细胞计数(LY)、血小板计数(PLT)、清蛋白(ALB)、胆红素(TBil)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、尿素氮(BUN)、肌酐(Scr)及国际标准化比值(INR)等资料。SII=PLT×NE/LY。
1.3 随访资料收集肝细胞癌肝移植受者术后进行门诊或电话随访,随访截止时间为2021年1月1日。病人总生存(OS)以肝移植受者术后死亡或者随访截止时为观察终点。
1.4 统计学方法采用SPSS 24.0软件对数据进行统计学分析。正态分布的计量资料以x±s形式表示,两组间比较采用t检验;非正态分布的计量资料以M(Q25~Q75)表示,两组间比较采用Mann Whitney U检验;计数资料以例数(百分数)表示,两组间比较采用χ2检验。绘制受试者工作特征(ROC)曲线,并根据最佳界值进行分组。Kaplan-Meier法绘制生存曲线,采用log-rank检验进行组间生存率差异的比较。采用Cox比例风险回归模型进行影响术后生存的危险因素分析,方法为基于最大似然估计的向前逐步回归法。以P < 0.05为差异有统计学意义。
2 结果 2.1 ROC曲线及不同SII组病人临床资料比较SII预测肝细胞癌肝移植受者生存的ROC曲线最佳界值是211.09,灵敏度0.738,特异度0.540,曲线下面积0.678(95%CI=0.602~0.754)(见图 1)。根据SII最佳界值将病人分为低SII组(SII < 211.09, n=124)与高SII组(SII≥211.09, n=139),两组病人术前的BMI、AFP、病理分化类型、最大肿瘤直径、移植标准、肝组织纤维化分期比较,差异具有统计学意义(χ2=4.938~24.973,P均 < 0.05)。术前高SII组、低SII组病人的ALT、AST、GGT、ALP、INR差异有显著意义(Z=-3.870~-2.126, P < 0.05)。见表 1、2。
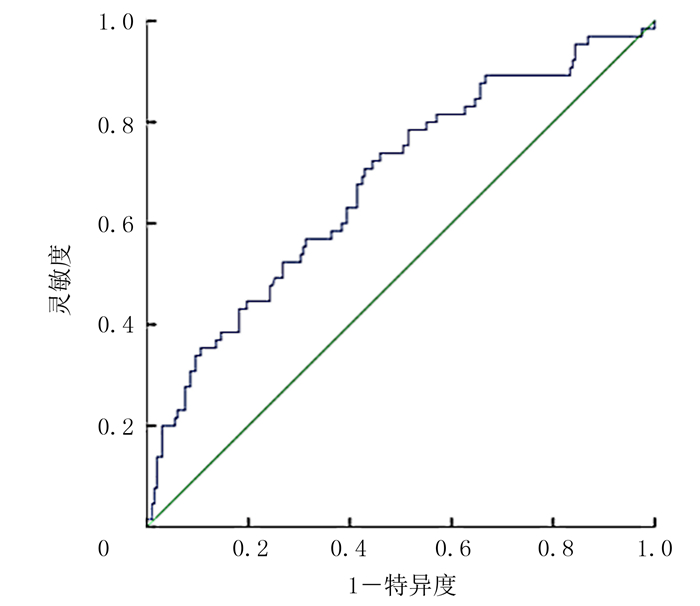 |
| 图 1 SII预测肝细胞癌肝移植受者术后生存的ROC曲线 |
| 表 1 低SII组与高SII组病人计数资料的比较(例) |
|
|
| 表 2 低、高SII两组病人计量资料的比较(M(Q25~Q75) |
|
|
至随访结束有65例病人死亡,其中男60例,女5例。低SII组病人术后1、2、3年生存率为92.5%、86.9%、82.4%,高SII组病人1、2、3年生存率分别为83.0%、66.0%、55.6%,差异有统计学意义(χ2=15.280,P < 0.01)(图 2A)。AFP≤400 μg/L的病人术后1、2、3年的生存率分别为92.7%、84.1%、76.6%,AFP>400 μg/L病人术后1、2、3年生存率分别为75.0%、55.5%、47.5%,两组比较差异有显著性(χ2=24.187,P < 0.01)(图 2B)。对AFP≤400 μg/L病人进行亚组分析,结果显示,低SII组具有更高的生存概率(χ2=16.091,P < 0.01)(图 3A),而在AFP>400 μg/L病人中SII分组未发现明显预测价值(图 3B)。
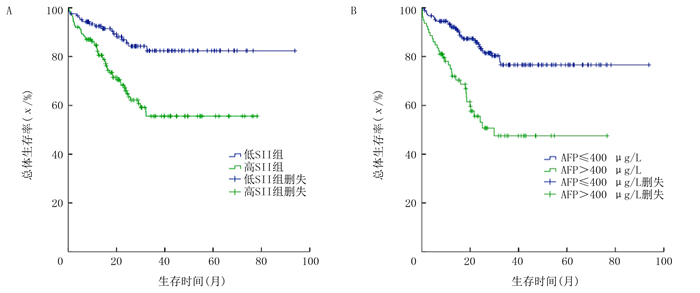 |
| A:低SII组和高SII组总体生存率比较;B:AFP≤400 μg/L组和AFP>400 μg/L组总体生存率比较。 图 2 按SII和AFP分组病人总体生存率比较 |
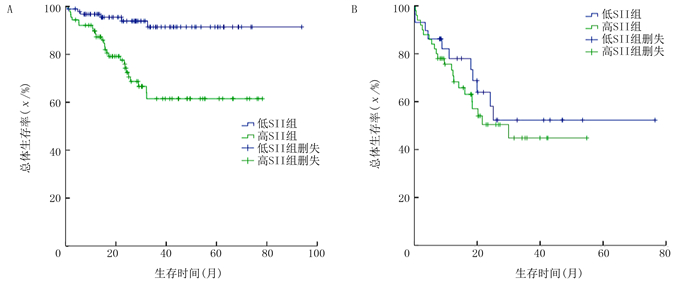 |
| A:AFP≤400 μg/L;B:AFP>400 μg/L。 图 3 按AFP分组病人不同SII亚组的总体生存率比较 |
单因素分析显示,AFP、Child-Pugh分级、术中失血量、TBil、AST、GGT、ALP、病理分化类型、最大肿瘤直径、移植标准、MVI和SII对肝细胞癌病人肝移植术后的生存有影响(B=0.002~1.300,P < 0.05)。将单因素分析中差异有统计学意义的指标纳入Cox风险比例回归模型分析显示,术前AFP>400 μg/L(HR=1.756, 95%CI=1.026~3.007, P < 0.05)、术中失血量≥2 000 mL(HR=2.530, 95%CI=1.468~4.359, P < 0.01)、病理分化Ⅲ~Ⅳ级(HR=1.975, 95%CI=1.085~3.594, P < 0.05)、MVI阳性(HR=2.367, 95%CI=1.277~4.388, P < 0.01)和SII≥211.09(HR=1.882, 95%CI=1.041~3.401, P < 0.05)是肝癌肝移植术后总体生存的独立危险因素。见表 3。
| 表 3 Cox多因素分析影响肝细胞癌肝移植预后的因素 |
|
|
既往有研究认为,SII可以预测实体恶性肿瘤的不良预后[6-9],然而鲜有文献探讨SII对肝细胞癌病人肝移植术后生存情况的预测价值。在我国肝细胞癌是一种炎症相关性肿瘤,大部分病人合并乙肝病毒感染[1-2]。多项研究表明,慢性炎症过程中产生的多种细胞因子能够促进肿瘤细胞增殖、侵袭和转移[4-5]。中性粒细胞通过炎症反应产生相关细胞因子破坏基因稳定性,导致基因突变从而致使肿瘤发生,并通过分泌血管内皮生长因子促进血管生成致使肿瘤增殖转移[10-11]。血小板黏附于肿瘤细胞形成保护层帮助肿瘤细胞逃脱免疫监视和杀伤作用,血小板还可分泌多种生长因子来刺激肿瘤细胞增殖、抑制肿瘤细胞凋亡。淋巴细胞具有抗肿瘤作用,其分泌的细胞因子可抑制肿瘤细胞增殖和迁移。SII升高的肿瘤病人往往处于抗肿瘤炎症失衡状态,预后情况较差[12]。本研究结果显示,SII < 211.09组病人较SII≥211.09组具有更高的生存率;多因素分析显示,SII是影响肝细胞癌肝移植受者生存的独立危险因素,SII≥211.09组病人死亡风险为SII < 211.09组的1.882倍,说明SII可以作为预测肝细胞癌病人肝移植预后的标志物,这与FU等[13]的研究结果一致。
探究影响肝移植受者术后生存的因素对肝细胞癌临床诊疗具有重要的指导价值。术前AFP水平是否影响肝移植受者的预后仍有争议,有研究认为术前高AFP水平的肝移植受者术后具有较高的复发率和死亡率[14-15],但也有研究认为AFP不是影响肝移植受者术后生存的因素[16]。本研究多因素分析显示,AFP>400 μg/L病人死亡风险为AFP≤400 μg/L组的1.756倍, AFP>400 μg/L是影响肝细胞癌肝移植受者预后的独立危险因素。本文研究AFP≤400 μg/L病人中,高SII组、低SII组病人移植术后的总体生存率差异有统计学意义,说明SII分组可以对AFP≤400 μg/L的肝细胞癌病人术后的死亡风险进行分层,对那些AFP不超过400 μg/L但位于高SII组的肝细胞癌病人需要引起重视,这或许可为临床医生决策AFP≤400 μg/L的肝癌病人肝移植的时机提供帮助。本研究结果还显示,术中失血量≥2 000 mL病人死亡风险为失血量 < 2 000 mL病人的2.530倍,术中失血量≥2 000 mL是影响肝移植受者术后生存的独立危险因素。原因可能与手术过程中缺血再灌注损伤有关。有研究表明,缺血再灌注损伤诱导肝细胞凋亡坏死引起移植物失功,是术后并发症和影响预后的独立危险因素之一[17]。
病理分化较差也是影响肝癌肝移植受者术后生存的独立危险因素之一[16]。本研究中高SII病人具有较差的肿瘤病理分化类型及较大的肿瘤直径,可能与慢性炎症过程中产生的多种细胞因子促进肿瘤细胞增殖、侵袭和转移有关[4-5], 进而表现为更差的病理分化和较大的肿瘤直径。肝纤维化本质上是各种原因对肝组织损伤的修复反应过程[18]。本文中低SII组和高SII组病人的肝纤维化分期差异有统计学意义,可能与肿瘤细胞及抗肿瘤炎症过程中释放的各种细胞因子、代谢产物等对肝组织长期损伤和自身修复有关。本文结果显示,MVI阳性肝移植受者术后死亡风险为MVI阴性者的2.367倍,MVI是影响肝细胞癌肝移植受者术后生存的独立危险因素,与既往研究结果一致[19]。
综上所述,术前AFP>400 μg/L、术中的失血量≥2 000 mL、病理分化Ⅲ~Ⅳ级、MVI阳性以及SII≥211.09是肝细胞癌肝移植受者预后的独立危险因素,SII对肝细胞癌肝移植受者术后生存情况有一定的预测价值,高SII组的预后较低SII组差。本研究为单中心回顾性研究,存在选择偏倚等不足,未来需要开展大样本量、多中心的、前瞻性的研究以证明本文结果的准确性。
| [1] |
中华人民共和国国家卫生健康委员会医政司. 原发性肝癌诊疗指南(2022年版)[J]. 肝癌电子杂志, 2022, 9(1): 1-22. |
| [2] |
郑树森, 徐骁, 陈峻, 等. 中国肝癌肝移植临床实践指南(2018版)[J]. 临床肝胆病杂志, 2019, 35(2): 275-280. DOI:10.3969/j.issn.1001-5256.2019.02.008 |
| [3] |
COHEN E N, GAO H, ANFOSSI S, et al. Inflammation mediated metastasis: immune induced epithelial-to-mesenchymal transition in inflammatory breast cancer cells[J]. PLoS One, 2015, 10(7): e0132710. DOI:10.1371/journal.pone.0132710 |
| [4] |
ELINAV E, NOWARSKI R, THAISS C A, et al. Inflammation-induced cancer: crosstalk between tumours, immune cells and microorganisms[J]. Nature Reviews Cancer, 2013, 13(11): 759-771. DOI:10.1038/nrc3611 |
| [5] |
DIAKOS C I, CHARLES K A, MCMILLAN D C, et al. Cancer-related inflammation and treatment effectiveness[J]. The Lancet Oncology, 2014, 15(11): e493-e503. DOI:10.1016/S1470-2045(14)70263-3 |
| [6] |
ISHIBASHI Y, TSUJIMOTO H, HIRAKI S, et al. Prognostic value of preoperative systemic immunoinflammatory measures in patients with esophageal cancer[J]. Annals of Surgical Oncology, 2018, 25(11): 3288-3299. DOI:10.1245/s10434-018-6651-y |
| [7] |
HONG X, CUI B H, WANG M, et al. Systemic immune-inflammation index, based on platelet counts and neutrophil-lymphocyte ratio, is useful for predicting prognosis in small cell lung cancer[J]. The Tohoku Journal of Experimental Medicine, 2015, 236(4): 297-304. DOI:10.1620/tjem.236.297 |
| [8] |
INOUE H, KOSUGA T, KUBOTA T, et al. Significance of a preoperative systemic immune-inflammation index as a predictor of postoperative survival outcomes in gastric cancer[J]. World Journal of Surgical Oncology, 2021, 19(1): 173. DOI:10.1186/s12957-021-02286-3 |
| [9] |
WU Y F, TU C Y, SHAO C X. Inflammatory indexes in preoperative blood routine to predict early recurrence of hepatocellular carcinoma after curative hepatectomy[J]. BMC Surgery, 2021, 21(1): 178. DOI:10.1186/s12893-021-01180-9 |
| [10] |
MANTOVANI A, ALLAVENA P, SICA A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [11] |
BONAVITA E, GALDIERO M R, JAILLON S, et al. Phagocytes as corrupted policemen in cancer-related inflammation[J]. Advances in Cancer Research, 2015, 128: 141-171. |
| [12] |
李健, 孟赛赛, 柏凯, 等. 系统免疫炎症指数与肝门部胆管癌患者术后预后的关系[J]. 中华肝胆外科杂志, 2021, 27(2): 106-109. DOI:10.3760/cma.j.cn113884-20200423-00226 |
| [13] |
FU H Y, ZHENG J, CAI J Y, et al. Systemic immune-inflammation index (SⅡ) is useful to predict survival outcomes in patients after liver transplantation for hepatocellular carcinoma within Hangzhou criteria[J]. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2018, 47(1): 293-301. DOI:10.1159/000489807 |
| [14] |
邵浙新, 徐骁, 郑树森, 等. 肝细胞癌患者肝移植术后甲胎蛋白的变化与肿瘤复发[J]. 中华普通外科杂志, 2006, 21(5): 351-353. DOI:10.3760/j.issn:1007-631X.2006.05.014 |
| [15] |
张笑时, 吕少诚, 潘飞, 等. 甲胎蛋白水平与肿瘤总体积比值对肝癌肝移植患者预后的影响[J]. 中华肝胆外科杂志, 2021, 27(3): 215-217. |
| [16] |
季家祥, 关鸽, 孙延东, 等. 肝细胞肝癌肝移植受者术后生存及肿瘤复发临床分析[J]. 中华移植杂志(电子版), 2020, 14(3): 143-148. |
| [17] |
CZIGANY Z, LURJE I, SCHMELZLE M, et al. Ischemia-reperfusion injury in marginal liver grafts and the role of hypothermic machine perfusion: molecular mechanisms and clinical implications[J]. Journal of Clinical Medicine, 2020, 9(3): E846. |
| [18] |
ZHU C H, QI X S, LI H Y, et al. Correlation of serum liver fibrosis markers with severity of liver dysfunction in liver cirrhosis: a retrospective cross-sectional study[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(4): 5989-5998. |
| [19] |
王建丰, 曾凯宁, 李海波, 等. 微血管侵犯对肝癌肝移植受者预后影响的临床研究[J]. 器官移植, 2021, 12(3): 309-316. |
 2023, Vol. 59
2023, Vol. 59

