糖尿病心肌病是糖尿病病人高死亡率的因素之一[1]。研究表明,高糖血症是糖尿病心肌病发生的始动因素[2],高糖血症能够促进活性氧(ROS)过度释放,进而通过诱导心肌细胞凋亡而引起糖尿病心肌损伤[3]。心肌细胞凋亡和糖尿病心肌病的发生存在密切关系[4-5]。但高糖诱导引起心肌细胞凋亡的具体分子机制尚不清楚。具有半胱天冬酶募集域的凋亡抑制因子(ARC)是一种在心脏和骨骼肌中高表达并具有高效抑制凋亡作用的内源性多功能蛋白[6-7]。ARC具有很强的心脏保护功能,而这种保护功能主要体现在其对凋亡性心肌细胞的抑制[8]。有研究结果显示,心肌细胞中ARC参与调控多种心血管疾病的发生发展,比如心肌梗死、心脏缺血再灌注损伤和心肌肥大[9-11]。还有研究显示,ARC在阿霉素诱导的心肌细胞凋亡过程中发挥着抑制作用[12],在心脏缺血再灌注损伤诱导的心肌细胞程序性坏死中ARC也有强保护作用[13]。同时有研究显示,ARC可以抑制线粒体凋亡途径引起的细胞死亡[10]。P53在调节细胞死亡过程中起到重要作用。P53通过与死亡相关的蛋白相互作用或作为转录因子调控基因表达来促进细胞死亡[14]。有研究显示,P53可以促进线粒体呼吸导致的活性氧生成和脂质积累过多导致的糖尿病心脏功能障碍[15];靶向抑制P53可以有效预防糖尿病心肌病[16];P53可以结合ARC的启动子区域并在凋亡开始时在转录水平上降低其表达[17]。但P53是否可以通过调控ARC的表达调节糖尿病心肌病的发生发展有待研究。既往有研究发现,在糖尿病性心肌病模型中敲低ARC会引起心肌细胞焦亡,这表明ARC可以通过抑制高糖诱导的炎性因素来保护心脏[18]。但ARC是否可以通过抑制心肌细胞凋亡抑制糖尿病心肌病的发展尚不清楚。本文研究检测了ARC对高糖诱导的H9c2细胞凋亡的影响,并观察过表达ARC对ROS和线粒体膜电位的影响,进一步探讨ARC影响高糖诱导的H9c2细胞凋亡的机制。
1 材料与方法 1.1 实验材料大鼠心肌细胞(H9c2细胞)、人胚胎肾细胞293(HEK293细胞)为本实验室之前所有,在液氮中冻存;DMEM高糖培养液、胎牛血清和胰酶购自美国Gibico公司;RIPA裂解液购自上海雅酶生物科技有限公司;ARC抗体购自美国CST公司;p53抗体购自英国Abcam公司;链脲佐菌素(STZ)购自西格玛奥德里奇(上海)贸易有限公司;Tunel细胞凋亡检测试剂盒(FITC)购自上海翊圣生物科技有限公司;caspase3/7活性检测试剂盒以及线粒体膜电位检测试剂盒购自大连美仑生物技术有限公司;抗氧化剂N-乙酰半胱氨酸(NAC)购自上海碧云天生物技术有限公司;ROS检测试剂盒购自北京索莱宝生物技术有限公司;腺病毒ARC(Ad-ARC)、腺病毒h-半乳糖苷酶(Ad-β-gal)、腺病毒si-ARC(Ad-si-ARC)、腺病毒scr-ARC(Ad-scr-ARC)、腺病毒si-p53(Ad-si-p53)和腺病毒scr-p53 (Ad-scr-p53)为本实验室之前合成[17]。
1.2 实验方法 1.2.1 细胞培养H9c2细胞和HEK293细胞在含有体积分数0.10胎牛血清的DMEM高糖培养液中,置于37 ℃、含体积分数0.05 CO2的细胞培养箱中培养,取对数生长期细胞用于后续实验。
1.2.2 实验分组及处理以高糖(50 mmol/L)处理的H9c2细胞为HG组,正常培养的细胞作为正常对照组(C组)。高糖处理0、3、6、12、24 h的H9c2细胞标记为C、3、6、12、24组。将腺病毒ARC、Ad-β-gal、Ad-si-ARC、Ad-scr-ARC、Ad-si-p53、Ad-scr-p53分别转染至H9c2细胞中,作为Ad-ARC组、Ad-β-gal组、Ad-si-ARC组、Ad-scr-ARC组、Ad-si-p53组、Ad-scr-p53组;将腺病毒ARC、Ad-β-gal、Ad-si-ARC、Ad-scr-ARC、Ad-si-p53、腺病毒scr-p53分别转染至H9c2细胞中再进行高糖处理,作为HG+Ad-ARC组、HG+Ad-β-gal组、HG+Ad-si-ARC组、HG+Ad-scr-ARC组、HG+Ad-si-p53组、HG+Ad-scr-p53组。
1.2.3 腺病毒的扩增和感染HEK293细胞传代于10 cm细胞培养皿中,当细胞生长至占全板密度100%,加入腺病毒感染2~3 d,当细胞出现肉眼可见的空洞时收集细胞,于液氮中反复冻融3次后,12 000 r/min离心5 min,收集上清中更多的腺病毒,放于-80 ℃保存,用于后续实验。细胞换成无血清培养液后将腺病毒转染至细胞中,4 h后换成有血清培养液。
1.2.4 Western blot方法检测ARC和P53蛋白表达各组细胞处理后以RIPA裂解液提取蛋白,取20 μg蛋白溶液进行SDS-PAGE电泳,然后进行PVDF膜湿转(28 W、90 min),用50 g/L的脱脂奶粉溶液封闭1 h,分别加入ARC(1∶1 500)、p53(1∶1 500)和内参β-actin(1∶10 000)一抗,4 ℃过夜,TBST洗3次,加入二抗,室温孵育1 h,TBST洗3次,在蛋白凝胶成像仪上曝光拍照。应用ImageJ软件分析各条带的灰度值,结果以ARC/β-actin和P53/β-actin比值表示。
1.2.5 Tunel染色检测细胞凋亡率各组细胞使用预冷的PBS清洗3次,多聚甲醛固定细胞,固定完成后吸出多聚甲醛,用PBS洗3次,加入含体积分数0.20的TritonX-100通透处理10 min,吸出TritonX-100,用PBS洗2次,按照Tunel细胞凋亡检测试剂盒说明书进行操作,荧光显微镜下检测细胞凋亡。
1.2.6 caspase3/7活性检测收集各组细胞,用PBS洗3次,加入2.5 g/L胰酶消化后收集细胞于1.5 mL离心管中,应用酶标仪检测各组相对于C组的caspase3/7活性,按caspase 3/7活性测定试剂盒说明书操作。
1.2.7 ROS检测在6孔板中常规培养H9c2细胞,当细胞生长至占全板密度50%时,加入腺病毒ARC感染细胞24 h,再换成高糖(50 mmol/L)含血清的培养液继续培养36 h,应用荧光显微镜检测各组的ROS水平,按照ROS检测试剂盒说明书操作。
1.2.8 线粒体膜电位检测在6孔板中常规培养H9c2细胞,当细胞密度达到50%左右时,加入腺病毒感染细胞24 h,换成含体积分数0.10血清的高糖(50 mmol/L)培养液继续培养36 h后,应用荧光显微镜检测各组线粒体膜电位,根据线粒体膜电位检测试剂盒说明书操作。
1.2.9 小鼠心肌组织ARC蛋白表达检测6周龄雄性C57BL/6J小鼠10只(购自北京维通利华实验动物技术有限公司),饲养在环境控制的繁殖室中(温度(20±2) ℃,湿度(60±5)%,12 h/12 h昼夜循环),自由饮水。随机分为健康对照组和链脲佐菌素组(STZ组),每组5只。STZ组腹腔注射STZ 120 mg/kg(柠檬酸盐缓冲液溶解,pH值4.5)建立糖尿病小鼠模型[19]。连续注射STZ 3 d后,尾静脉采血测定小鼠的空腹血糖,连续2次血糖水平>16.7 mmol/L诊断为糖尿病小鼠模型造模成功。健康对照组小鼠腹腔注射等量的生理盐水。造模成功后10周断颈处死小鼠,取心脏,常规方法提取蛋白,Western blot方法检测ARC蛋白表达。
1.3 统计学处理采用GraphPad Prism软件进行统计学处理。计量资料结果以x±s表示,两组数据间比较采用t检验;多组数据间比较采用one-way ANOVA检验,继以Tukey’s多重对比法进行两两比较。以P < 0.05为差异具有统计学意义。
2 结果 2.1 STZ诱导糖尿病小鼠心肌组织ARC及高糖诱导的H9c2细胞中ARC、P53的表达Western blot检测显示,健康对照组和STZ组小鼠心肌组织ARC蛋白的相对表达量分别为1.21±0.07和0.76±0.08,两组比较差异有显著性(t=7.507,P < 0.05)(图 1A)。H9c2细胞C组的ARC和P53蛋白相对表达量分别为1.69±0.05和0.90±0.02;高糖处理3、6、12、24 h后,ARC的蛋白相对表达量分别降低至1.04±0.03、0.87±0.03、0.75±0.02、0.60±0.01(n=3,F=612.9, P < 0.05),P53的蛋白相对表达量分别升高至0.92±0.04、0.96±0.08、1.00±0.06、1.13±0.05(n=3,F=8.0,P < 0.05)。ARC的表达量随着高糖诱导时间的增加而降低,24 h降低最明显(q=45.01,P < 0.05);而P53的表达量随着高糖诱导时间的增加而增加,24 h增加最明显(q=5.07,P < 0.05)(图 1B)。
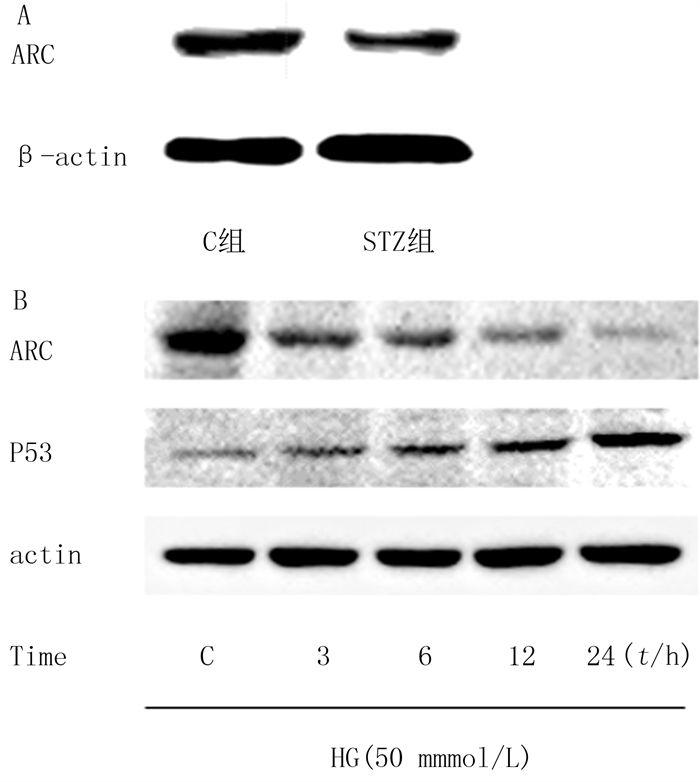 |
| A:STZ诱导糖尿病小鼠心肌组织ARC表达;B: 高糖诱导不同时间H9c2细胞中ARC、P53表达。 图 1 STZ诱导糖尿病小鼠心肌组织ARC及高糖诱导的H9c2细胞中ARC、P53表达的Western blot检测 |
为了探讨ARC在高糖诱导的H9c2细胞中的作用,本研究构建了ARC敲低的腺病毒(图 2A)。Western blot结果显示, C组、Ad-scr组和Ad-ARC-siR-NA组H9c2细胞的ARC蛋白的相对表达水平分别为1.17±0.01、1.17±0.02和0.68±0.01,与Ad-scr组相比,Ad-ARC-siRNA组H9c2细胞ARC蛋白表达水平降低(F=1 049.0,t=34.12,P < 0.05)。Tunel染色结果显示,与C组比较,HG组H9c2细胞的凋亡率明显增加(图 2B),HG+Ad-si-ARC组的H9c2细胞凋亡率较HG+Ad-scr-ARC组更高(F=807.2,t=17.04,P < 0.05)。与C组比较,HG组H9c2细胞的caspase3/7活性增加,HG+Ad-si-ARC组H9c2细胞的caspase3/7活性较HG+Ad-scr-ARC组更高(F=290.8,t=5.86,P < 0.05)。敲低ARC可以增强高糖诱导的H9c2细胞凋亡及caspase3/7活性。见表 1和图 2。
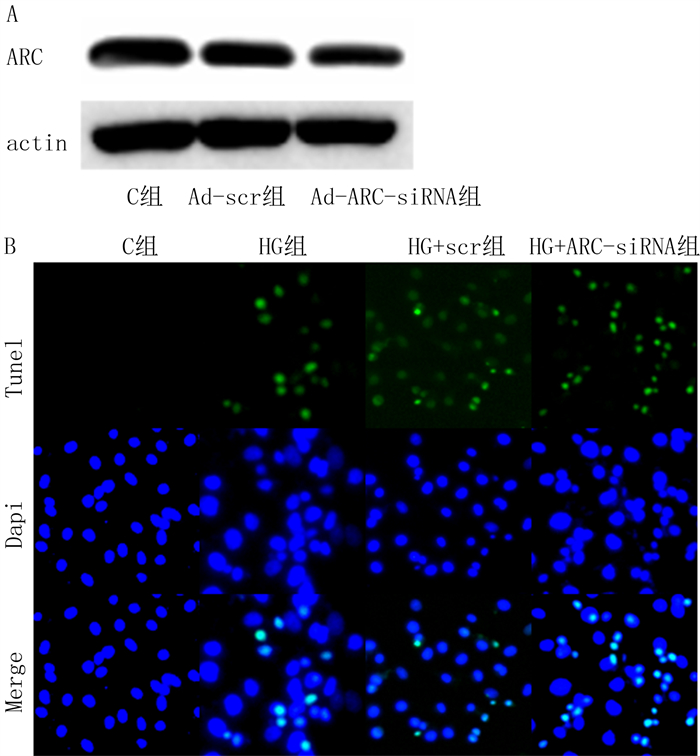 |
| A:Western blot检测各组H9c2细胞中ARC表达;B:Tunel染色检测各组H9c2细胞经高糖处理36 h细胞凋亡数。20倍。 图 2 敲低ARC对高糖诱导的H9c2细胞凋亡的影响 |
| 表 1 敲低ARC后高糖诱导的H9c2细胞凋亡率和caspase3/7活性比较(n=3,x±s) |
|
|
Western blot检测结果显示,C组、Ad-β-gal组和Ad-ARC组H9c2细胞ARC的蛋白相对表达水平分别为0.87±0.02、0.95±0.03和1.16±0.02,各组比较差异有显著性(F=155.9, P < 0.05),与Ad-β-gal组相比,Ad-ARC组H9c2细胞ARC蛋白表达水平升高(t=11.53,P < 0.05)。Tunel染色结果显示,与HG+Ad-β-gal组相比较,HG+Ad-ARC组H9c2细胞的凋亡率(图 3B)明显减少(F=480.6,t=15.55,P < 0.05);与HG+Ad-β-gal组比较,HG+Ad-ARC组H9c2细胞的caspase3/7活性(图 3C)明显减少(F=229.5,t=6.66,P < 0.05)。过表达ARC可以抑制高糖诱导的H9c2细胞凋亡及caspase3/7活性。见表 2。
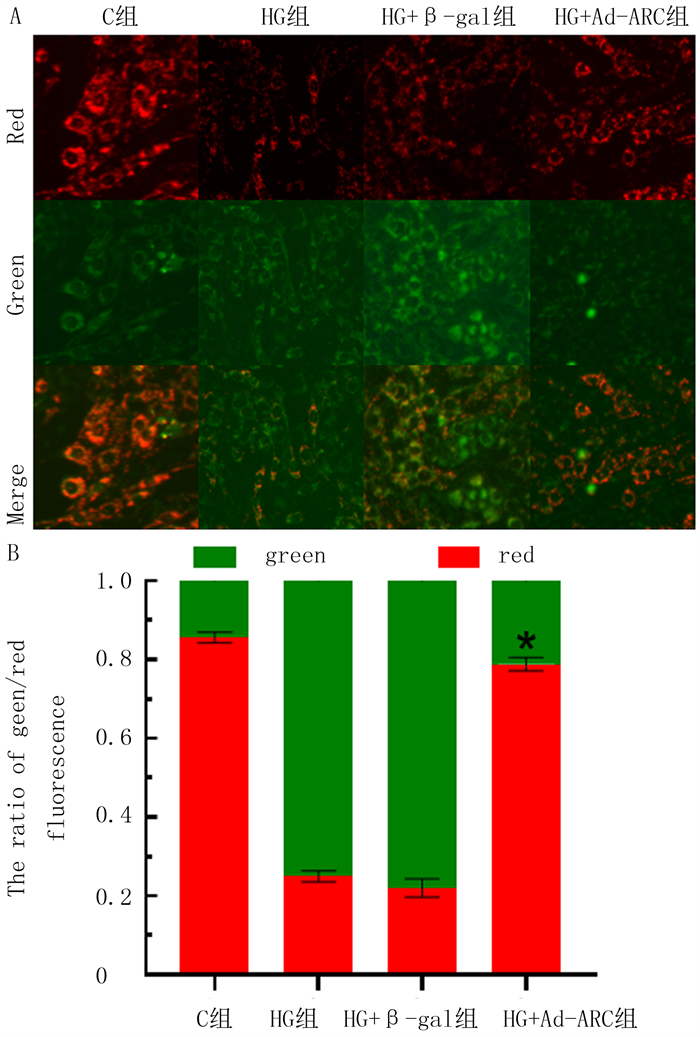 |
| A:荧光显微镜检测Ad-β-gal、Ad-ARC腺病毒转染H9c2细胞,经高糖处理36 h后线粒体膜电位变化,绿色荧光增加代表膜电位减少,红色荧光增加代表膜电位增高;B:用绿色和红色荧光对线粒体膜电位定量,红色荧光减少代表线粒体膜电位增加。 图 3 ARC对高糖引起的线粒体膜电位增高的影响 |
| 表 2 过表达ARC后各组H9c2细胞凋亡率以及caspase3/7活性比较(n=3,x±s) |
|
|
将C组的ROS水平设为1,HG组、HG+NAC组相对于C组的ROS水平分别为2.96±0.07、1.08±0.05。与C组相比,HG组的ROS水平增加,并且这种ROS水平的增加可以被抗氧化剂NAC清除(F=1 594.0,t=39.08,P < 0.05)。进一步检测显示,HG组、HG+Ad-β-gal组、HG+Ad-ARC组相对于C组的ROS水平分别为2.96±0.07、2.57±0.03、1.32±0.07,与HG+Ad-β-gal组相比,HG+Ad-ARC组的ROS水平减少(F=991.3,t=26.81,P < 0.05),说明过表达ARC可以抑制高糖引起的ROS水平增加。
2.5 过表达ARC对高糖引起的线粒体膜电位增高的影响对过表达ARC后线粒体膜电位红绿荧光比率分析显示,C组、HG组、HG+Ad-β-gal组、HG+Ad-ARC组的红色荧光占总荧光的比值分别为0.86±0.01、0.25±0.01、0.22±0.02、0.79±0.02,与C组比,HG组的线粒体膜电位增加; 与HG+Ad-β-gal组相比,HG+Ad-ARC组的线粒体膜电位下降(F=1 153.0, t=34.38,P < 0.05)。提示过表达ARC可抑制高糖引起的线粒体膜电位增高。见图 3。
2.6 高糖诱导的H9c2细胞凋亡中P53对ARC的作用Western blot结果显示,C组、Ad-scr-p53组和Ad-si-p53组H9c2细胞P53蛋白相对表达量分别为1.18±0.02、1.17±0.04和0.68±0.06,各组间比较差异有显著性(F=164.4,P < 0.05);其中Ad-si-p53组H9c2细胞P53蛋白表达水平较Ad-scr-p53组降低(t=13.05,P < 0.05)。C组、HG组、HG+Ad-scr-p53组、HG+Ad-si-p53组的P53蛋白相对表达水平分别为0.84±0.02、1.32±0.05、1.33±0.06、0.53±0.06,ARC的蛋白相对表达水平分别为1.39±0.02、0.68±0.01、0.63±0.02、1.28±0.04。敲低p53表达可恢复高糖引起的ARC的减少(F=780.4, t=24.78,P < 0.05)。C组、HG组、HG+Ad-scr-p53组、HG+Ad-si-p53组的caspase3/7活性分别为1.16±0.06、5.04±0.16、5.18±0.17、2.23±0.09,HG+Ad-si-p53组的caspase3/7活性较HG+Ad-scr-p53组显著降低,差异有统计学意义(F=725.8,t=26.00,P < 0.05)。表明P53在高糖诱导的H9c2细胞凋亡中参与调控ARC的表达。见图 4。
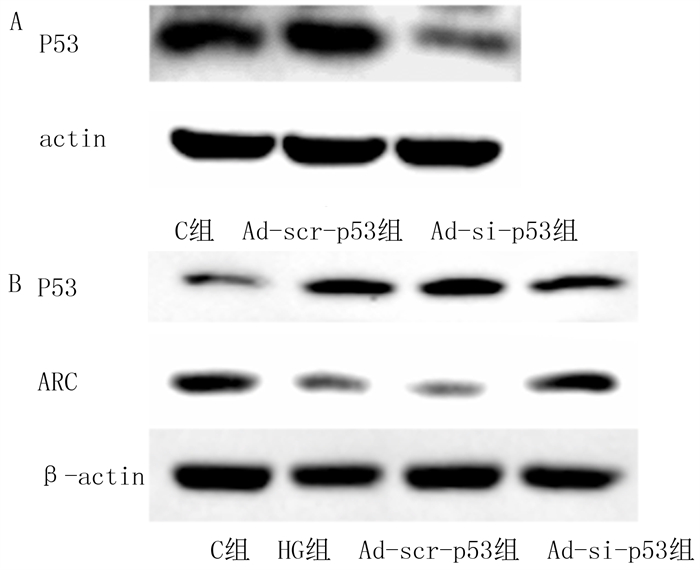 |
| A:转染Ad-si-p53、Ad-scr-p53腺病毒后H9c2细胞中P53表达;B:Ad-si-p53、Ad-scr-p53腺病毒转染后经高糖处理36 h各组P53、ARC的表达。 图 4 Western blot检测高糖诱导的H9c2细胞凋亡中P53对ARC的作用 |
抗凋亡蛋白ARC在心肌组织中高表达并有着很强的心脏保护功能[6-7]。ARC具有两个功能域CARD和P/E,其中CARD与caspase的CARDS、caspase接头蛋白RAIDD和凋亡蛋白酶激活因子-1(Apaf-1)具有高度同源性[6]。研究显示,ARC可以与caspase家族及其受体蛋白相互作用调节细胞凋亡,还可以维持线粒体膜电位的稳定并减少线粒体中活性氧的释放[10]。更加有趣的是,ARC可以通过抑制淀粉样蛋白诱导的JNK途径的激活和凋亡来减少2型糖尿病中胰岛β细胞的丢失,这意味着ARC有防治糖尿病的潜力。本文试图找到ARC在高糖诱导的H9c2细胞中是否存在着未被发现的保护途径。心肌细胞凋亡的增加是糖尿病心肌病发展过程中的一个重要病理表现,细胞凋亡的增加会对心脏的结构功能造成很大的损害,找到抑制心肌细胞凋亡的新方法十分必要,抑制心肌细胞凋亡也成为预防和治疗糖尿病心肌病的重要研究方向。
本文首先检测了糖尿病小鼠心脏中ARC的表达,结果显示,与健康对照组相比,STZ组ARC蛋白表达降低。接着我们在细胞水平进行验证,结果显示,与对照组相比,HG组H9c2细胞的ARC蛋白水平明显下降;Tunel染色和caspase3/7活性检测显示,与对照组相比较,HG组H9c2细胞凋亡率和caspase3/7活性增加,HG+Ad-si-ARC组H9c2细胞的凋亡率和caspase3/7活性较HG+Ad-scr-ARC组更高,而HG+Ad-ARC组H9c2细胞凋亡率和caspase3/7活性较HG+Ad-β-gal组降低,提示敲低ARC可促进高糖诱导的心肌细胞凋亡,ARC过表达可抑制高糖诱导的心肌细胞凋亡,ARC可以有效地抑制高糖诱导的H9c2细胞凋亡。本文结果还显示,与C组比,HG组的ROS水平和线粒体膜电位增加;与HG+Ad-β-gal组相比,HG+Ad-ARC组的ROS水平和线粒体膜电位下降,提示过表达ARC可以有效抑制高糖诱导引起的ROS水平和线粒体膜电位的增加,这表明ARC可以通过线粒体途径调控高糖诱导的心肌细胞凋亡。p53是一种肿瘤抑制基因,已有研究显示,p53可以通过转录调控抑制ARC表达[17],但在糖尿病心肌病模型中该发现并未被证实。本文Western blot检测结果显示,与HG+Ad-scr-p53组相比,HG+Ad-si-p53组的ARC蛋白表达增高,表明在高糖诱导的心肌细胞凋亡中P53参与调控ARC的表达。
综上所述,ARC通过线粒体途径抑制高糖诱导的心肌细胞凋亡,P53可以调控ARC并抑制其表达。本研究结果为糖尿病心肌病的治疗提供了新的靶点。
| [1] |
CHAVALI V, TYAGI S C, MISHRA P K. Predictors and prevention of diabetic cardiomyopathy[J]. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy, 2013, 6: 151-160. |
| [2] |
梁国标, 郭润民, 吴铿. 氧化应激与自噬相互作用在糖尿病心肌病发病中的研究现状[J]. 2016, 13(32): 132-135, 136.
|
| [3] |
CHEN J F, GUO R M, YAN H, et al. Naringin inhibits ROS-activated MAPK pathway in high glucose-induced injuries in H9c2 cardiac cells[J]. Basic & Clinical Pharmacology & Toxicology, 2014, 114(4): 293-304. DOI:10.3969/j.issn.1673-5412.2014.04.008 |
| [4] |
FRUSTACI A, KAJSTURA J, CHIMENTI C, et al. Myocardial cell death in human diabetes[J]. Circulation Research, 2000, 87(12): 1123-1132. DOI:10.1161/01.RES.87.12.1123 |
| [5] |
HE C Y, ZHU H P, LI H L, et al. Dissociation of Bcl-2-Beclin1 complex by activated AMPK enhances cardiac autophagy and protects against cardiomyocyte apoptosis in diabetes[J]. Diabetes, 2013, 62(4): 1270-1281. DOI:10.2337/db12-0533 |
| [6] |
KOSEKI T, INOHARA N, CHEN S, et al. ARC, an inhibitor of apoptosis expressed in skeletal muscle and heart that interacts selectively with caspases[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(9): 5156-5160. DOI:10.1073/pnas.95.9.5156 |
| [7] |
STOSS O, SCHWAIGER F W, COOPER T A, et al. Alternative splicing determines the intracellular localization of the novel nuclear protein Nop30 and its interaction with the splicing factor SRp30c[J]. The Journal of Biological Chemistry, 1999, 274(16): 10951-10962. DOI:10.1074/jbc.274.16.10951 |
| [8] |
DONATH S, LI P F, WILLENBOCKEL C, et al. Apoptosis repressor with caspase recruitment domain is required for cardioprotection in response to biomechanical and ischemic stress[J]. Circulation, 2006, 113(9): 1203-1212. DOI:10.1161/CIRCULATIONAHA.105.576785 |
| [9] |
EKHTERAE D, HINMON R, MATSUZAKI K, et al. Infarction induced myocardial apoptosis and ARC activation[J]. The Journal of Surgical Research, 2011, 166(1): 59-67. DOI:10.1016/j.jss.2009.05.002 |
| [10] |
LUDWIG-GALEZOWSKA A H, FLANAGAN L, REHM M. Apoptosis repressor with caspase recruitment domain, a multifunctional modulator of cell death[J]. Journal of Cellular and Molecular Medicine, 2011, 15(5): 1044-1053. DOI:10.1111/j.1582-4934.2010.01221.x |
| [11] |
MURTAZA I, WANG H X, FENG X, et al. Down-regulation of catalase and oxidative modification of protein kinase CK2 lead to the failure of apoptosis repressor with caspase recruitment domain to inhibit cardiomyocyte hypertrophy[J]. The Journal of Biological Chemistry, 2008, 283(10): 5996-6004. DOI:10.1074/jbc.M706466200 |
| [12] |
WANG J X, ZHANG X J, FENG C, et al. MicroRNA-532-3p regulates mitochondrial fission through targeting apoptosis repressor with caspase recruitment domain in doxorubicin cardiotoxicity[J]. Cell Death & Disease, 2015, 6: e1677. DOI:10.1038/cddis.2015.41 |
| [13] |
XU T, DING W, AO X, et al. ARC regulates programmed necrosis and myocardial ischemia/reperfusion injury through the inhibition of mPTP opening[J]. Redox Biology, 2019, 20: 414-426. DOI:10.1016/j.redox.2018.10.023 |
| [14] |
WHELAN R S, KAPLINSKIY V, KITSIS R N. Cell death in the pathogenesis of heart disease: mechanisms and significance[J]. Annual Review of Physiology, 2010, 72: 19-44. DOI:10.1146/annurev.physiol.010908.163111 |
| [15] |
NAKAMURA H, MATOBA S, IWAI-KANAI E, et al. p53 promotes cardiac dysfunction in diabetic mellitus caused by excessive mitochondrial respiration-mediated reactive oxygen species generation and lipid accumulation[J]. Circulation Heart Failure, 2012, 5(1): 106-115. DOI:10.1161/CIRCHEARTFAILURE.111.961565 |
| [16] |
GU J L, WANG S D, GUO H, et al. Inhibition of p53 prevents diabetic cardiomyopathy by preventing early-stage apoptosis and cell senescence, reduced glycolysis, and impaired angiogenesis[J]. Cell Death & Disease, 2018, 9(2): 82. |
| [17] |
LI Y Z, LU D Y, TAN W Q, et al. p53 initiates apoptosis by transcriptionally targeting the antiapoptotic protein ARC[J]. Molecular and Cellular Biology, 2008, 28(2): 564-574. DOI:10.1128/MCB.00738-07 |
| [18] |
LI X, DU N, ZHANG Q, et al. MicroRNA-30d regulates cardiomyocyte pyroptosis by directly targeting foxo3a in diabetic cardiomyopathy[J]. Cell Death & Disease, 2014, 5: e1479. |
| [19] |
RHEE K J, LEE C G, KIM S W, et al. Extract of Ginkgo biloba ameliorates streptozotocin-induced type 1 diabetes mellitus and high-fat diet-induced type 2 diabetes mellitus in mice[J]. International Journal of Medical Sciences, 2015, 12(12): 987-994. DOI:10.7150/ijms.13339 |
 2022, Vol. 58
2022, Vol. 58

