2. 青岛大学医学部, 山东 青岛 266555;
3. 青岛大学附属医院急诊内科, 山东 青岛 266555
侵袭性淋巴瘤主要包括弥漫大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)、外周T细胞淋巴瘤(PTCL)、结外NK/T细胞淋巴瘤(ENKTL)、伯基特淋巴瘤等常见亚型,在国内外的发病率逐年攀升[1]。早期诊断和预后分层判断对于该病治疗方案的选择、疾病进程的控制以及改善预后生存有着十分重要的意义,临床评估模型的应用在其中发挥了十分重要的作用[2-3]。随着近些年各种治疗方案不断改进,特别是免疫治疗的逐渐推广,侵袭性淋巴瘤病人的生存率和生活质量得到很大提升,而现有的临床评估模型尚不能正确及时识别部分病人的疾病危险度,从而延误医师对病人病情的准确评估,仍需要更完善的分层方法[4]。有研究表明,血清铁蛋白(FERR)水平升高是侵袭性淋巴瘤病人的不良预后因素[5-7]。血清乳酸脱氢酶(LDH)水平在一定程度上代表机体肿瘤负荷,对判断侵袭性淋巴瘤预后有相当大的帮助。但两者联合检测对侵袭性淋巴瘤预后意义的相关研究甚少。本研究分析血清FERR和LDH水平对初治侵袭性淋巴瘤病人生存的影响以及与其他临床因素之间的关系,探讨二者联合检测对预后的意义,以期更准确地鉴别不同危险分层病人,为后续诊疗方案选择及预后评价提供参考。
1 资料与方法 1.1 研究对象选取2014年1月—2021年3月就诊于我院的182例初治侵袭性淋巴瘤病人作为研究对象,其中DLBCL病人133例(73.1%),MCL 18例(9.9%),ENKTL 14例(7.7%),PTCL(纳入血管免疫母细胞性T细胞淋巴瘤和PTCL未分类,二者的特征均为淋巴结受累)17例(9.3%)。男性90例(49.5%),女性92例(50.5%);中位年龄58岁(19~82岁);中位随访时间22个月(4~89个月)。根据细胞起源将病人分为B细胞淋巴瘤(DLBCL、MCL)和T细胞淋巴瘤(ENKTL、PTCL)。以病历追踪、电话联系的方式收集临床资料。
1.2 纳入及排除标准病人纳入标准:①符合淋巴瘤指南共识诊断标准[8-10],于我院经淋巴结穿刺或切除活检、组织病理学检查、免疫组织化学检测等首次确诊为DLBCL、MCL、ENKTL、PTCL;②基本资料完善,在首次治疗启动前1周内检测血清FERR、LDH水平,具备随访条件;③首次治疗方案为淋巴瘤指南共识推荐的一线标准方案[8-10];④取得病人知情同意。排除标准:①存在其他部位的实体肿瘤;②合并肝功能不全、肾功能不全、噬血细胞综合征、缺血性心脏病、免疫系统疾病、感染性疾病;③近3个月内使用影响铁代谢的药物。
1.3 生存及疗效评价分析血清FERR、LDH水平对初治侵袭性淋巴瘤病人总生存时间(OS)和无进展生存时间(PFS)的影响,其中OS定义为从诊断之日到任何原因死亡或末次随访的时间,PFS定义为从诊断之日至疾病复发、进展或末次随访的时间(以先发生者为准)。依据Lugano 2014评价标准进行疗效评估,分为病情进展(PD)、病情稳定(SD)、部分缓解(PR)和完全缓解(CR)[11]。治疗有效定义为达到CR或PR。
1.4 统计学分析应用SPSS 25.0软件进行统计学分析。计数资料以例数和百分比表示,组间比较采用卡方检验。以病人死亡或最后一次随访为终点,绘制FERR、LDH两者单独检测以及联合检测与病人预后的受试者工作特征(ROC)曲线,并分析血清FERR和LDH水平判断病人预后的灵敏度和特异度,计算曲线下面积(AUC),计算约登指数确定血清FERR和LDH的最佳截断值。影响初治侵袭性淋巴瘤病人预后的单因素分析采用Log-rank检验;生存曲线用Kaplan-Meier法绘制,采用对数秩检验比较不同分组病人OS、PFS的差异。多因素分析采用Cox比例风险模型,纳入单因素分析有统计学意义的变量及可能对生存结果有较大影响的变量,变量筛选采用前进法。P < 0.05认为差异具有显著性。
2 结果 2.1 截断值确定和分组ROC曲线分析结果显示,血清FERR单独检测的AUC为0.708(95%CI=0.608~0.807,P < 0.001),对应的截断值为376.75 μg/L,灵敏度为0.838,特异度为0.537;血清LDH单独检测的AUC为0.644(95%CI=0.545~0.742,P=0.007),对应的截断值为295 U/L,灵敏度为0.730,特异度为0.591;血清FERR、LDH联合检测的AUC为0.771(95%CI=0.672~0.869,P < 0.001),灵敏度为0.814,特异度为0.717。血清FERR、LDH联合检测的AUC高于两者单独检测的AUC。见图 1。根据截断值,将182例病人分为高FERR高LDH组(47例)、低FERR低LDH组(67例)和其他组(68例,包括低FERR高LDH组42例和高FERR低LDH组26例)。
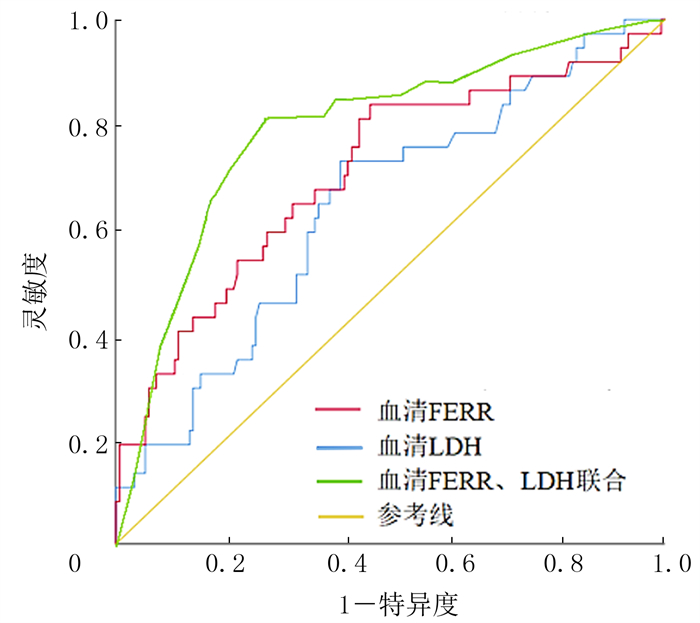 |
| 图 1 初治侵袭性淋巴瘤病人血清FERR、LDH与预后的ROC曲线 |
高FERR高LDH组病人与另外两组相比,Ann Arbor分期为Ⅲ~Ⅳ期、存在B症状、IPI评分3~5分、贫血、血小板减少、β2微球蛋白水平升高、血清清蛋白水平降低者所占比例更高,差异有统计学意义(χ2=6.200~11.522,P < 0.05)。见表 1。
| 表 1 初治侵袭性淋巴瘤病人血清FERR、LDH水平与一般临床特征的关系(例(χ/%)) |
|
|
高FERR高LDH组、其他组和低FERR低LDH组治疗有效率分别为68.1%(32/47)、88.2%(60/68)和95.5%(64/67),高FERR高LDH组的治疗有效率明显低于另外两组,差异具有统计学意义(χ2=17.546,P < 0.001)。
2.4 预后影响因素分析单因素分析结果显示,Ann Arbor分期、B症状、ECOG评分、IPI评分、血清FERR水平、血清LDH水平、血红蛋白、β2微球蛋白、D-二聚体与病人的OS、PFS相关,差异有统计学意义(χ2=4.823~36.883,P < 0.05)。见表 2。多因素分析显示,IPI评分3~5分、血清FERR≥376.75 μg/L是影响初治侵袭性淋巴瘤病人OS的独立危险因素,年龄 > 60岁、IPI评分3~5分、血清FERR≥376.75 μg/L是影响初治侵袭性淋巴瘤病人PFS的独立危险因素。见表 3、4。
| 表 2 影响初治侵袭性淋巴瘤病人预后的单因素分析 |
|
|
| 表 3 多因素分析变量赋值表 |
|
|
| 表 4 影响初治侵袭性淋巴瘤病人预后的多因素Cox分析 |
|
|
在所有的初治侵袭性淋巴瘤病人中,高血清FERR病人的OS及PFS明显短于低血清FERR病人(中位OS分别为48和77个月,χ2=12.251,P < 0.001;中位PFS分别为16和48个月,χ2=30.750,P < 0.001);高血清LDH病人的OS及PFS明显短于低血清LDH病人(中位OS分别为46个月和未达到,χ2=16.256,P < 0.001;中位PFS分别为18和39个月,χ2=17.914,P < 0.001)。见图 2、3。在B细胞淋巴瘤病人中,高血清FERR病人的OS及PFS明显短于低血清FERR病人(中位OS分别为48和77个月,χ2=7.162,P=0.007;中位PFS分别为17和52个月,χ2=26.718,P < 0.001),高血清LDH病人的OS及PFS明显短于低血清LDH病人(中位OS分别为48个月和未达到,χ2=13.593,P < 0.001;中位PFS分别为18和39个月,χ2=13.268,P < 0.001)。在T细胞淋巴瘤病人中,高血清FERR病人的OS及PFS明显短于低血清FERR病人(中位OS均未达到,χ2=6.968,P=0.008;中位PFS分别为10和31个月,χ2=4.428,P=0.035),高血清LDH病人的OS及PFS明显短于低血清LDH病人(中位OS分别为48个月和未达到,χ2=2.764,P=0.046;中位PFS分别为11和31个月,χ2=6.082,P=0.014)。
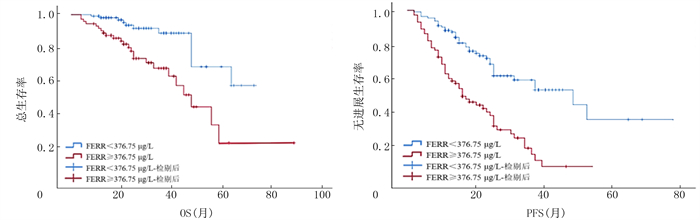 |
| 图 2 血清FERR对初治侵袭性淋巴瘤病人预后的影响 |
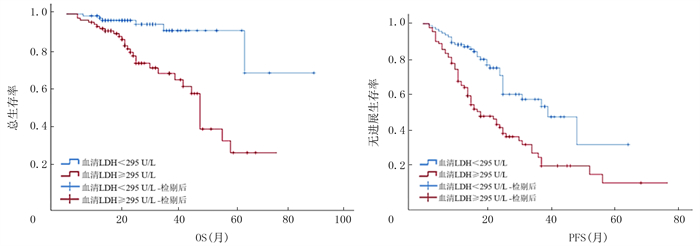 |
| 图 3 血清LDH对初治侵袭性淋巴瘤病人预后的影响 |
高FERR高LDH组、其他组以及低FERR低LDH组的中位OS分别为42、77和80个月,中位PFS分别为13、25和48个月,高FERR高LDH组的OS和PFS均明显短于另外两组,差异有统计学意义(χ2=30.568、40.759,P < 0.001)。见图 4。
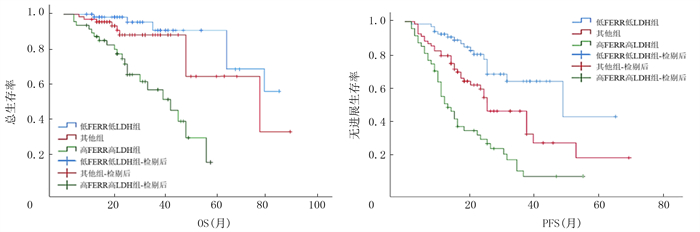 |
| 图 4 血清FERR和LDH不同表达水平各组初治侵袭性淋巴瘤病人的生存曲线 |
侵袭性淋巴瘤是一组淋巴系统恶性增殖性疾病,早期明确诊断和精确判断预后对于个体化治疗方案的选择、改善预后有着重要的意义[1, 12]。既往研究发现,许多临床因素与初治侵袭性淋巴瘤病人生存预后差有关,包括肿瘤体积大(直径≥10 cm)、FERR水平高、β2微球蛋白水平高、血清免疫球蛋白游离轻链水平升高、淋巴细胞计数与单核细胞计数比值(ALC/AMC)低、血清C反应蛋白水平升高等,这些因素在侵袭性淋巴瘤病人预后评估中起一定的作用[2, 7, 13-17]。为进一步探索对初治侵袭性淋巴瘤病人进行危险度分层的方法,本研究分析了我院182例初治侵袭性淋巴瘤病人的临床资料,分析血清FERR、LDH水平对初治侵袭性淋巴瘤病人生存的影响以及与其他临床因素的关系,探讨二者联合检测对预后的意义。
在没有铁储存过量的情况下,血清FERR水平可在炎症、感染性疾病、实体肿瘤以及血液系统恶性肿瘤等疾病中升高[18-22]。FERR在肿瘤相关的巨噬细胞中高水平表达,与肿瘤细胞增殖和治疗耐药有关[23-24]。已有研究证明,血清FERR水平升高是侵袭性淋巴瘤病人生存的不良预后因素[6-7, 25]。但在临床实践中仅使用血清FERR评估初治侵袭性淋巴瘤病人的预后有一定的局限性,因为病人的生存也受到机体肿瘤负荷水平的影响。LDH与肿瘤的免疫反应之间存在一定关系,能在一定程度上反映机体的肿瘤负荷程度[26-29]。血清LDH在侵袭性淋巴瘤病情评估中的作用已得到广泛研究,并被纳入多个侵袭性淋巴瘤临床预后评估模型中,既往研究已证实血清LDH水平升高是侵袭性淋巴瘤病人的预后不良因素[30-35]。
本研究根据血清FERR、LDH的截断值对初治侵袭性淋巴瘤病人进行分组,比较不同分组病人的临床特征及生存预后差异。血清FERR、LDH联合检测得到的AUC为0.771(95%CI=0.672~0.869),高于二者分别检测得到的AUC,且具有较高的特异度和灵敏度。血清FERR、LDH在侵袭性淋巴瘤发生发展过程中所起到的作用和反映的情况不同,两者联合检测可在一定程度上弥补分别检测的缺陷,预后价值更高。
KOYAMA等[6]研究分析了78例初治PTCL病人的临床资料,结果显示,血清FERR水平升高(以血清FERR的正常上限作为分界值)病人的4年总生存率显著低于血清FERR水平不升高病人(23% vs 72%),证明血清FERR水平是判断PTCL预后的有用指标。YAMAZAKI等[7]研究分析了35例ENKTL病人的临床资料,根据ROC曲线将血清FERR截断值界定为300 μg/L,与FERR不升高病人相比,FERR水平升高病人治疗后的CR率明显较低(82% vs 23%),OS明显较短。本研究根据ROC曲线将FERR截断值界定为376.75 μg/L,将血清LDH的截断值界定为295 U/L,分析血清FERR、LDH水平与疗效间的关系,结果显示,高FERR高LDH组治疗有效病人占比明显低于另外两组,差异具有显著意义,表明初治时血清FERR、LDH水平较高的侵袭性淋巴瘤病人治疗效果欠佳。高FERR高LDH组病人的OS、PFS均短于另外两组,表明初治时血清FERR、LDH水平较高的病人比水平低的病人预后更差。本研究不同分组间的ECOG评分比较差异无统计学意义,可能与纳入的病例整体ECOG评分较低有关。
YOH等[25]回顾性分析了267例非霍奇金淋巴瘤病人的资料,证实血清FERR升高(≥500 μg/L)、β2微球蛋白升高、IPI评分3~5分是影响病人5年OS和PFS的独立危险因素,可作为预测非霍奇金淋巴瘤预后不良的指标。本研究多因素分析结果显示,IPI评分3~5分、血清FERR≥376.75 μg/L是影响初治侵袭性淋巴瘤病人OS、PFS的独立危险因素,年龄 > 60岁是影响初治侵袭性淋巴瘤病人PFS的独立危险因素,表明IPI评分、年龄在预后评估中的作用仍不容忽视。血清LDH水平不是初治侵袭性淋巴瘤病人的独立预后因素,可能与本研究纳入病例数量有限、影响血清LDH水平的因素较多有关。
综上所述,血清FERR、LDH联合检测是判断初治侵袭性淋巴瘤病人预后的有用指标,两者均升高提示病人预后较差。但由于纳入的病例数量有限、随访时间较短,本研究结果还需要大样本量的随机对照研究进一步证实。
| [1] |
SWERDLOW S H, CAMPO E, PILERI S A, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127(20): 2375-2390. DOI:10.1182/blood-2016-01-643569 |
| [2] |
CHEN Y M, NEELAPU S, FENG L, et al. Prognostic significance of baseline peripheral absolute neutrophil, monocyte and serum β2-microglobulin level in patients with diffuse large B-cell lymphoma: a new prognostic model[J]. British Journal of Haematology, 2016, 175(2): 290-299. DOI:10.1111/bjh.14237 |
| [3] |
FEDERICO M, BELLEI M, MARCHESELLI L, et al. Peripheral T cell lymphoma, not otherwise specified (PTCL-NOS). A new prognostic model developed by the International T cell Project Network[J]. British Journal of Haematology, 2018, 181(6): 760-769. DOI:10.1111/bjh.15258 |
| [4] |
ZHOU Z, SEHN L H, RADEMAKER A W, et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era[J]. Blood, 2014, 123(6): 837-842. DOI:10.1182/blood-2013-09-524108 |
| [5] |
KIM D J, KIM T, JEONG J Y, et al. Poor prognostic impact of high serum ferritin levels in patients with a lower risk of diffuse large B cell lymphoma[J]. International Journal of Hematology, 2020, 111(4): 559-566. DOI:10.1007/s12185-019-02816-6 |
| [6] |
KOYAMA S, FUJISAWA S, WATANABE R, et al. Serum ferritin level is a prognostic marker in patients with peripheral T-cell lymphoma[J]. International Journal of Laboratory Hematology, 2017, 39(1): 112-117. DOI:10.1111/ijlh.12592 |
| [7] |
YAMAZAKI E, TOMITA N, KOYAMA S, et al. Serum ferritin level is prognostic of patient outcome in extranodal NK/T cell lymphoma, nasal type[J]. Medical Oncology (Northwood, London, England), 2014, 31(9): 149. DOI:10.1007/s12032-014-0149-7 |
| [8] |
中华医学会血液学分会, 中国抗癌协会淋巴瘤专业委员会. 中国弥漫大B细胞淋巴瘤诊断与治疗指南(2013年版)[J]. 中华血液学杂志, 2013, 34(9): 816-819. |
| [9] |
中国抗癌协会血液肿瘤专业委员会, 中华医学会血液学分会白血病淋巴瘤学组, 中国抗淋巴瘤联盟. 套细胞淋巴瘤诊断与治疗中国专家共识(2016年版)[J]. 中华血液学杂志, 2016, 37(9): 735-741. |
| [10] |
HORWITZ S M, ANSELL S M, AI W Z, et al. NCCN guidelines insights: T-cell lymphomas, version 2.2018[J]. Journal of the National Comprehensive Cancer Network: JNCCN, 2018, 16(2): 123-135. DOI:10.6004/jnccn.2018.0007 |
| [11] |
CHESON B D, FISHER R I, BARRINGTON S F, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2014, 32(27): 3059-3068. DOI:10.1200/JCO.2013.54.8800 |
| [12] |
中国抗癌协会淋巴瘤专业委员会, 中国医师协会肿瘤医师分会, 中国医疗保健国际交流促进会肿瘤内科分会. 中国淋巴瘤治疗指南(2021年版)[J]. 中华肿瘤杂志, 2021, 43(7): 707-735. |
| [13] |
PFREUNDSCHUH M, HO A D, CAVALLIN-STAHL E, et al. Prognostic significance of maximum tumour (bulk) diameter in young patients with good-prognosis diffuse large-B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab: an exploratory analysis of the MabThera International Trial Group (MInT) study[J]. The Lancet Oncology, 2008, 9(5): 435-444. DOI:10.1016/S1470-2045(08)70078-0 |
| [14] |
ZHAO P, ZANG L, ZHANG X Y, et al. Novel prognostic scoring system for diffuse large B-cell lymphoma[J]. Oncology Letters, 2018, 15(4): 5325-5332. |
| [15] |
WITZIG T E, MAURER M J, HABERMANN T M, et al. Elevated monoclonal and polyclonal serum immunoglobulin free light chain as prognostic factors in B- and T-cell non-Hodgkin lymphoma[J]. American Journal of Hematology, 2014, 89(12): 1116-1120. DOI:10.1002/ajh.23839 |
| [16] |
GAO F Q, HU J L, ZHANG J W, et al. Prognostic value of peripheral blood lymphocyte/monocyte ratio in lymphoma[J]. Journal of Cancer, 2021, 12(12): 3407-3417. DOI:10.7150/jca.50552 |
| [17] |
DI Q S, XU T, SONG Y, et al. High C-reactive protein to albumin ratio predicts inferior clinical outcomes in extranodal natural killer T-cell lymphoma[J]. Dose-Response: a Publication of International Hormesis Society, 2020, 18(2): 1559325820917824. |
| [18] |
KERNAN K F, CARCILLO J A. Hyperferritinemia and inflammation[J]. International Immunology, 2017, 29(9): 401-409. DOI:10.1093/intimm/dxx031 |
| [19] |
GRANGÉ S, BUCHONNET G, BESNIER E, et al. The use of ferritin to identify critically ill patients with secondary hemophagocytic lymphohistiocytosis[J]. Critical Care Medicine, 2016, 44(11): e1045-e1053. DOI:10.1097/CCM.0000000000001878 |
| [20] |
SONG A N, EO W, KIM S, et al. Significance of serum ferritin as a prognostic factor in advanced hepatobiliary cancer patients treated with Korean medicine: a retrospective cohort study[J]. BMC Complementary and Alternative Medicine, 2018, 18(1): 176. DOI:10.1186/s12906-018-2240-7 |
| [21] |
PARK J M, MAU C Z, CHEN Y C, et al. A case-control study in Taiwanese cohort and meta-analysis of serum ferritin in pancreatic cancer[J]. Scientific Reports, 2021, 11(1): 21242. DOI:10.1038/s41598-021-00650-7 |
| [22] |
FERNANDEZ-ALVAREZ R, GONZALEZ-RODRIGUEZ A P, GONZALEZ M E, et al. Serum ferritin as prognostic mar-ker in classical Hodgkin lymphoma treated with ABVD-based therapy[J]. Leukemia Lymphoma, 2015, 56(11): 3096-3102. DOI:10.3109/10428194.2015.1038709 |
| [23] |
ALKHATEEB A A, CONNOR J R. Nuclear ferritin: a new role for ferritin in cell biology[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2010, 1800(8): 793-797. DOI:10.1016/j.bbagen.2010.03.017 |
| [24] |
BURANRAT B, CONNOR J R. Cytoprotective effects of fer-ritin on doxorubicin-induced breast cancer cell death[J]. Oncology Reports, 2015, 34(5): 2790-2796. DOI:10.3892/or.2015.4250 |
| [25] |
YOH K A, LEE H S, PARK L C, et al. The prognostic significance of elevated levels of serum ferritin before chemotherapy in patients with non-Hodgkin lymphoma[J]. Clinical Lymphoma, Myeloma & Leukemia, 2014, 14(1): 43-49. |
| [26] |
LACROIX R, ROZEMAN E A, KREUTZ M, et al. Targeting tumor-associated acidity in cancer immunotherapy[J]. Cancer Immunology, Immunotherapy: CⅡ, 2018, 67(9): 1331-1348. DOI:10.1007/s00262-018-2195-z |
| [27] |
JURISIC V, RADENKOVIC S, KONJEVIC G. The actual role of LDH as tumor marker, biochemical and clinical aspects[J]. Advances in Experimental Medicine and Biology, 2015, 867: 115-124. |
| [28] |
SHEN Z Y, ZHANG S, ZHANG M, et al. The addition of ferritin enhanced the prognostic value of international prognostic index in diffuse large B-cell lymphoma[J]. Frontiers in Oncology, 2021, 11: 823079. |
| [29] |
FENG J, YANG H, ZHANG Y, et al. Tumor cell-derived lactate induces TAZ-dependent upregulation of PD-L1 through GPR81 in human lung cancer cells[J]. Oncogene, 2017, 36(42): 5829-5839. DOI:10.1038/onc.2017.188 |
| [30] |
LIU W P, SONG Y Q, ZHENG W, et al. Aggressive behavior and elevated lactate dehydrogenase at baseline confer inferior prognosis in patients with primary cutaneous lymphoma[J]. Clinical Lymphoma, Myeloma & Leukemia, 2013, 13(5): 534-540. |
| [31] |
YI J H, KIM J H, BAEK K K, et al. Elevated LDH and paranasal sinus involvement are risk factors for central nervous system involvement in patients with peripheral T-cell lymphoma[J]. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 2011, 22(7): 1636-1643. |
| [32] |
SUZUKI K, TERUI Y, NISHIMURA N, et al. Prognostic value of C-reactive protein, lactase dehydrogenase and anemia in recurrent or refractory aggressive lymphoma[J]. Japanese Journal of Clinical Oncology, 2013, 43(1): 37-44. |
| [33] |
KIM S J, HONG J S, CHANG M H, et al. Highly elevated serum lactate dehydrogenase is associated with central nervous system relapse in patients with diffuse large B-cell lymphoma: results of a multicenter prospective cohort study[J]. Oncotarget, 2016, 7(44): 72033-72043. |
| [34] |
AGUILAR C, LABERIANO C, BELTRAN B, et al. Clinico-pathologic characteristics and survival of patients with primary effusion lymphoma[J]. Leukemia Lymphoma, 2020, 61(9): 2093-2102. |
| [35] |
BOK R, LEE J, SRIRAM R, et al. The role of lactate meta-bolism in prostate cancer progression and metastases revealed by dual-agent hyperpolarized 13C MRSI[J]. Cancers (Basel), 2019, 11(2): 257. |
 2022, Vol. 58
2022, Vol. 58

