2. 临朐县卫生健康局医政科;
3. 青岛大学附属医院普外科
横纹肌溶解症是由多种病因引起的急性肌肉损伤,从而引发一系列临床并发症。其特点是横纹肌细胞损伤或破坏,肌红蛋白等肌细胞内容物外漏至血液中,引起生化紊乱及脏器功能损伤[1]。其临床表现缺乏特异性,可引起高钾血症、急性肾衰竭等严重并发症,甚至导致病人死亡[2-3],因此早期诊断尤为重要。横纹肌溶解症的诊断主要根据病史、病人临床表现以及血液中肌酸激酶、肌红蛋白水平的升高。肌酸激酶由受损的骨骼肌释放,其水平可超过正常上限值的5倍以上[4]。磁共振成像(MRI)具有较高的软组织分辨力,在评估受累肌肉的分布以及受累程度方面有重要价值。此外,MRI可以通过识别肌肉坏死帮助评估受损肌肉发生可逆或不可逆改变的可能性[5-6]。本研究回顾性分析经临床证实的8例横纹肌溶解症的MRI表现,并结合文献进行分析,旨在提高横纹肌溶解症的诊断水平。现将结果报告如下。
1 资料与方法 1.1 一般资料收集青岛大学附属医院2016年6月—2020年12月期间收治的横纹肌溶解症病例8例,其中男6例,女2例;年龄9~34岁,平均(23.75±11.67)岁。8例病人中,4例健身或剧烈活动后出现浓茶色尿,伴四肢酸痛,以双下肢为重,夜间较重;1例爬山后出现乏力,伴双下肢不适感,以双侧腓肠肌明显,适当休息后缓解,尿色深如茶色;1例挤压伤后出现臀部及双下肢疼痛;2例酗酒2 d后出现四肢酸痛伴发热。实验室检查:8例病人血清肌酸激酶浓度均升高,平均为(13.38±5.54)kU/L(正常值范围为50~310 U/L);血清肌红蛋白均升高,平均值为(4.59±4.12)mg/L(正常值范围25~58 μg/L)。病人于入院1~2 d内进行MRI检查。
1.2 MRI扫描采用GE Signa 1.5 T或3.0 T超导MRI扫描仪,行自旋回波SE-T1WI压水序列、自旋回波SE-T2WI序列以及STIR序列扫描, 并获取横轴位、冠状位以及矢状位图像。各序列主要扫描参数如下。SE-T1WI:TR 980 ms, TE 13.596 ms,层厚5 mm,层间距为1 mm;FSE-T2WI:TR 3 600 ms,TE 38 ms,层厚为5 mm,矩阵256×256;STIR:TR 5 260 ms,TE 42.48 ms,层厚5 mm。
2 结果 2.1 病变部位本文5例病人病变位于双侧大腿,主要累及双侧大腿前肌群;1例病人病变累及双侧大腿和小腿,主要累及双侧腓肠肌;1例病变累及双侧肩部及双侧大腿;1例病变累及臀部及双侧大腿。
2.2 MRI表现本文8例病人病变处MRI均表现为受累肌肉弥漫性肿胀,肌束紊乱,部分伴有皮下软组织水肿。T1WI表现:病变表现为等或稍低信号,不易与正常肌肉相区分,1例中可见小斑片状T1WI稍高信号;T2WI信号表现为斑片状、索条状不均匀高信号,边界受脂肪信号的影响而界定较为困难,但较T1WI显示病变范围清晰。STIR序列呈不均匀高信号,病变范围界定最为清晰。见图 1。
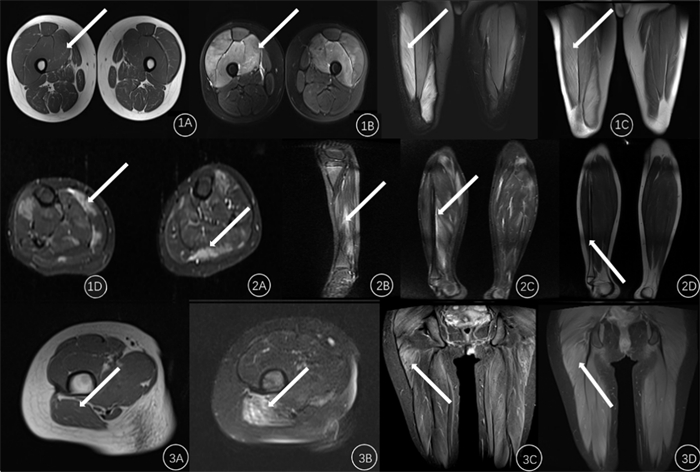 |
1A~1D:病人,男,27岁。因剧烈活动出现浓茶色尿,伴四肢酸痛,以双下肢为重,夜间较重,实验室检查尿潜血( ),尿胆原( ),尿胆原( ),尿蛋白(+)。1A为MRI横轴位T1WI序列,病变与周围正常肌肉组织信号相仿,分界不清;1B、1C分别为横轴位与冠状位STIR序列,以双侧大腿前组肌群为主要分布区的信号升高,与周围组织分界清;1D为冠状位T2WI序列,病变信号增高,与周围正常组织分界较清晰。2A~2D:病人,男34岁,因挤压伤后出现臀部及双下肢疼痛。2A为MRI横轴位STIR序列,病变呈散在多发斑片状高信号;2B、2C分别为矢状位与冠状位STIR序列,双侧大腿多处肌群受累,与周围组织分界清;2D为冠状位T1WI序列,病变信号与周围肌肉组织相仿,分界不清。3A~3D:病人,男,13岁,因剧烈活动出现肌痛,伴呕吐及浓茶色尿。3A为MRI横轴位T1WI序列,病变与周围正常肌肉组织信号相仿,受累区见小斑片状稍高信号;3B、3C分别为横轴位与冠状位STIR序列,以双侧大腿后组肌群为主要分布区的信号升高,与周围组织分界清;3D为冠状位T1WI序列,病变信号稍高,与周围正常组织分界欠清晰。箭头所示为病变信号。
图 1 横纹肌溶解症病人的MRI表现 ),尿蛋白(+)。1A为MRI横轴位T1WI序列,病变与周围正常肌肉组织信号相仿,分界不清;1B、1C分别为横轴位与冠状位STIR序列,以双侧大腿前组肌群为主要分布区的信号升高,与周围组织分界清;1D为冠状位T2WI序列,病变信号增高,与周围正常组织分界较清晰。2A~2D:病人,男34岁,因挤压伤后出现臀部及双下肢疼痛。2A为MRI横轴位STIR序列,病变呈散在多发斑片状高信号;2B、2C分别为矢状位与冠状位STIR序列,双侧大腿多处肌群受累,与周围组织分界清;2D为冠状位T1WI序列,病变信号与周围肌肉组织相仿,分界不清。3A~3D:病人,男,13岁,因剧烈活动出现肌痛,伴呕吐及浓茶色尿。3A为MRI横轴位T1WI序列,病变与周围正常肌肉组织信号相仿,受累区见小斑片状稍高信号;3B、3C分别为横轴位与冠状位STIR序列,以双侧大腿后组肌群为主要分布区的信号升高,与周围组织分界清;3D为冠状位T1WI序列,病变信号稍高,与周围正常组织分界欠清晰。箭头所示为病变信号。
图 1 横纹肌溶解症病人的MRI表现
|
横纹肌溶解症是一种由肌肉损伤引起的严重疾病,既往文献报道该病多见于男性青壮年,男性发病率约为72%[3]。本文中男性占比75%(6/8),平均年龄(24.83±12.75)岁。病人以男性为主,可能与年轻男性体力活动较女性频繁,因此其发病率增高。目前,临床上对于横纹肌溶解症的诊断主要基于典型的临床症状以及实验室检查结果,包括血清肌酸激酶及肌红蛋白水平测定。横纹肌溶解症的临床表现缺乏特异性,本文8例病人主要表现为剧烈肌痛、肌无力和浓茶样尿,未出现伴有骨筋膜间隔室综合征、急性肾衰竭等严重并发症。在实验室检查方面,本研究中病人血清肌酸激酶含量均超出正常范围的5倍以上,最高者含量达23.43 kU/L,与TORRES等[4]结果相似。
目前认为,横纹肌溶解症发生机制是多种物理和非物理因素共同作用的结果,如过度运动导致的肌肉劳损、药物、酗酒、挤压伤和体内代谢紊乱[4]。多种因素共同导致肌细胞膜损伤,使得肌细胞缺血低氧,ATP生成减少,进而影响Na+-K+-ATP酶和Ca2+-Na+交换;低钾血症、低钠血症导致Na+-K+泵转运Na+和K+功能降低,最终导致细胞内Ca2+超负荷,引起肌细胞溶解坏死,肌细胞内物质(如肌红蛋白、肌酸激酶、钾离子等)大量释放入血,导致肌红蛋白血症,出现肌红蛋白尿,这是横纹肌溶解症的最重要表现[7-8]。
对于软组织病变诊断通常采用MRI检查。既往研究显示,MRI诊断肌肉病变的灵敏度高于CT和超声检查(分别为100%、62%和42%)[8]。横纹肌溶解症的MRI表现为病变处肌肉弥漫性肿胀,范围广,境界欠清晰,T1WI信号降低,T2WI和STIR序列信号升高,内见片状、絮状不均匀信号。本研究中所有病人均可见肌群弥漫性水肿,边界模糊,分析其原因是由于病变组织细胞膜破坏导致Na+内流,同时伴随大量水内流,造成细胞水肿。DAS等[9]的研究也证实横纹肌溶解症合并急性肾衰竭病人有多达12 L(最多者可达15 L)的水进入细胞内,造成肌肉组织水肿。因此,当临床病史及MRI特点符合横纹肌溶解症表现时,可以提示诊断。本文研究MRI检查部分病灶内可见斑片状高低混杂的T1WI信号,可能是病变处于肌肉损伤的急性期,肌纤维变性、水肿及出血并存的共同结果,这与相关研究结果一致[10]。本研究中8例病人MRI检查STIR序列病变表现为不均匀高信号,病变范围界定清晰,优于T1WI及T2WI,考虑可能与病变处于不同时期及水分子聚集于细胞内或细胞外有关;而STIR图像在正常和异常肌肉之间可显示出良好的对比度,并且由于其具有脂肪抑制作用,受损肌肉与相邻脂肪之间的区分更好[11]。虽然本文研究病人未进行MR增强检查, 但有研究表明部分横纹肌溶解症病人MR增强可见病灶边缘出现环形强化,称为“stipple征”[12]。stipple征潜在的生物学假设是坏死肌纤维不会发生强化,提示组织缺乏灌注,可反映病变的缺血及坏死程度[13]。此外,磁共振血管造影(MRA)可提示受伤肢体血供情况,对病变的修复可提供有价值的参考[14]。
横纹肌溶解症应与以下疾病进行鉴别。①骨筋膜间隔室综合征:可以有与横纹肌溶解症相似的临床和影像学表现,如疼痛、受累肌肉肿胀、坏死和皮下水肿,但横纹肌溶解症不发生苍白、麻痹和瘫痪等症状,且本研究中病人血清肌酸激酶水平明显升高,有助于二者的区分。②肌筋膜炎:该病主要累及肌筋膜,在肌腱的附着点或肌腹上有固定疼痛区和压痛点,且病程较长,反复发作;MRI扫描可见肌间隙内线条状长T1长T2信号,局部肌肉萎缩;CT扫描有时可见软组织钙化[15]。③多发性肌炎/皮肌炎(PM/DM):为遗传因素和环境因素相互作用的自身免疫性疾病,其特征为慢性肌肉炎症,近端肌肉无力,皮疹和软组织钙化,还可发现弥漫性近端肌肉水肿。PM/DM的MRI表现为T1WI无明显变化或可见多发小片状等低信号,T2WI和STIR序列上可见斑片状、索条状异常高信号。皮肌炎往往主要累及股外侧肌、中间肌和内侧肌;而横纹肌溶解症病人几乎所有主要的下肢近端肌肉群均可受累[16]。本研究中5例病人病变主要累及双侧大腿前肌群,其余分别累及双侧大腿、小腿等,存在一定的肌群选择性。可能是由于大腿前群慢肌纤维比例高,当机体因各种原因出现ATP耗竭时,耗能更多的慢肌纤维首先受到损害。④早期骨化性肌炎:早期骨化性肌炎病理学表现为异位性骨化;临床表现为外伤后的肌肉坏死与出血,并形成软组织包块,但缺乏钙化或骨化;MRI表现为T1WI中等偏高信号,T2WI高信号为主,病灶边缘水肿明显[17-18]。⑤软组织感染性病变:感染多表现为患处的软组织红肿、不适,MRI表现为边界欠清的高低混杂信号,部分可见脓肿形成,而与肌肉走行无明显相关性[10]。
综上所述,横纹肌溶解症的病因多而复杂,临床表现缺乏特异性,并可引起一系列并发症。横纹肌溶解症典型临床表现为病变处肌肉弥漫性肿胀,边界欠清;MRI表现为斑片状、索条状长T1长T2信号,STIR序列呈高信号。MRI检查无辐射,可以进行多方位、多序列成像,具有较高的灵敏度和较高的软组织分辨率,是诊断横纹肌溶解症有效的影像学检查方法。
| [1] |
SCALCO R S, SNOECK M, QUINLIVAN R, et al. Exertional rhabdomyolysis: physiological response or manifestation of an underlying myopathy[J]. BMJ Open Sport & Exercise Medicine, 2016, 2(1): e000151. |
| [2] |
王乐. 横纹肌溶解症及其研究进展[J]. 中国伤残医学, 2014, 22(21): 216-217. DOI:10.13214/j.cnki.cjotadm.2014.21.189 |
| [3] |
胡明哲, 潘阿善, 杨运俊, 等. 横纹肌溶解症的临床与MRI表现分析[J]. 医学影像学杂志, 2018, 28(2): 280-283. |
| [4] |
TORRES P A, HELMSTETTER J A, KAYE A M, et al. Rhabdomyolysis: pathogenesis, diagnosis, and treatment[J]. The Ochsner Journal, 2015, 15(1): 58-69. |
| [5] |
CABRAL B M I, EDDING S N, PORTOCARRERO J P, et al. Rhabdomyolysis[J]. Disease-a-Month, 2020, 66(8): 101015. DOI:10.1016/j.disamonth.2020.101015 |
| [6] |
PETEJOVA N, MARTINEK A. Acute kidney injury due to rhabdomyolysis and renal replacement therapy: a critical review[J]. Critical Care (London, England), 2014, 18(3): 224. DOI:10.1186/cc13897 |
| [7] |
章梅华, 卢晓阳, 杨志海, 等. 横纹肌溶解症及其发病机制研究进展[J]. 中华急诊医学杂志, 2010, 19(11): 1226-1228. |
| [8] |
MORATALLA M B, BRAUN P, FORNAS G M. Importance of MRI in the diagnosis and treatment of rhabdomyolysis[J]. European Journal of Radiology, 2008, 65(2): 311-315. |
| [9] |
DAS S, HANUMAN S B, MYLAPALLI J L. Rhabdomyolysis associated acute renal failure-Report of two fatal cases and a brief review of literature[J]. Journal of Forensic and Legal Medicine, 2020, 71: 101941. |
| [10] |
李忠, 孙家瑜, 王忠, 等. 横纹肌溶解症的MRI诊断[J]. 临床放射学杂志, 2009, 28(10): 1422-1424. |
| [11] |
李峥艳, 邹翎, 宋彬, 等. 地震挤压伤致下肢横纹肌溶解症的MRI表现[J]. 中华放射学杂志, 2008, 42(11): 1126-1129. |
| [12] |
LU C H, TSANG Y M, YU C W, et al. Rhabdomyolysis: Magnetic resonance imaging and computed tomography findings[J]. Journal of Computer Assisted Tomography, 2007, 31(3): 368-374. |
| [13] |
CUNNINGHAM J, SHARMA R, KIRZNER A, et al. Acute myonecrosis on MRI: etiologies in an oncological cohort and assessment of interobserver variability[J]. Skeletal Radiology, 2016, 45(8): 1069-1078. |
| [14] |
王劭亮, 陈蓉, 王明欢. 运动性横纹肌溶解症37例诊治分析[J]. 中华临床医师杂志(电子版), 2020, 14(1): 35-38. |
| [15] |
李勇刚, 王仁法, 张景峰, 等. MR多种成像序列在皮肌炎诊断中的应用[J]. 医学影像学杂志, 2004, 14(12): 1012-1014. |
| [16] |
MIAN A Z, SAITO N, SAKAI O. Rhabdomyolysis of the head and neck: computed tomography and magnetic resonance imaging findings[J]. Dento Maxillo Facial Radiology, 2011, 40(6): 390-392. |
| [17] |
何淑玲, 冯晓源. 骨化性肌炎的临床和MRI表现分析[J]. 医学影像学杂志, 2008, 18(12): 1448-1450. |
| [18] |
PERLEPE V, DALLAUDIÈRE B, OMOUMI P, et al. Self-resolving focal non-ossifying myositis: a poorly known clinical and imaging entity diagnosed with MRI[J]. Acta Radiologica Open, 2015, 4(12): 2058460115606156. |
 2022, Vol. 58
2022, Vol. 58

