2. 德州市陵城区人民医院药剂科;
3. 青岛大学附属医院药学部
川乌具有抗炎、抗肿瘤、调节免疫、镇痛等药理作用[1-4],经炮制后,其毒性降低,在保留药理活性的同时安全性得到有效提升[5-9]。苯甲酰新乌头原碱为制川乌中含量最高的单酯型生物碱。既往关于制川乌中生物碱的药代动力学(药动学)已有少量研究[10-21],但研究对象均为制川乌提取物,目前尚缺少苯甲酰新乌头原碱的药动学数据,故无法获得其绝对生物度等参数。本文研究了苯甲酰新乌头原碱经静脉注射和灌胃途径给药后在大鼠体内的药动学特点,建立了灵敏、准确、稳定和通用的高效液相色谱-串联质谱法(LC-MS/MS法)测定大鼠血浆中的苯甲酰新乌头原碱,该方法回收率高,日内和日间相对标准差(RSD)小,简便可行,检测结果可靠,具有一定的推广价值。现报告如下。
1 材料与方法 1.1 实验材料 1.1.1 仪器API 4000+三重四极杆串联质谱系统,Analyst 1.6.3质谱数据处理软件(AB公司);Agilent 1290Ⅱ高效液相色谱仪(配备G7120泵、G7167B进样器、G7116B柱温箱,Agilent公司);Centrifuge 5418型离心机(Eppendorf公司);DT5-6B低速离心机(北京时代北利离心机有限公司);BF-2000氮气吹干仪(北京八方世纪有限公司);Model 420A酸度计(Orion公司);超纯水机(Millipore公司)。
1.1.2 药品与试剂苯甲酰新乌头原碱和乌头碱(纯度>99%,购于上海一林生物科技有限公司);色谱纯乙腈、甲醇和甲酸购于Tedia公司;色谱纯甲基叔丁基醚购于ACS公司;其余试剂均为分析纯,购于烟台远东精细化工有限公司。
1.1.3 实验动物雄性Wistar大鼠,体质量260~280 g,由青岛派特福德白鼠养殖专业合作社提供。饲养于标准鼠笼中,保持室温(25±1)℃,相对湿度60%,自由进食标准鼠粮及饮水,实验前12 h禁食不禁水,给药后2 h自由进食标准鼠粮。本实验经青岛大学附属医院伦理委员会批准开展。
1.2 实验方法 1.2.1 色谱条件色谱柱:Ultimate AQ-C18 co-lumn(3.0 μm,2.1 mm×100.0 mm,上海月旭科技有限公司),流量0.4 mL/min。用梯度洗脱,流动相乙腈(A,含体积分数0.001甲酸)和体积分数0.001甲酸溶液(B)梯度洗脱(0~0.5 min,体积分数0.25 A;0.5~3.5 min,0.25~0.70 A;3.5~4.0 min,体积分数0.70 A);柱温为40 ℃;进样量为10 μL。
1.2.2 质谱条件电喷雾电离,用多反应监测模式、正离子模式,喷雾电压5 500 V,碰撞气压力8×104 Pa,气帘气压力为2×105 Pa,雾化气压力5.5×105 Pa,辅助气压力5.5×105 Pa,雾化温度550 ℃。待测成分及内标定量分析离子对质子数/电荷数的比值(m/z)分别为590.5→540.4和646.7→587.0,去簇电压分别为110、120 V,碰撞能量分别为47、50 V。
1.2.3 标准曲线用血浆样品与质控样品配制甲醇配制苯甲酰新乌头原碱(1 g/L)溶液,-20 ℃储存;将母液用甲醇稀释得到质量浓度分别为1 000.0、200.0、20.0、5.0、1.0、0.2、0.1 μg/L的系列溶液。取上述系列溶液0.1 mL加入玻璃试管中,45 ℃氮气吹干溶剂,加入空白血浆0.1 mL,涡旋混合30 s,得到相当于血浆中苯甲酰新乌头原碱质量浓度分别为1 000.0、200.0、20.0、5.0、1.0、0.2、0.1 μg/L的标准曲线用血浆样品。用上述方法另行配制相当于血浆中苯甲酰新乌头原碱质量浓度为200.0、5.0、0.2 μg/L的血浆样品作为质控样品。
1.2.4 血浆样品预处理取血浆样品100 μL加入EP管中,加入内标溶液(1 000 μg/L,溶于体积分数0.50甲醇)20 μL,涡旋混合30 s;然后加入甲基叔丁基醚4 mL,涡旋混合2 min,以3 500 r/min离心5 min,取上清液移入另一尖底玻璃离心试管,45 ℃氮气吹干,残渣用0.1 mL甲醇-水(50∶50,V/V)溶解,涡旋混合1 min,以3 500 r/min离心10 min,取上清液即得供试溶液。
1.3 方法学验证按照《中华人民共和国药典》中记载的生物样品测定相关要求,对样本的专属性、线性、残留效应、准确度与精密度、提取的回收率以及稳定性等指标进行考察。
1.3.1 专属性取空白血浆100 μL,按1.2.4方法进行预处理,按1.2.1和1.2.2条件进样测定。
1.3.2 标准曲线及定量下限按1.2.3方法制得苯甲酰新乌头原碱质量浓度分别为1 000.0、200.0、20.0、5.0、1.0、0.2、0.1 μg/L的标准曲线用血浆样品,按1.2.4方法进行预处理,按1.2.1和1.2.2条件进样测定,以苯甲酰新乌头原碱质量浓度为横坐标(X),苯甲酰新乌头原碱峰面积与内标峰面积的比值为纵坐标(Y),进行线性回归。
1.3.3 残留效应在分析标准曲线用最高浓度的血浆样品后,再分析空白血浆样品,残留的分析物不能影响检测的精密度和准确度。
1.3.4 准确度与精密度试验按1.2.3方法制备低、中、高质量浓度(0.2、5.0、200.0 μg/L)的苯甲酰新乌头原碱质控样品,按1.2.4方法进行预处理,再按1.2.1和1.2.2条件进样测定,连续测定5次,计算日内精密度以及准确度,再连续测定5 d计算日间精密度。
1.3.5 提取回收率和基质效应按1.2.3方法制备低、中、高质量浓度(0.2、5.0和200.0 μg/L)苯甲酰新乌头原碱的质控样品,按1.2.4方法进行预处理,再按1.2.1和1.2.2方法进样测定,以该组峰面积结果为A;将空白血浆按1.2.4方法进行预处理(不加内标),用氮气吹干后分别加入低、中、高质量浓度(0.2、5.0、200.0 μg/L)的苯甲酰新乌头原碱溶液和内标,再按照1.2.1和1.2.2的方法进样测定,以该组峰面积结果为B;将质量浓度分别为0.2、5.0和200.0 μg/L的苯甲酰新乌头原碱溶液按照1.2.1和1.2.2的方法进样测定,以其峰面积结果为C。计算提取回收率(A/B×100%)和基质效应(B/C×100%)。每个浓度重复测定5次,计算平均提取回收率和基质效应。
1.3.6 稳定性试验取苯甲酰新乌头原碱质量浓度为0.2、5.0和200.0 μg/L(低、中、高浓度)质控样品,室温放置12 h,按1.2.4方法预处理,进样测定峰面积,考察室温放置稳定性;在-20 ℃冰箱放置30 d,按1.2.4方法预处理,进样测定峰面积,观察低温长期放置的稳定性;将质控样品-20 ℃冷冻-室温融化,按1.2.4方法预处理,进样测定峰面积,重复3次,观察冻融稳定性;将1.2.4方法预处理后的供试溶液室温放置24 h后注入高效液相色谱仪,测定峰面积,观察预处理后供试溶液的稳定性。各实验重复测定5次,计算平均值和RSD。
1.4 苯甲酰新乌头原碱药动学研究雄性Wistar大鼠24只,按体质量随机分为4组,每组6只。其中3组大鼠灌胃给予苯甲酰新乌头原碱,剂量分别为5、10和20 mg/kg(苯甲酰新乌头原碱混悬于5 g/L羧甲基纤维素钠溶液),分别于给药后0、0.5、1.0、1.5、2.0、2.5、3.0、4.0、6.0、9.0、12.0和24.0 h取血250 μL,加入肝素抗凝试管中,3 500 r/min离心5 min,分离血浆,-20 ℃保存待测。另一组大鼠静脉注射(静注)苯甲酰新乌头原碱,剂量为1 mg/kg(苯甲酰新乌头原碱溶解于体积分数0.15乙醇中),分别于给药后0、0.050、0.167、0.330、0.500、1.000、2.000、4.000、6.000、9.000、12.000、24.000和36.000 h取血250 μL加入肝素抗凝试管中,3 500 r/min离心5 min,分离血浆,置于-20 ℃待测。按1.2.3方法进样预处理及进样测定。采用DAS 2.0分析软件(中国药理学会),利用非隔室模型计算给药后的药动学参数,包括日内和日间RSD、苯甲酰新乌头原碱在大鼠体内绝对生物利用度(F)等。
2 结果 2.1 专属性空白血浆样品、最低定量限处血浆样品+苯甲酰新乌头原碱和内标以及大鼠灌胃苯甲酰新乌头原碱(5 mg/kg)0.5 h后的色谱图见图 1。由图 1可见,苯甲酰新乌头原碱和内标的保留时间分别为2.3、3.2 min,在此保留时间下空白血浆无色谱峰,即空白血浆中的杂质不干扰苯甲酰新乌头原碱的测定结果。
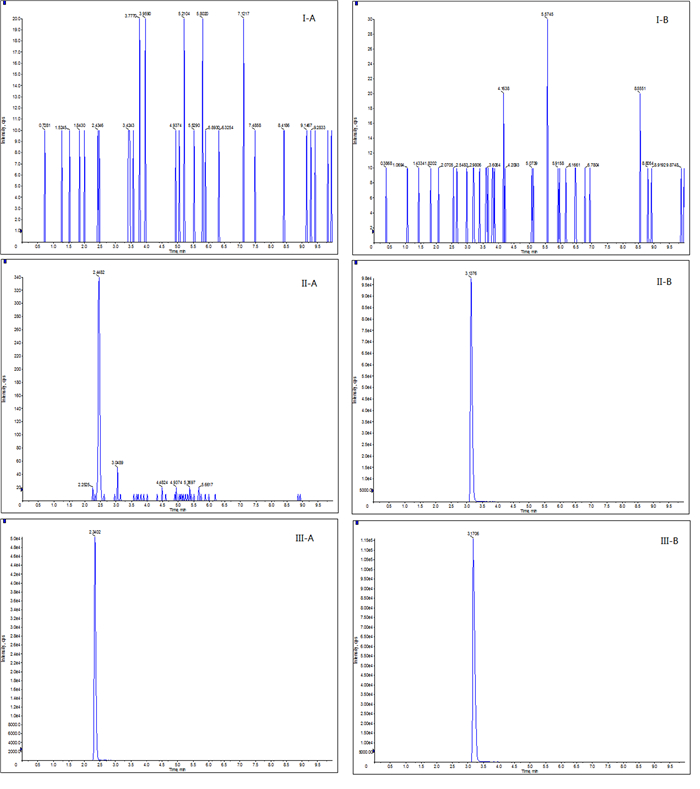 |
| Ⅰ:空白血浆样品;Ⅱ:最低定量限处血浆样品+苯甲酰新乌头原碱和内标;Ⅲ:大鼠灌胃苯甲酰新乌头原碱(5 mg/kg)0.5 h后苯甲酰新乌头原碱(A)和内标(B) 图 1 专属性检测色谱图 |
苯甲酰新乌头原碱质量浓度0.1~1 000.0 μg/L范围内线性关系良好,权重1/X2,典型的回归方程为:Y=1.7×10-1X+3.1×10-3,r=0.999 3,方法的检测下限信号平均功率与噪声平均功率的比值(S/n=3)为0.05 μg/L,定量下限为0.1 μg/L。
2.3 残留效应待测物残留的峰面积<最低定量限的20%,内标的残留峰面积<内标峰面积的5%,符合生物样品定量分析方法验证指导原则要求[11]。
2.4 准确度与精密度日内和日间精密度试验RSD分别小于10.7%和13.5%,准确度试验的相对误差(RE)<9.1%,符合测定生物样品对精密度的要求。见表 1。
| 表 1 准确度与精密度试验结果(n=5) |
|
|
苯甲酰新乌头原碱在血浆中质量浓度为0.2、5.0和200.0 μg/L时的提取回收率(n=5)分别为(93.7±9.3)%、(95.5±4.8)%和(95.0±6.5)%,内标的提取回收率(n=5)为(96.9±8.7)%;苯甲酰新乌头原碱的基质效应(n=5)则分别为(98.3±10.3)%、(96.1±8.4)%和(97.3±6.3)%,内标的基质效应(n=5)为(98.0±7.6)%。苯甲酰新乌头原碱和内标的提取回收率均较高且稳定,基质效应很小,符合要求。
2.6 稳定性低、中、高浓度的质控样品室温放置12 h时的RSD均<10.2%,-20 ℃放置30 d的RSD均<4.6%,-20 ℃冷冻-室温融化循环3次的RSD均<10.9%,预处理后的供试溶液室温放置24 h的RSD均<3.4%。样品在储存、预处理及待检测过程中均能保持稳定。
以上方法的专属性、线性等指标都能满足测定要求[22-23]。
2.7 苯甲酰新乌头原碱药动学参数大鼠静注1 mg/kg的苯甲酰新乌头原碱后,成分浓度在体内迅速达峰,药-时曲线下面积(AUC)为(711.01±209.45)μg·h/L, 血浆清除率(CL)为(1.57±0.65)L/(kg·h),药物清除半衰期(t1/2)为(4.87±0.66) h。灌胃5、10、20 mg/kg苯甲酰新乌头原碱后,药物在大鼠体内吸收较快,血药浓度达峰时间约2 h,峰浓度分别为5.29、11.26、22.50 μg/L,CL分别为(37.04±4.19)、(18.00±1.05)、(9.24±0.54)L/(kg·h),AUC分别为(27.26±2.83)、(55.69±3.06)、(108.52±6.01)μg·h/L,24 h后血中几乎检测不到苯甲酰新乌头原碱含量,t1/2分别为(5.20±0.93)、(5.21±0.83)、(4.80±0.49) h。3种给药剂量下F分别为0.767%、0.783%、0.763%,见图 2、3。提示大鼠对苯甲酰新乌头原碱吸收较差,其生物利用度较低。消除速率常数(ke)、吸收速率常数(ka)、一阶曲线下面积(AUMC)、平均驻留时间(MRT)见表 2。
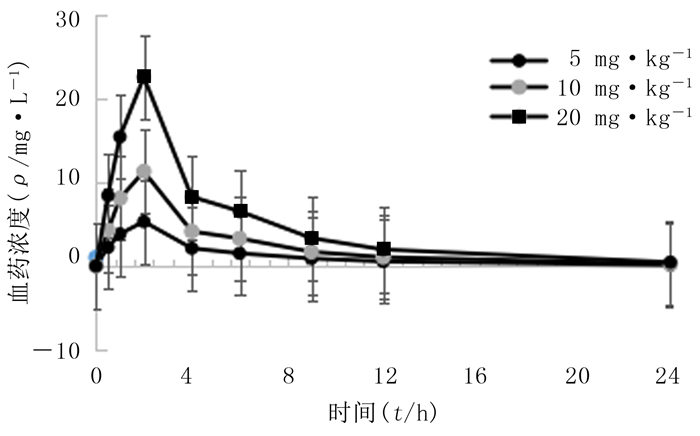 |
| 图 2 大鼠灌胃不同浓度苯甲酰新乌头原碱后的药-时曲线(n=6) |
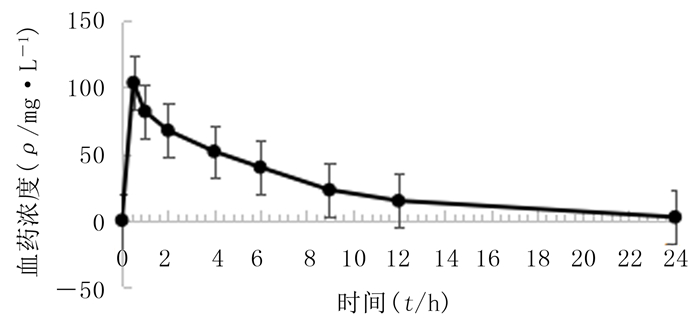 |
| 图 3 大鼠静注苯甲酰新乌头原碱1 mg/kg后的药-时曲线(n=6) |
| 表 2 大鼠灌胃和静注苯甲酰新乌头原碱的药动学参数(n=6, x±s) |
|
|
川乌经炮制后其主要功效成分由双酯型生物碱转变为单酯型生物碱,苯甲酰新乌头原碱为含量最高的单酯型生物碱成分。本研究通过大鼠灌胃和静注两种给药方式研究了苯甲酰新乌头原碱的药动学特点,结果显示,5、10、20 mg/kg给药剂量经灌胃给药,约2 h后血药浓度达峰值,提示苯甲酰新乌头原碱在大鼠体内的吸收较快;体内t1/2约为5 h,在大鼠体内的消除较快;然而,药-时曲线显示,3种给药剂量下的F均低于0.8%,说明苯甲酰新乌头原碱在大鼠体内吸收较差,生物利用度低。本文大鼠体内药动学实验结果为后期研究苯甲酰新乌头原碱的给药途径、给药剂量、给药间隔设计提供了一定参考,亦提示或可通过结构修饰或剂型改良手段,提高其生物利用度,从而为实现制剂研发并投入临床应用创造必要条件。
本研究结果显示,苯甲酰新乌头原碱在大鼠血浆中的浓度较低,为避免稀释样本,本文研究没有采用甲醇或乙腈蛋白沉淀的方法,而是采用液-液萃取的方法。肖日平等[16]采用固相萃取法处理血浆样品,应用LC-MS/MS法对比格犬血中附子生物碱进行定量分析,样品运行时间为6 min,但该方法前处理采用的固相萃取法成本较高。朱定姬等[24]采用在线固相萃取结合LC-MS/MS法检测生物样品中的附子生物碱,样品运行时间为10 min,但该方法需要配备自动固相萃取装置,成本较高,操作复杂。李建宋等[14]以烟曲霉素回收率为指标筛选最佳萃取溶剂,选取乙酸乙酯、甲基叔丁基醚、正庚烷和正己烷这4种有机溶剂为萃取剂,综合考虑生产成本和生产周期,确定甲基叔丁基醚为最佳萃取溶剂。本文在萃取溶剂选择方面,前期通过预实验比较了乙酸乙酯、甲基叔丁基醚和乙醚等萃取溶剂提取回收率结果显示,4 mL的甲基叔丁基醚的提取回收率最高且易于氮气吹干,最终选择甲基叔丁基醚作为萃取溶剂预处理样本。采用此预处理方法得到的样本也比较干净。
综上,本研究建立了一种快速、灵敏、准确的方法测定血浆中苯甲酰新乌头原碱的浓度,可以满足药动学研究的需要。单酯型生物碱作为制川乌的主要功效成分,其相关药动学数据相对缺乏,苯甲酰新乌头原碱作为含量最高的单酯型生物碱,有一定的临床开发价值,探究其在动物体内的药动学特征、获得其绝对生物度等参数,对于日后相关制剂的开发创制意义重大。本文研究了不同给药方法下苯甲酰新乌头原碱在大鼠体内的药动学特征,通过结果对比,初步总结了苯甲酰新乌头原碱在动物体内的药动学特征,为未来研究其他单酯型生物碱成分的药动学特征及相关制剂研发提供了一定的依据。
| [1] |
郑世超, 严小英, 陈菊, 等. 基于蛋白互作网络分析祛风湿药川乌的抗炎机制[J]. 中国中药杂志, 2017, 42(9): 1747-1751. DOI:10.19540/j.cnki.cjcmm.20170121.031 |
| [2] |
WADA K, OHKOSHI E, ZHAO Y, et al. Evaluation of Aconitum diterpenoid alkaloids as antiproliferative agents[J]. Bioorganic & Medicinal Chemistry Letters, 2015, 25(7): 1525-1531. |
| [3] |
LI T F, GONG N, WANG Y X. Ester hydrolysis differentially reduces aconitine-induced anti-hypersensitivity and acute neurotoxicity: involvement of spinal microglial dynorphin expression and implications for Aconitum processing[J]. Frontiers in Pharmacology, 2016, 7: 367. |
| [4] |
唐梅, 赵立春, 徐敏, 等. 附子化学成分和药理作用研究进展[J]. 广西植物, 2017, 37(12): 1614-1627. DOI:10.11931/guihaia.gxzw201704033 |
| [5] |
刘帅, 李妍, 李卫飞, 等. 乌头类中药毒性及现代毒理学研究进展[J]. 中草药, 2016, 47(22): 4095-4102. |
| [6] |
安婧娴, 刘芳, 刘芳, 等. 近年来乌头属植物二萜生物碱化学成分及其镇痛活性研究进展[J]. 中南药学, 2016, 14(5): 521-525. |
| [7] |
ZHOU G H, TANG L Y, ZHOU X D, et al. A review on phytochemistry and pharmacological activities of the processed lateral root of Aconitum carmichaelii Debeaux[J]. Journal of Ethnopharmacology, 2015, 160: 173-193. DOI:10.1016/j.jep.2014.11.043 |
| [8] |
马天宇, 俞腾飞, 李树民, 等. 乌头类中药毒代动力学及代谢组学研究进展[J]. 中国中药杂志, 2014, 39(11): 1972-1975. |
| [9] |
CHAN T Y. Aconitum alkaloid content and the high toxicity of aconite tincture[J]. Forensic Science International, 2012, 222(1-3): 1-3. DOI:10.1016/j.forsciint.2012.02.026 |
| [10] |
赛那, 金蓉, 布仁, 等. 高效液相色谱-四极杆/静电场轨道阱高分辨率质谱法快速检测大鼠血浆中6种附子生物碱[J]. 中国药房, 2018, 29(6): 761-765. |
| [11] |
李燕, 彦培傲, 赵梦杰, 等. 附子总生物碱在阳虚便秘模型大鼠体内的整合药动学分析[J]. 中国实验方剂学杂志, 2017, 23(1): 79-84. |
| [12] |
程丽丽, 许妍妍, 张艳军. 中药川乌多成分同时检测及药动学评价研究进展[J]. 天津中医药大学学报, 2014, 33(1): 56-60. |
| [13] |
李燕, 赵梦杰, 袁岸, 等. 给药剂量对附子总生物碱在大鼠体内药代动力学特征的影响[J]. 中国实验方剂学杂志, 2016, 22(22): 82-85. |
| [14] |
李建宋, 李亚, 王继栋, 等. 高效抗肿瘤药物烟曲霉素的分离纯化及杂质分析[J]. 中国医药生物技术, 2020, 15(4): 398-403. |
| [15] |
许妍妍, 郭雪君, 李遇伯, 等. 生川乌瓜蒌不同配伍中乌头类生物碱在大鼠体内的药动学研究[J]. 现代药物与临床, 2016, 31(3): 273-279. |
| [16] |
肖日平, 赖小平, 赵亚, 等. 附子6种生物碱在比格犬体内药动学研究[J]. 中药材, 2014, 37(2): 284-287. |
| [17] |
杨晓珊, 吴锦俊, 卢琳琳, 等. 附子药代动力学研究进展[J]. 世界中医药, 2014, 9(2): 171-174. |
| [18] |
刘玉婷, 蒋且英, 黄国勇, 等. LC-MS法研究黄芪对附子6种乌头生物碱大鼠药代动力学的影响[J]. 药学学报, 2019, 54(12): 7. |
| [19] |
甘嘉荷, 王淳, 宋志前, 等. 炼蜜用量对附子理中丸中9种生物碱类成分药代动力学的影响[J]. 中国实验方剂学杂志, 2018, 24(3): 7. |
| [20] |
黎晓丽, 吴璐, 吴维刚, 等. 在体皮肤微透析法研究制川乌白芍配伍对6种酯型生物碱局部药动学的影响[J]. 中国中药杂志, 2016, 41(5): 7. |
| [21] |
杨华生, 黎晓丽, 闻丽珍, 等. 基于经皮给药途径研究白芍对制川乌6个酯型生物碱组织分布的影响[J]. 药物分析杂志, 2017, 37(6): 9. |
| [22] |
国家药典委员会. 中华人民共和国药典(四部)2015年版[M]. 北京: 中国医药科技出版社, 2015: 363.
|
| [23] |
钟大放, 李高, 刘昌孝. 生物样品定量分析方法指导原则(草案)[J]. 药物评价研究, 2011, 34(6): 409-415. |
| [24] |
朱定姬, 卢敏萍, 黄克, 等. 在线固相萃取结合液相色谱-线性离子阱多级质谱法同时检测生物样品中7种乌头类生物碱[J]. 色谱, 2016, 34(3): 249-257. |
 2022, Vol. 58
2022, Vol. 58

