帕金森病(PD)是一种常见的神经退行性疾病,临床表现主要包括静止性震颤、运动迟缓、肌强直和姿势步态障碍等[1]。PD主要病理特征是黑质致密部多巴胺能神经元的进行性丧失以及路易小体的出现。路易小体由异常聚集的α-突触核蛋白(α-syn)所形成。α-syn是一种小分子酸性蛋白质,主要表达于突触前末端,在PD致病中的关键作用已被广泛证实[2]。α-syn在细胞内聚集,可促进线粒体损伤,破坏溶酶体和高尔基体等,并增加细胞对氧化应激的易感性,进而促进细胞死亡[3-6]。
研究结果表明,PD病人非运动症状出现比运动症状提前10~20年,胃肠功能障碍是PD最常见的非运动症状,严重影响着病人的生活质量[7-9]。根据BRAAK等[10-11]的学说,α-syn的聚集可能始于外周(包括肠神经系统),并由外周沿迷走神经向中枢神经系统传播。在PD的不同阶段,α-syn在肠中的表达量可能会不同程度地影响胃肠功能。A53T小鼠是携带人A53T突变型α-syn基因的PD模型小鼠。在体内,基因突变诱导的α-syn的高表达可导致路易小体的形成和黑质多巴胺能神经元的丢失[12-13]。纯合子的A53T小鼠从6月龄开始表现出PD的运动症状,并表现出更早和更严重的胃肠运动功能下降。但是,在运动症状出现之前小鼠胃肠道中α-syn的表达是否已有改变尚不清楚。因此,本实验观察了α-syn在3月龄和6月龄的A53T小鼠小肠中的表达变化。
1 材料和方法 1.1 实验动物野生型(WT)小鼠购于北京维通利华公司; A53T小鼠(B6;C3-Tg (PrnpSNCA*A53T)83Vle/ J)购自南京大学模式动物研究所。两种小鼠均按照SPF级别标准,饲养于温度为(22±2)℃、湿度为(50±10)%、12 h昼夜循环光照的安静环境中,可自由饮水、进食。选用3月龄和6月龄A53T纯合子转基因小鼠和WT小鼠,每组4只。
1.2 实验试剂α-syn抗体、Beta tubulin抗体购于美国Cell Signaling Technology公司; NFH抗体购于美国Santa公司; 山羊抗兔和山羊抗鼠抗体购于英国Thermo Fisher Scientific公司; PVDF膜、ECL发光液均购于美国Millipore公司; 山羊血清购于中国Solarbio公司; DAPI染液购于中国Roche公司; 冷冻切片包埋剂购于日本TaKaRa公司; Triton X-100购于韩国Biosharp公司; Tween-20购于美国Sigma公司。
1.3 蛋白免疫印迹法检测小鼠小肠组织中α-syn蛋白表达将小鼠麻醉后,取其邻近十二指肠的空肠1 cm。向装有小肠组织的EP管内加入300 μL组织裂解液,用研磨器充分研磨,在冰上进行裂解,静置30 min后,在4 ℃下以1 200 r/min离心20 min,吸取上清置于新的EP管中,采用BCA法检测蛋白浓度。按照每孔20 μg蛋白计算上样量,经SDS-PAGE凝胶电泳(80 V、30 min,120 V、60 min)后,电转到0.22 μm的PVDF膜上,加100 g/L脱脂奶粉于室温摇床孵育2 h; 加入相应的一抗(α-syn滴度为1∶1 000,Beta tubulin滴度为1∶10 000),4 ℃摇床孵育过夜(时间>16 h),用TBST溶液洗3次,每次10 min; 分别加入山羊抗兔和山羊抗鼠(滴度均为1∶10 000)的HRP-IgG二抗并室温孵育1.5 h,然后使用TBST溶液洗3次,每次10 min。ECL发光液显影后用Image J软件读取条带灰度值,对α-syn表达水平进行分析。
1.4 免疫荧光实验取小鼠近十二指肠的空肠1 cm,放入40 g/L多聚甲醛内浸泡1周,之后将小肠分别置于200 g/L和300 g/L蔗糖溶液中梯度沉糖。将沉糖处理后的小肠于冷冻切片机上切成15 μm厚的冷冻切片,并贴到多聚赖氨酸处理过的病理级别载玻片上,在常温下晾干(24 h)。用0.01 mol/L的PBS清洗包埋剂,然后用体积分数0.1的山羊血清封闭2 h; 加入α-syn(滴度1∶250)和NFH(滴度1∶500)一抗4 ℃孵育过夜,用0.01 mol/L PBST溶液洗3次,每次10 min; 分别加入山羊抗兔(滴度1∶500)和山羊抗鼠(滴度1∶500)的二抗并室温孵育1.5 h,然后用0.01 mol/L PBST溶液洗3次,每次10 min。封片,加入体积分数0.7的甘油后盖上盖玻片,晾干后进行荧光观察。
1.5 统计学处理采用SPSS 25.0统计分析软件进行数据分析。计量资料数据以x±s表示,不同月龄WT小鼠和A53T小鼠小肠组织α-syn表达比较采用析因设计的方差分析。P<0.05表示差异有统计学意义。
2 结果 2.1 不同月龄WT和A53T小鼠小肠组织α-syn表达比较蛋白免疫印迹法检测结果显示,与同月龄WT组小鼠相比,3月龄、6月龄A53T组小鼠小肠组织α-syn表达量显著增高,差异均有统计学意义(F=3.107、2.955,P<0.05);6月龄A53T组小鼠小肠的α-syn表达量比3月龄A53T组小鼠增加21.71%,两组相比差异具有统计学意义(F=2.836,P<0.05)。说明A53T小鼠小肠组织α-syn的表达远高于WT小鼠,6月龄A53T小鼠小肠组织α-syn的表达高于3月龄A53T小鼠。见表 1。
| 表 1 不同月龄WT和A53T小鼠小肠组织α-syn表达的比较(n=4,x±s) |
|
|
免疫荧光实验结果显示,与同月龄WT组小鼠相比,3月龄、6月龄A53T组小鼠小肠组织α-syn表达量显著增高; 6月龄A53T组小鼠小肠组织α-syn表达量明显高于3月龄A53T组小鼠。见图 1。
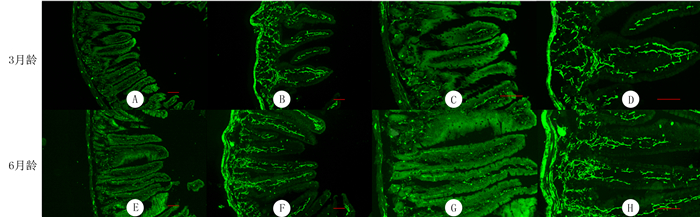 |
| 3月龄WT小鼠(A、C)和A53T小鼠(B、D)小肠α-syn染色,6月龄WT小鼠(E、G)和A53T小鼠(F、H)小肠α-syn染色。标尺=100 μm。 图 1 不同月龄WT和A53T小鼠小肠组织α-syn表达的免疫荧光检测 |
本实验通过蛋白免疫印迹和免疫荧光方法证实,与同月龄的WT小鼠相比较,3月龄和6月龄A53T小鼠小肠组织α-syn表达显著增加,且随年龄的增长,A53T小鼠小肠组织α-syn的表达增加。
PD是一种多系统受累的神经退行性疾病,其临床症状不仅包括运动症状,还包括便秘、胃排空延迟、唾液分泌过多、吞咽困难、恶心以及嗅觉障碍、抑郁和睡眠障碍等非运动症状[8]。其中,胃肠道功能障碍是PD发展过程中一种常见非运动症状[14]。2003年,BRAAK等的学说认为,肠道中的α-syn可向中枢神经系统传播,最初传播到舌咽和迷走神经背侧运动核以及嗅球,随后逐渐传播到中脑黑质区,最终达到皮质层[15]。由于在PD病人的疾病早期已经发现了肠道中α-syn的异常沉积,故推测肠神经系统可能是α-syn的一个起始病理位点。α-syn主要位于Meissner和Auerbach’s神经丛的肠神经元中[16-18]。最近的研究结果还表明,多种危险因素可能单独或共同导致α-syn在肠道表达的增加,例如肠道菌群、肠道炎症和肠神经胶质细胞功能障碍等[19-21]。了解肠道中的α-syn是如何开始聚集的,将有助于治疗胃肠功能障碍,并可能有助于预防或延缓PD的发生和发展。
与PD相关的特异性遗传突变首先发现于1997年,其中A53T点突变属于常染色体显性遗传,该突变引起的PD通常具备早发性以及病情进展迅速等特点[22-23]。α-syn第53位的丙氨酸被苏氨酸替代后,能促进可溶性的α-syn寡聚体或原纤维的形成,并可以作为种子促进α-syn在神经元之间的传播。在转基因小鼠模型中,表达人突变型α-syn的A53T转基因小鼠应用最为广泛。过度表达人A53T突变型α-syn的小鼠随年龄增长会表现出严重的运动障碍以及α-syn病[14, 24]。研究发现,在A53T小鼠脑皮质神经元和脊髓运动神经元的细胞质中存在包裹体,包裹体中包含人α-syn和硝基化的α-syn,并且运动神经元在A53T小鼠中耗竭可达75%[13, 25]。有研究通过检测A53T纯合子小鼠的食物摄入量、结肠动力以及结肠和回肠环形肌的收缩活动发现,3月龄纯合子A53T小鼠的进食量与非转基因小鼠相比虽然无明显变化,但肠道运输时间比非转基因小鼠延迟2 h左右,同时结肠和回肠环形肌运动反应幅度也明显下降; 6月龄纯合子A53T小鼠的胃肠道运输功能逐渐降低,肠道运输时间延迟超过3 h,与此同时,结肠和回肠环形肌运动反应幅度进一步降低[26-27]。本实验结果显示,3月龄A53T小鼠小肠组织α-syn的表达已经较同月龄WT小鼠出现明显增加,6月龄A53T小鼠小肠组织α-syn表达亦比3月龄A53T小鼠增加。这说明小肠组织α-syn和PD的胃肠功能障碍可能存在联系。A53T小鼠在3月龄出现结肠动力障碍时,并未出现PD的运动症状,中枢神经系统中也未出现α-syn的病理性聚集,甚至到6月龄时,中枢神经系统也未有α-syn的病理性聚集[26],但事实上此时肠道中的α-syn已经增加。因此,肠内α-syn的表达量可能作为PD的一项早期诊断指标,本实验结果为此提供了数据支持。
综上所述,在未出现运动症状的3月龄A53T小鼠小肠中组织有α-syn的表达增加,并且随年龄增长,A53T小鼠小肠组织α-syn表达也增加。
| [1] |
KANSARA S, TRIVEDI A, CHEN S, et al. Early diagnosis and therapy of Parkinson's disease: can disease progression be curbed?[J]. Journal of Neural Transmission (Vienna, Austria: 1996), 2013, 120(1): 197-210. DOI:10.1007/s00702-012-0840-9 |
| [2] |
DEHAY B, BOURDENX M, GORRY P, et al. Targeting α-synuclein for treatment of Parkinson's disease: mechanistic and therapeutic considerations[J]. The Lancet Neurology, 2015, 14(8): 855-866. DOI:10.1016/S1474-4422(15)00006-X |
| [3] |
STEFANIS L, LARSEN K E, RIDEOUT H J, et al. Expression of A53T mutant but not wild-type alpha-synuclein in PC12 cells induces alterations of the ubiquitin-dependent degradation system, loss of dopamine release, and autophagic cell death[J]. The Journal of Neuroscience, 2001, 21(24): 9549-9560. DOI:10.1523/JNEUROSCI.21-24-09549.2001 |
| [4] |
GOSAVI N, LEE H J, LEE J S, et al. Golgi fragmentation occurs in the cells with prefibrillar alpha-synuclein aggregates and precedes the formation of fibrillar inclusion[J]. The Journal of Biological Chemistry, 2002, 277(50): 48984-48992. DOI:10.1074/jbc.M208194200 |
| [5] |
HSU L J, SAGARA Y, ARROYO A, et al. Alpha-synuclein promotes mitochondrial deficit and oxidative stress[J]. The American Journal of Pathology, 2000, 157(2): 401-410. DOI:10.1016/S0002-9440(10)64553-1 |
| [6] |
OSTREROVA N, PETRUCELLI L, FARRER M, et al. alpha-Synuclein shares physical and functional homology with 14-3-3 proteins[J]. The Journal of Neuroscience, 1999, 19(14): 5782-5791. DOI:10.1523/JNEUROSCI.19-14-05782.1999 |
| [7] |
POIRIER A A, AUBÉ B, CÔTÉ M, et al. Gastrointestinal dysfunctions in Parkinson's disease: symptoms and treatments[J]. Parkinson's Disease, 2016, 2016: 6762528. |
| [8] |
LEE H M, KOH S B. Many faces of Parkinson's disease: non-motor symptoms of Parkinson's disease[J]. Journal of Movement Disorders, 2015, 8(2): 92-97. DOI:10.14802/jmd.15003 |
| [9] |
STIRPE P, HOFFMAN M, BADIALI D, et al. Constipation: an emerging risk factor for Parkinson's disease?[J]. European Journal of Neurology, 2016, 23(11): 1606-1613. DOI:10.1111/ene.13082 |
| [10] |
BRAAK H, DEL TREDICI K, RVB U, et al. Staging of brain pathology related to sporadic Parkinson's disease[J]. Neuro-biology of Aging, 2003, 24(2): 197-211. DOI:10.1016/S0197-4580(02)00065-9 |
| [11] |
BRAAK H, GHEBREMEDHIN E, RVB U, et al. Stages in the development of Parkinson's disease-related pathology[J]. Cell and Tissue Research, 2004, 318(1): 121-134. DOI:10.1007/s00441-004-0956-9 |
| [12] |
KAHLE P J, NEUMANN M, OZMEN L, et al. Subcellular localization of wild-type and Parkinson's disease-associated mutant alpha-synuclein in human and transgenic mouse brain[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2000, 20(17): 6365-6373. DOI:10.1523/JNEUROSCI.20-17-06365.2000 |
| [13] |
LU J Q, SUN F Y, MA H, et al. Comparison between α-synuclein wild-type and A53T mutation in a progressive Par-kinson's disease model[J]. Biochemical and Biophysical Re-search Communications, 2015, 464(4): 988-993. DOI:10.1016/j.bbrc.2015.07.007 |
| [14] |
MARTINEZ-MARTIN P. The importance of non-motor disturbances to quality of life in Parkinson's disease[J]. Journal of the Neurological Sciences, 2011, 310(1-2): 12-16. DOI:10.1016/j.jns.2011.05.006 |
| [15] |
RIETDIJK C D, PEREZ-PARDO P, GARSSEN J, et al. Exploring Braak's hypothesis of Parkinson's disease[J]. Frontiers in Neurology, 2017, 8: 37. |
| [16] |
ZHONG C B, CHEN Q Q, HAIKAL C, et al. Age-dependent alpha-synuclein accumulation and phosphorylation in the ente-ric nervous system in a transgenic mouse model of Parkinson's disease[J]. Neuroscience Bulletin, 2017, 33(5): 483-492. DOI:10.1007/s12264-017-0179-1 |
| [17] |
WANG W W, SONG N, JIA F, et al. Genomic DNA levels of mutant alpha-synuclein correlate with non-motor symptoms in an A53T Parkinson's disease mouse model[J]. Neurochemistry International, 2018, 114: 71-79. DOI:10.1016/j.neuint.2018.01.006 |
| [18] |
WANG L, MAGEN I, YUAN P Q, et al. Mice overexpres-sing wild-type human alpha-synuclein display alterations in colonic myenteric ganglia and defecation[J]. Neurogastroentero-logy & Motility, 2012, 24(9): e425-e436. DOI:10.1111/j.1365-2982.2012.01974.x |
| [19] |
SCHEPERJANS F, AHO V, PEREIRA P A B, et al. Gut microbiota are related to Parkinson's disease and clinical phenotype[J]. Movement Disorders, 2015, 30(3): 350-358. DOI:10.1002/mds.26069 |
| [20] |
DEVOS D, LEBOUVIER T, LARDEUX B, et al. Colonic inflammation in Parkinson's disease[J]. Neurobiology of Di-sease, 2013, 50: 42-48. DOI:10.1016/j.nbd.2012.09.007 |
| [21] |
CLAIREMBAULT T, LECLAIR-VISONNEAU L, NEUNLIST M, et al. Enteric glial cells: new players in Parkinson's disease?[J]. Movement Disorders, 2015, 30(4): 494-498. DOI:10.1002/mds.25979 |
| [22] |
HIGUCHI S, ARAI H, MATSUSHITA S, et al. Mutation in the alpha-synuclein gene and sporadic Parkinson's disease, Alzheimer's disease, and dementia with lewy bodies[J]. Experimental Neurology, 1998, 153(1): 164-166. DOI:10.1006/exnr.1998.6868 |
| [23] |
LOTANKAR S, PRABHAVALKAR K S, BHATT L K. Biomarkers for Parkinson's disease: recent advancement[J]. Neuroscience Bulletin, 2017, 33(5): 585-597. DOI:10.1007/s12264-017-0183-5 |
| [24] |
MARTIN L J. Parkinson's disease-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death[J]. Journal of Neuroscience, 2006, 26(1): 41-50. DOI:10.1523/JNEUROSCI.4308-05.2006 |
| [25] |
LUK K C, LEE V M. Modeling Lewy pathology propagation in Parkinson's disease[J]. Parkinsonism & Related Disorders, 2014, 20(Suppl 1): S85-S87. |
| [26] |
ROTA L, PELLEGRINI C, BENVENUTI L, et al. Constipation, deficit in colon contractions and alpha-synuclein inclusions within the colon precede motor abnormalities and neurodegeneration in the central nervous system in a mouse model of alpha-synucleinopathy[J]. Translational Neurodegeneration, 2019, 8: 5. DOI:10.1186/s40035-019-0146-z |
| [27] |
CHAUDHURI K R, HEALY D G, SCHAPIRA A H. Non-motor symptoms of Parkinson's disease: diagnosis and ma-nagement[J]. The Lancet Neurology, 2006, 5(3): 235-245. DOI:10.1016/S1474-4422(06)70373-8 |
 2022, Vol. 58
2022, Vol. 58

