2. 青岛大学附属医院病理科, 山东 青岛 266003
创面的愈合是一个极为复杂而持续的病理生理过程,维持创面湿润、透气、无菌的微环境是创面良好愈合的基础条件。既往创面处理多采用清创换药联合植皮术或局部皮瓣/肌瓣/筋膜瓣转移修复术,但手术治疗方法的实施需要具备临床技术基础及外科手术条件,且手术治疗影响外观并可引起功能障碍[1]。敷料作为创面治疗的重要工具,在创面愈合中发挥着巨大的作用。许多研究已经报道了使用各种技术制造纳米纤维合成高分子材料类敷料,例如静电纺丝[2]。静电纺丝技术是一种简单、廉价且用途广泛的纺丝方法,作为组织工程应用的潜在生物技术已引起广泛的兴趣[3-4]。本实验旨在观察评估利用静电纺丝技术制备的聚己内酯(PCL)-羧基壳聚糖混纺纳米纤维膜在促进创面愈合中的作用,以探寻一种使用安全、成本低廉的促进伤口愈合及预防感染发生的组织工程材料。
1 材料与方法 1.1 实验材料 1.1.1 实验动物健康c57小鼠15只,6周龄,体质量(20±1)g,雌雄不限,由青岛大学医学部实验动物中心提供。实验过程中对动物的处置符合动物伦理学标准。
1.1.2 PCL-羧基壳聚糖静电纺丝纳米纤维膜由青岛大学纺织学院制备,PCL与羧基壳聚糖的配比约为1∶4。
1.2 实验方法 1.2.1 伤口造模每只小鼠腹腔注射10 g/L的戊巴比妥钠,剂量为35 mg/kg,待小鼠麻醉效果满意后将其固定于操作台上。用刮毛器将背部鼠毛刮净,用标记笔在小鼠后背标记2个在脊柱两侧对称分布的1 cm×1 cm大小正方形创面,以碘附消毒3次后,沿标记线剪除2个创面内全层皮肤组织,至深筋膜层,止血,制成机械性损伤动物模型。
1.2.2 创面处理以小鼠脊柱左侧创面为实验组,脊柱右侧创面为对照组。实验组用灭菌后的PCL-羧基壳聚糖静电纺丝纳米纤维膜覆盖创面,对照组用普通无菌纱布覆盖。
1.2.3 伤口愈合情况监测于造模后3、7、13 d对小鼠创面进行拍照处理,用Photoshop CS7软件对图片进行分析,确定实验组及对照组愈合及未愈合面积,利用像素计量方法计算伤口面积变化。
1.2.4 愈合伤口组织的病理学观察造模后14 d切取两组小鼠伤口愈合处组织,将切取的组织浸入40 g/L中性甲醛溶液中固定,石蜡包埋,切片。组织切片经脱蜡水化后进行苏木精-伊红(HE)染色,在光镜下观察肉芽组织形成情况。观察指标包括:皮肤附属器、毛囊及新生毛细血管;胶原沉积及排列;细胞层次;炎细胞。
1.3 统计学分析采用Excel建立数据库,双人双录入后进行核查对比。采用SPSS 23.0软件进行统计学分析。创面未愈合面积以x±s表示,数据比较采用两因素重复测量设计的方差分析。以P<0.05为差异具有统计学意义。
2 结果 2.1 创面面积比较两组小鼠术后1周内创面面积均缩小,但变化幅度不大;造模后13 d时,伤口面积减小到很小。实验组创面的愈合能力强于对照组,其创面面积明显缩小的快,愈合明显;造模后13 d,实验组小鼠创面基本愈合,而对照组则未完全愈合。两因素重复测量方差分析显示,两组小鼠造模后3、7、13 d创面未愈合面积均逐渐变小,不同时间比较差异有统计学意义(F=10 534.901、15 559.614,P<0.01);与对照组相比较,实验组小鼠在造模后3、7、13 d时的创面未愈合面积明显缩小,差异有统计学意义(F=157.500~840.000,P<0.01)。见表 1。
| 表 1 两组小鼠造模后不同时间皮肤创面未愈合面积比较(n=15,A/cm2) |
|
|
造模后3 d:两组创面面积均较大,创面颜色红、收缩,创腔可见肉芽组织,创缘新生上皮组织生长较明显,实验组创面PCL-羧基壳聚糖静电纺丝纳米纤维膜覆盖完好,对照组可见较大结痂。造模后7 d:两组创面颜色深红、收缩,创腔被肉芽组织填平,创缘新生上皮组织生长明显,创缘可见瘢痕组织形成,实验组创面PCL-羧基壳聚糖静电纺丝纳米纤维膜覆盖完好,对照组结痂较前缩小。造模后13 d:两组创面颜色浅红,创面上皮化明显,实验组PCL-羧基壳聚糖静电纺丝纳米纤维膜脱落,创面表面闭合、收缩良好,对照组结痂脱落,创面表面基本闭合,创面收缩较实验组差。造模后两组创面均未出现皮肤红斑和水肿反应,未见局部充血、肿胀及坏死等刺激反应。见图 1。
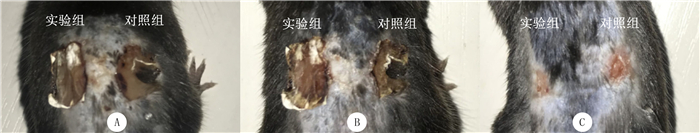 |
| A、B、C分别表示两组小鼠术后3、7、13 d时的创面愈合情况。 图 1 两组小鼠术后不同时间创面愈合情况的大体观察 |
HE染色显示,实验组创面新生皮肤组织,皮肤表皮层菲薄,真皮层增厚,内见大量皮肤附属器、毛囊及新生毛细血管,皮下纤维结缔组织增生并胶原化,排列尚整齐,胶原沉积较多且排列规则、有序,细胞层次较对照组多,炎细胞比例约为20%;对照组创面新生皮肤组织,皮肤表皮及真皮层尚可,未见明显皮肤附属器及毛囊,可见小血管增生,皮下纤维结缔组织增生及胶原化不明显,排列紊乱,内有较多慢性炎细胞浸润,细胞层次较实验组少且杂乱,炎细胞比例约为35%。见图 2。
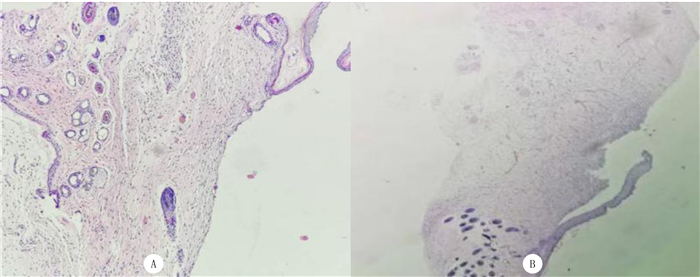 |
| A:实验组,B:对照组;HE染色,100倍。 图 2 造模后14 d两组小鼠伤口愈合处组织的组织学观察 |
创面的治疗常因保护不足导致愈合速度慢、愈合质量差等问题,因此保护创面是其临床治疗的重点和难点。敷料作为阻绝外界病原菌、营造创面组织细胞生长所需微环境的重要工具,一直以来都是创面修复的重要武器[5]。
PCL是一种人工合成的线性脂肪族聚酯,不仅具有良好的生物相容性、可控的生物降解速度和优良的力学性能, 而且其可塑性好、成本低廉[6-8]。利用静电纺丝技术生产的PCL纳米纤维膜敷料具有比表面积大、疏松多孔、柔韧抗拉、可生物降解、无细胞毒性等诸多特点[9]。但是,PCL的疏水作用使得PCL纳米纤维膜无法有效吸收创面渗液,可以导致创面渗液的聚集及感染风险的增加[10]。近年来因为抗生素的滥用使很多细菌产生了耐药性,而天然抗菌物质的使用可以有效降低抗生素的滥用率[11]。壳聚糖,又名甲壳胺,是自然界中具有良好抗菌性能的天然聚合物[12-14]。然而,壳聚糖因其分子内存在大量的NH2基团使其在水中溶解度差,故静电纺丝过程中壳聚糖的溶解需要大量具有细胞毒性和生物刺激性的酸性溶剂的辅助[15-16]。为解决此问题,我们在壳聚糖分子内引入-COOH形成羧基壳聚糖,以提高壳聚糖在水溶液中的溶解度,使壳聚糖在静电纺丝过程中形成静电纺丝溶液时不再需要以酸性溶液作为媒介,克服了传统酸性溶媒体系存在的细胞刺激性及毒性问题[16-19]。我们制备的PCL-羧基壳聚糖静电纺丝纳米纤维膜既能有效阻隔外界微生物入侵,又能在创面形成湿润、透气的微环境,羧基壳聚糖等的加入进一步赋予了电纺纤维膜亲水、抗菌等特性,而且PCL-羧基壳聚糖静电纺丝纳米纤维膜内部纤维间孔隙小于组织细胞直径,能有效避免应用传统敷料时组织细胞长入敷料网眼内造成换药时创面疼痛和组织损伤。
本实验结果表明,PCL-羧基壳聚糖静电纺丝纳米纤维膜相对于传统纱布敷料,促进创面愈合能力强,贴合性更好。究其原因可能是:①PCL-羧基壳聚糖静电纺丝纳米纤维膜覆盖于创面能够阻挡外来细菌感染;②PCL-羧基壳聚糖静电纺丝纳米纤维膜与创面贴合性好,有利于创面周围组织细胞爬行愈合,从而加快创面愈合;③PCL-羧基壳聚糖静电纺丝纳米纤维膜具有一定透气性,能够保持创面愈合所需适宜湿润环境;④PCL-羧基壳聚糖静电纺丝纳米纤维膜内部纤维间孔隙小于组织细胞直径,能有效避免应用传统敷料时组织细胞长入敷料网眼内,在创面愈合后可自动脱落,避免二次损伤。
总之,本实验通过构建小鼠创面模型研究结果表明,PCL-羧基壳聚糖静电纺丝纳米纤维膜对于小鼠创面能起到很好的保护作用,有利于创面的愈合。本研究为临床创面敷料的选择与研发、减少抗生素的滥用提供了新思路。本实验应用的创面类型属于机械性损伤创面,后续实验可以检测PCL-羧基壳聚糖静电纺丝纳米纤维膜对烧伤、糖尿病皮肤组织溃疡等其他类型创面的影响;PCL-羧基壳聚糖静电纺丝纳米纤维膜应用时未出现皮肤红斑和水肿反应等副作用,因此可将PCL-羧基壳聚糖静电纺丝纳米纤维膜作为基础性载体敷料,加入可促进创面愈合的物质后再观测其对于创面愈合的影响;后期还可对系列静电纺丝纳米纤维膜的生物相容性进行综合性检测。
| [1] |
陈东亮, 张增方, 郑良孝, 等. VAC联合PRP凝胶技术治疗足外伤后创面的效果[J]. 青岛大学学报(医学版), 2020, 56(1): 101-104. |
| [2] |
VENUGOPAL J, LOW S, CHOON A T, et al. Interaction of cells and nanofiber scaffolds in tissue engineering[J]. Journal of Biomedical Materials Research Part B, Applied Biomate-rials, 2008, 84(1): 34-48. |
| [3] |
SCHUMANN D, EKAPUTRA A K, LAM C X, et al. Biomaterials/scaffolds. Design of bioactive, multiphasic PCL/collagen type Ⅰ and type Ⅱ-PCL-TCP/collagen composite scaffolds for functional tissue engineering of osteochondral repair tissue by using electrospinning and FDM techniques[J]. Methods in Molecular Medicine, 2007, 140: 101-124. |
| [4] |
CEDERVALL T, LYNCH I, LINDMAN S, et al. Understanding the nanoparticle-protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(7): 2050-2055. DOI:10.1073/pnas.0608582104 |
| [5] |
BOATENG J S, MATTHEWS K H, STEVENS H N E, et al. Wound healing dressings and drug delivery systems: a review[J]. Journal of Pharmaceutical Sciences, 2008, 97(8): 2892-2923. DOI:10.1002/jps.21210 |
| [6] |
余程, 刘凯, 侯长江, 等. 3D打印纳米羟基磷灰石/聚己内酯支架生物相容性[J]. 青岛大学医学院学报, 2017, 53(1): 1-4. |
| [7] |
YAO Q Q, WEI B, GUO Y, et al. Design, construction and mechanical testing of digital 3D anatomical data-based PCL-HA bone tissue engineering scaffold[J]. Journal of Materials Science Materials in Medicine, 2015, 26(1): 5360. |
| [8] |
PARK S H, PARK D S, SHIN J W, et al. Scaffolds for bone tissue engineering fabricated from two different materials by the rapid prototyping technique: PCL versus PLGA[J]. Journal of Materials Science: Materials in Medicine, 2012, 23(11): 2671-2678. DOI:10.1007/s10856-012-4738-8 |
| [9] |
PLANZ V, SEIF S, ATCHISON J S, et al. Three-dimensio-nal hierarchical cultivation of human skin cells on bio-adaptive hybrid fibers[J]. Integrative Biology: Quantitative Biosciences from Nano to Macro, 2016, 8(7): 775-784. DOI:10.1039/C6IB00080K |
| [10] |
WANG J, PLANZ V, VUKOSAVLJEVIC B, et al. Multifunctional electrospun nanofibers for wound application-Novel insights into the control of drug release and antimicrobial acti-vity[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2018, 129: 175-183. DOI:10.1016/j.ejpb.2018.05.035 |
| [11] |
许雪冉, 孙强, 阴佳, 等. 抗生素耐药性全球治理的发展历程及对中国的启示[J]. 中国卫生政策研究, 2019, 12(5): 38-43. DOI:10.3969/j.issn.1674-2982.2019.05.006 |
| [12] |
吉秋霞, 徐全臣, 于新波, 等. 壳聚糖及其季铵盐对牙周常见致病菌的体外抑菌活性[J]. 青岛大学医学院学报, 2011, 47(1): 23-24, 27. |
| [13] |
HELANDER I M, NURMIAHO-LASSILA E L, AHVENAINEN R, et al. Chitosan disrupts the barrier properties of the outer membrane of gram-negative bacteria[J]. Interna-tional Journal of Food Microbiology, 2001, 71(2-3): 235-244. DOI:10.1016/S0168-1605(01)00609-2 |
| [14] |
COOPER A, OLDINSKI R, MA H Y, et al. Chitosan-based nanofibrous membranes for antibacterial filter applications[J]. Carbohydrate Polymers, 2013, 92(1): 254-259. DOI:10.1016/j.carbpol.2012.08.114 |
| [15] |
FADAIE M, MIRZAEI E, GERAMIZADEH B, et al. Incorporation of nanofibrillated chitosan into electrospun PCL nanofibers makes scaffolds with enhanced mechanical and biological properties[J]. Carbohydrate Polymers, 2018, 199: 628-640. DOI:10.1016/j.carbpol.2018.07.061 |
| [16] |
ZHAO X J, ZHOU L Y, LI Q T, et al. Biomimetic mineralization of carboxymethyl chitosan nanofibers with improved osteogenic activity in vitro and in vivo[J]. Carbohydrate Polymers, 2018, 195: 225-234. DOI:10.1016/j.carbpol.2018.04.090 |
| [17] |
YAO M Y, ZOU Q X, ZOU W W, et al. Bifunctional scaffolds of hydroxyapatite/poly(dopamine)/carboxymethyl chitosan with osteogenesis and anti-osteosarcoma effect[J]. Biomaterials Science, 2021, 9(9): 3319-3333. DOI:10.1039/D0BM01785J |
| [18] |
CHEN T, ZOU Q X, DU C, et al. Biodegradable 3D printed HA/CMCS/PDA scaffold for repairing lacunar bone defect[J]. Materials Science & Engineering C, Materials for Biological Applications, 2020, 116: 111148. |
| [19] |
STIE M B, GĀTKE J R, WAN F, et al. Swelling of mucoadhesive electrospun chitosan/polyethylene oxide nanofibers facilitates adhesion to the sublingual mucosa[J]. Carbohydrate Polymers, 2020, 242: 116428. DOI:10.1016/j.carbpol.2020.116428 |
 2022, Vol. 58
2022, Vol. 58

