冠状动脉粥样硬化性心脏病(冠心病,CHD)是当今严重威胁人类生命健康的疾病之一。研究证实,炎症与动脉粥样硬化斑块的形成以及CHD相关的心血管事件的发生显著相关[1]。2型糖尿病(T2DM)是一种慢性代谢性疾病,可导致血管病变。CHD与T2DM关系密切,两者共存可以进一步增加心血管事件的发生率和死亡风险[2]。早期诊断CHD合并T2DM病人,有利于早期治疗,改善预后,降低致残致死风险。人血浆脂蛋白磷脂酶A2(Lp-PLA2)可通过调节脂质代谢来介导血管炎症,现有研究发现Lp-PLA2与心血管疾病发病及预后显著相关[3]。C反应蛋白(CRP)是一种炎症标志物,可参与冠状动脉粥样硬化斑块形成[4],已被认为是CHD的可靠标志物,且与T2DM病人的心血管并发症密切相关[5]。目前尚缺乏Lp-PLA2与CRP联合检测评价CHD合并T2DM病人发病风险的研究。本研究旨在探讨Lp-PLA2、CRP联合检测对CHD合并T2DM发病的预测价值,以期为早期识别及干预CHD合并T2DM高危人群、降低疾病危害提供参考。
1 对象和方法 1.1 研究对象本研究为回顾性研究。对2018年6月—2019年12月于青岛大学附属医院心血管内科住院并行冠状动脉造影(CAG)检查的1 364例病人进行筛选。纳入标准:CHD以CAG显示冠状动脉及其主要分支血管狭窄≥50%为诊断标准;T2DM诊断符合《中国2型糖尿病防治指南(2017年版)》的诊断标准[6]。排除标准:严重肝肾功能损害病人;恶性肿瘤病人;近期急慢性感染性疾病病人;有脑血管病病史者;自身免疫性疾病或血液系统疾病病人;心力衰竭、心肌病或冠状动脉旁路移植术后病人;入院前2周服用过他汀类药物病人。最终1 051例病人被纳入研究。根据是否患CHD和T2DM分为4组:非CHD非T2DM组(对照组,A组)268例,单纯CHD组(CHD组,B组)263例,单纯T2DM组(T2DM组,C组)234例以及CHD合并T2DM组(CHD+T2DM组,D组)286例。
1.2 研究方法 1.2.1 临床资料采集收集4组病人的年龄、性别、体质量指数(BMI)、收缩压、舒张压、吸烟史、饮酒史以及体力活动史(每周3次以上、每次不少于30 min的有氧体力活动,包括散步、慢跑、体操、自行车等)等一般资料。收集三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脂蛋白(a)、空腹血糖、Lp-PLA2和CRP等实验室检查指标。各实验室指标检测结果从电子病历系统读取。
1.2.2 CAGCAG采用Judkin技术,造影结果至少由两位经验丰富的心血管介入医师判读。冠状动脉或其分支造影显示管腔狭窄≥50%则为病变血管,以目测法评估血管病变部位、狭窄程度和病变支数。冠状动脉病变血管的狭窄程度采用Gensini评分法[7]进行定量评估。将狭窄程度所对应的评分乘以病变节段所对应的系数,所得分数即为本病变节段评分。总Gensini评分为各节段评分之和。
1.2.3 Lp-PLA2和CRP检测方法病人入院禁食8 h后于清晨空腹时采集肘部静脉血,Lp-PLA2水平检测采用酶联免疫吸附试验(ELISA)法(检测试剂购自天津康尔克生物科技公司),CRP水平检测采用散射免疫比浊法。
1.3 统计学方法应用SPSS 22.0软件进行数据统计分析。采用Kolmogorov-Smirnov(K-S)法对计量资料进行正态性检验,符合正态分布的计量资料以x±s表示,两组比较采用t检验,多组比较采用方差分析,进一步的组间两两比较采用LSD-t检验;计数资料以例数和百分数表示,组间比较采用卡方检验。变量间的相关性分析采用Pearson相关分析。危险因素分析采用Logistic回归分析。应用MedCalc软件绘制受试者工作特征(ROC)曲线,评估Lp-PLA2、CRP以及两者联合检测对CHD合并T2DM发病的预测价值。以P<0.05为差异有统计学意义。
2 结果 2.1 各组病人基本资料比较本文4组病人的性别、年龄、吸烟史、饮酒史、体力活动史等指标比较差异均无统计学意义(P>0.05),而BMI、收缩压、舒张压、TG、TC、LDL-C、HDL-C、脂蛋白(a)、空腹血糖等指标比较差异有显著性(F=8.27~338.73,P<0.05)。CHD+T2DM组病人的BMI、TG、TC、LDL-C、脂蛋白(a) 较CHD组、T2DM组更高(t=2.36~4.99,P<0.05)。见表 1。
| 表 1 各组病人的基本资料比较(x±s) |
|
|
本文4组病人的Lp-PLA2、CRP水平比较差异有统计学意义(F=127.24、84.25,P<0.05),CHD合并T2DM组的Lp-PLA2、CRP水平明显高于对照组、CHD组和T2DM组(t=6.71~19.08,P<0.05)。CHD合并T2DM组病人的病变血管支数、Gensini评分明显高于CHD组(t=-5.97、-9.74,P<0.05)。见表 2。
| 表 2 各组病人Lp-PLA2、CRP、病变血管支数及Gensini评分比较(x±s) |
|
|
析因设计的方差分析结果显示,CHD和T2DM对Lp-PLA2、CRP水平的影响存在交互作用(F=9.67、6.40,P<0.05)。①固定T2DM后的单独效应分析:未患T2DM时,是否患CHD对Lp-PLA2、CRP水平影响的单独效应差异有显著意义(F=70.19、63.70,P<0.05),患CHD病人的Lp-PLA2、CRP水平显著高于未患CHD的病人;患有T2DM时,是否患CHD对Lp-PLA2、CRP水平影响的单独效应差异有显著意义(F=158.99、130.59,P<0.05),患CHD病人的Lp-PLA2、CRP水平显著高于未患CHD病人。②固定CHD后的单独效应分析:未患CHD时,是否患T2DM对Lp-PLA2、CRP水平影响的单独效应差异有显著性(F=32.52、8.47,P<0.05),患T2DM病人的Lp-PLA2、CRP水平显著高于未患T2DM病人;患CHD时,是否患T2DM对Lp-PLA2、CRP水平影响的单独效应差异有统计学意义(F=109.64、45.04,P<0.05),患T2DM病人的Lp-PLA2、CRP水平显著高于未患T2DM病人。
2.4 Lp-PLA2、CRP与Gensini评分相关性分析Pearson相关分析结果显示,在CHD组中,Lp-PLA2、CRP水平与Gensini评分呈正相关(r=0.19、0.17,P<0.05);在CHD+T2DM组中,Lp-PLA2、CRP水平也与Gensini评分呈正相关(r=0.22、0.26,P<0.05),且在CHD+T2DM组中的相关性更好。
2.5 Lp-PLA2、CRP对CHD、T2DM、CHD合并T2DM发病影响的Logistic回归分析以是否患有CHD和T2DM作为因变量(非CHD非T2DM=0,CHD=1,T2DM=3,CHD+T2DM=4),以性别(男=1,女=0)、年龄、BMI、收缩压、舒张压、吸烟史(有吸烟史=1,无吸烟史=0)、饮酒史(有饮酒史=1,无饮酒史=0)、体力活动史(有体力活动史=1,无体力活动史=0)、TG、TC、LDL-C、HDL-C、脂蛋白(a)、空腹血糖、Lp-PLA2和CRP为自变量,校正年龄、BMI、TG、TC、LDL-C、脂蛋白(a)、空腹血糖等的影响,行无序多分类Logistic回归分析。结果显示,Lp-PLA2(OR=1.029,95%CI=1.021~1.037,P<0.001)、CRP(OR=1.668,95%CI=1.376~2.022,P<0.001)是CHD合并T2DM发病的危险因素。见表 3。
| 表 3 Lp-PLA2、CRP对CHD、T2DM、CHD合并T2DM发病影响的Logistic回归分析 |
|
|
ROC曲线分析显示,Lp-PLA2、CRP及两者联合检测预测CHD合并T2DM发病的曲线下面积(AUC)分别为0.814、0.790和0.921。当Lp-PLA2截断值为179 μg/L时,预测的灵敏度为65.03%,特异度为88.06%;当CRP截断值为5.1 mg/L时,预测的灵敏度为67.13%, 特异度为82.46%;两者联合检测预测CHD合并T2DM的灵敏度为80.77%,特异度为89.55%。见图 1。
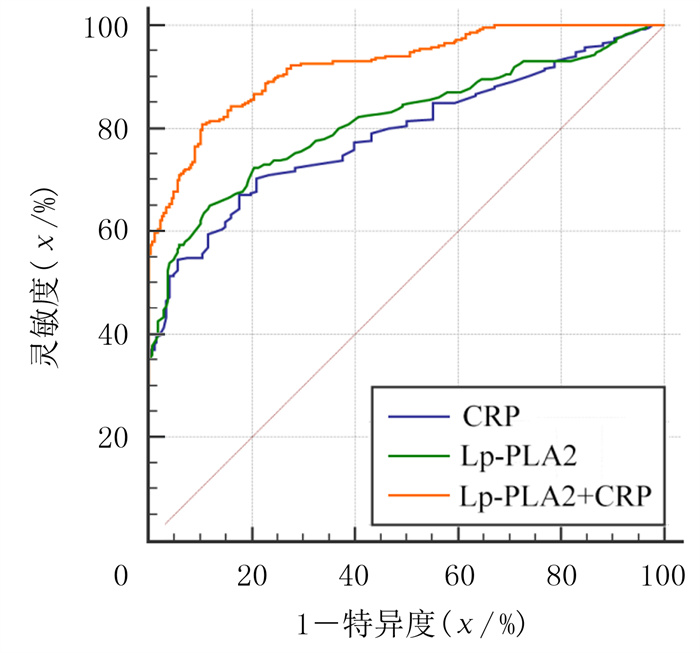 |
| 图 1 Lp-PLA2、CRP及两者联合检测预测CHD合并T2DM的ROC曲线 |
CHD是一类严重危害人类健康的疾病,合并T2DM的CHD病人具有更高的发病风险和病死率。CHD合并T2DM人群起病隐匿,因此早期寻找有效的预测指标,早期给予规范化治疗有利于改善病人预后。
Lp-PLA2是丝氨酸脂肪酶的一种,主要由参与动脉粥样硬化过程的细胞如巨噬细胞等产生[8],在血浆中大部分与低密度脂蛋白(LDL)结合,少部分与高密度脂蛋白(HDL)或极低密度脂蛋白(VLDL)结合,目前被认为是血管炎症和易破裂斑块形成的生物标志物[9]。Lp-PLA2可水解氧化型低密度脂蛋白(ox-LDL),产生活性脂质因子溶血磷脂酰胆碱(Ly-soPC)和氧化游离脂肪酸(ox-FA),此两者是促进炎症和动脉粥样硬化的有效递质[10],参与激活和维持动脉粥样硬化过程[11],并导致内皮功能障碍、泡沫细胞形成、坏死性脂质核心扩张和纤维帽变薄等变化,从而使斑块易于形成及破裂[12]。CRP是一种强有力的炎症标志物,在反映血管炎症方面具有重要临床意义。有证据表明,CRP可以直接参与动脉粥样硬化的形成[13]。CRP致动脉粥样硬化机制可能为:通过上调1型血管紧张素受体表达和增加活性氧(ROS)的产生,促使平滑肌细胞迁移、增殖和血管重塑[14];增强内皮细胞黏附分子的表达,促进单核细胞进入动脉粥样硬化斑块[15];与溶血卵磷脂、脂蛋白等结合后,通过经典途径激活补体系统,产生终末攻击复合物C5b-9,继而造成血管内膜损伤,甚至斑块破裂[16]。
本文研究结果显示,CHD+T2DM组、CHD组、T2DM组的Lp-PLA2及CRP水平显著高于对照组,CHD+T2DM组的Lp-PLA2和CRP水平显著高于CHD组、T2DM组,CHD和T2DM对Lp-PLA2、CRP水平升高影响存在交互作用。GARG等[17]通过大样本随访研究发现,Lp-PLA2水平与包括CHD在内的心血管事件发生风险明显相关。有学者通过体外动脉粥样硬化细胞模型发现,Lp-PLA2水平升高可导致内皮功能障碍以及加重动脉硬化[18]。JACKISCH等[19]研究认为,Lp-PLA2可提高T2DM病人ox-LDL循环水平,进而促进血管炎症和粥样硬化形成。JIA等[20]研究证实,CRP水平升高与CHD病人心绞痛症状相关,可能是CHD事件发生的致病因素。CRP在糖尿病病人中同样具有重要意义,ARYAN等[21]进行的为期7.5年的随访研究发现,CRP可导致T2DM病人的CHD事件和微血管并发症。上述研究提示,在CHD及糖尿病病人中均存在炎症反应,CHD病人合并T2DM可加重炎症反应,Lp-PLA2和CRP在CHD合并T2DM病人的冠状动脉病变发病过程中起到促进作用。本研究结果表明,与CHD组比较,CHD+T2DM组病人病变血管支数更多,Gensini积分也更高,在CHD组和CHD+T2DM组中,Lp-PLA2、CRP均与Gensini积分呈正相关,且两个指标在CHD+T2DM组中的相关性更好。这提示在CHD合并糖尿病人群中冠状动脉病变程度更重,其危险性更值得关注。
本研究Logistic回归分析结果显示,Lp-PLA2、CRP是CHD合并T2DM病人发病的危险因素。进一步的ROC曲线分析结果显示,Lp-PLA2、CRP对CHD合并T2DM发病均有一定预测价值,而且相比于单独检测,两个指标联合检测可提高预测的灵敏度和特异度。现有研究表明,Lp-PLA2是人群中CHD发病的危险因素及独立预测指标[22-23]。最近有荟萃分析结果表明,血浆Lp-PLA2水平升高与动脉粥样硬化的发展相关,并与糖尿病病人的心血管风险显著相关[24]。BOSEVSKI等[25]研究结果显示,CRP水平是T2DM和糖尿病合并血管疾病病人发病及预后的危险因素。目前认为,及早发现和管理危险因素有利于CHD及糖尿病病人的预防与诊疗[26-27]。因此,Lp-PLA2与CRP作为CHD合并T2DM的独立危险因素,对其及早干预将有重要意义,而且两个指标检测成本低,检测方法便捷,可以为CHD合并T2DM的早期筛查、早期诊治提供新的参考。
目前暂无CRP自身的特异性抑制剂或拮抗剂,Lp-PLA2的抑制剂因其治疗效果不明显现未应用于临床治疗[28]。有研究显示,他汀类药物可明显降低循环血液中Lp-PLA2、CRP的水平,降低心血管事件的发生率[29-30]。他汀类药物降低CRP水平的作用机制可能为:稳定斑块,减轻炎症反应,从而减少触发CRP合成的相关递质;干扰CRP基因表达以及提高CRP的分解速率[31]。而且他汀类药物具有减少巨噬细胞浸润、抗氧化等多种作用,从而可以减少巨噬细胞Lp-PLA2的分泌[32]。本研究排除了入院前有他汀类药物服用史的病人,以避免该药对CRP、Lp-PLA2水平的影响,后续将在CHD合并T2DM确诊人群的治疗中,进一步追踪观察他汀类药物降低CRP、Lp-PLA2循环水平的效果及对于不良心血管事件的改善情况。
综上所述,本研究结果表明,Lp-PLA2与CRP是CHD合并T2DM发病的危险因素,两者对CHD合并T2DM的发病有一定预测价值,Lp-PLA2、CRP联合检测则可以提高预测CHD合并T2DM的灵敏度和特异度。本文研究结果为CHD合并糖尿病人群的早期筛查、早期治疗提供了新的思路,但该研究结果仍需更大样本量、多中心联合以及更深入的研究加以证实。
| [1] |
YANG L, LIU Y, WANG S F, et al. Association between Lp-PLA2 and coronary heart disease in Chinese patients[J]. The Journal of International Medical Research, 2017, 45(1): 159-169. DOI:10.1177/0300060516678145 |
| [2] |
AL-SALAMEH A, CHANSON P, BUCHER S, et al. Car-diovascular disease in type 2 diabetes: a review of sex-related differences in predisposition and prevention[J]. Mayo Clinic Proceedings, 2019, 94(2): 287-308. DOI:10.1016/j.mayocp.2018.08.007 |
| [3] |
JENSEN M K, BERTOIA M L, CAHILL L E, et al. Novel metabolic biomarkers of cardiovascular disease[J]. Nature Reviews Endocrinology, 2014, 10(11): 659-672. DOI:10.1038/nrendo.2014.155 |
| [4] |
KALYONCUOGLU M, DURMUS G. Relationship between C-reactive protein-to-albumin ratio and the extent of coronary artery disease in patients with non-ST-elevated myocardial infarction[J]. Coronary Artery Disease, 2020, 31(2): 130-136. DOI:10.1097/MCA.0000000000000768 |
| [5] |
CHUENGSAMARN S, RATTANAMONGKOLGUL S, SITTITHUMCHAREE G, et al. Association of serum high-sensitivity C-reactive protein with metabolic control and diabetic chronic vascular complications in patients with type 2 diabetes[J]. Diabetes & Metabolic Syndrome, 2017, 11(2): 103-108. |
| [6] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中国实用内科杂志, 2018, 38(4): 292-344. |
| [7] |
MARINI A, NAKA K K, VAKALIS K, et al. Extent of coronary artery disease in patients undergoing angiography for stable or acute coronary syndromes[J]. Hellenic Journal of Car-diology, 2017, 58(2): 115-121. DOI:10.1016/j.hjc.2016.08.004 |
| [8] |
GURUNG A B, BHATTACHARJEE A. Impact of tyrosine nitration at positions Tyr307 and Tyr335 on structural dyna-mics of Lipoprotein-associated phospholipase A2-A therapeutically important cardiovascular biomarker for atherosclerosis[J]. International Journal of Biological Macromolecules, 2018, 107(Pt B): 1956-1964. |
| [9] |
WANG Y X, ZHOU B, ZHOU P G, et al. Association of li-poprotein-associated phospholipase A2 mass with asymptoma-tic cerebral artery stenosis[J]. Journal of Cellular and Molecular Medicine, 2018, 22(4): 2329-2336. DOI:10.1111/jcmm.13521 |
| [10] |
GURUNG A B, BHATTACHARJEE A. Impact of a non-sy-nonymous Q281R polymorphism on structure of human Lipoprotein-Associated Phospholipase A2 (Lp-PLA2)[J]. Journal of Cellular Biochemistry, 2018, 119(8): 7009-7021. DOI:10.1002/jcb.26909 |
| [11] |
MATTINA A, ROSENBAUM D, BITTAR R, et al. Lipoprotein-associated phospholipase A2 activity is increased in patients with definite familial hypercholesterolemia compared with other forms of hypercholesterolemia[J]. Nutrition, Metabolism, and Cardiovascular Diseases: NMCD, 2018, 28(5): 517-523. DOI:10.1016/j.numecd.2018.01.012 |
| [12] |
ROSENSON R S, HURT-CAMEJO E. Phospholipase A2 enzymes and the risk of atherosclerosis[J]. European Heart Journal, 2012, 33(23): 2899-2909. DOI:10.1093/eurheartj/ehs148 |
| [13] |
HERMANS M P, AHN S A, ROUSSEAU M F. Increased CRP: an extended biomarker of microvascular risk in men with type 2 diabetes[J]. Journal of Diabetes and Its Complications, 2019, 33(11): 107413. DOI:10.1016/j.jdiacomp.2019.107413 |
| [14] |
KOSMAS C E, SILVERIO D, SOURLAS A, et al. Anti-inflammatory therapy for cardiovascular disease[J]. Annals of Translational Medicine, 2019, 7(7): 147. DOI:10.21037/atm.2019.02.34 |
| [15] |
BADIMON L, PEÑA E, ARDERIU G, et al. C-reactive protein in atherothrombosis and angiogenesis[J]. Frontiers in Immunology, 2018, 9: 430. DOI:10.3389/fimmu.2018.00430 |
| [16] |
宫晓飞, 王红巧, 张帅, 等. 冠心病病人血清apoB与hs-CRP浓度变化及其意义[J]. 青岛大学医学院学报, 2013, 49(1): 44-46. |
| [17] |
GARG P K, MCCLELLAND R L, JENNY N S, et al. Lipoprotein-associated phospholipase A2 and risk of incident cardiovascular disease in a multi-ethnic cohort: the multi ethnic study of atherosclerosis[J]. Atherosclerosis, 2015, 241(1): 176-182. DOI:10.1016/j.atherosclerosis.2015.05.006 |
| [18] |
YANG L, CONG H L, WANG S F, et al. AMP-activated protein kinase mediates the effects of lipoprotein-associated phospholipase A2 on endothelial dysfunction in atherosclerosis[J]. Experimental and Therapeutic Medicine, 2017, 13(4): 1622-1629. DOI:10.3892/etm.2017.4142 |
| [19] |
JACKISCH L, KUMSAIYAI W, MOORE J D, et al. Diffe-rential expression of Lp-PLA2 in obesity and type 2 diabetes and the influence of lipids[J]. Diabetologia, 2018, 61(5): 1155-1166. DOI:10.1007/s00125-018-4558-6 |
| [20] |
JIA R F, LI L, LI H, et al. Meta-analysis of C-reactive protein and risk of angina pectoris[J]. The American Journal of Cardiology, 2020, 125(7): 1039-1045. DOI:10.1016/j.amjcard.2020.01.005 |
| [21] |
ARYAN Z, GHAJAR A, FAGHIHI-KASHANI S, et al. Baseline high-sensitivity C-reactive protein predicts macrovascular and microvascular complications of type 2 diabetes: a population-based study[J]. Annals of Nutrition & Metabolism, 2018, 72(4): 287-295. |
| [22] |
PRASAD M, LENNON R, BARSNESS G W, et al. Chronic inhibition of lipoprotein-associated phospholipase A2 does not improve coronary endothelial function: a prospective, rando-mized-controlled trial[J]. International Journal of Cardiology, 2018, 253: 7-13. DOI:10.1016/j.ijcard.2017.09.171 |
| [23] |
OTSUKA F, ZHAO X Q, TROUT H H, et al. Community-based statins and advanced carotid plaque: role of CD163 positive macrophages in lipoprotein-associated phospholipase A2 activity in atherosclerotic plaque[J]. Atherosclerosis, 2017, 267: 78-89. |
| [24] |
HUANG F B, WANG K, SHEN J H. Lipoprotein-associated phospholipase A2: the story continues[J]. Medicinal Research Reviews, 2020, 40(1): 79-134. DOI:10.1002/med.21597 |
| [25] |
BOSEVSKI M, BOSEVSKA G, STOJANOVSKA L, et al. CRP and fibrinogen imply clinical outcome of patients with Type-2 diabetes and coronary artery disease[J]. Acta Biochi-mica et Biophysica Sinica, 2017, 49(3): 284-285. |
| [26] |
HOUSTON M, MINICH D, SINATRA S T, et al. Recent science and clinical application of nutrition to coronary heart disease[J]. Journal of the American College of Nutrition, 2018, 37(3): 169-187. DOI:10.1080/07315724.2017.1381053 |
| [27] |
PARSONS C, AGASTHI P, MOOKADAM F, et al. Reversal of coronary atherosclerosis: role of life style and medical ma-nagement[J]. Trends in Cardiovascular Medicine, 2018, 28(8): 524-531. |
| [28] |
KOTTOOR S J, ARORA R R. The utility of anti-inflammatory agents in cardiovascular disease: a novel perspective on the treatment of atherosclerosis[J]. Journal of Cardiovascular Pharmacology and Therapeutics, 2018, 23(6): 483-493. |
| [29] |
REN Y Z, ZHU H, FAN Z G, et al. Comparison of the effect of rosuvastatin versus rosuvastatin/ezetimibe on markers of inflammation in patients with acute myocardial infarction[J]. Experimental and Therapeutic Medicine, 2017, 14(5): 4942-4950. |
| [30] |
RUSCICA M, FERRI N, MACCHI C, et al. Lipid lowering drugs and inflammatory changes: an impact on cardiovascular outcomes[J]. Annals of Medicine, 2018, 50(6): 461-484. |
| [31] |
ARÉVALO-LORIDO J C. Clinical relevance for lowering C-reactive protein with statins[J]. Annals of Medicine, 2016, 48(7): 516-524. |
| [32] |
ZHENG D D, CAI A P, XU R L, et al. Effects and potential mechanism of atorvastatin treatment on Lp-PLA2 in rats with dyslipidemia[J]. Archives of Medical Science: AMS, 2018, 14(3): 629-634. |
 2022, Vol. 58
2022, Vol. 58

