2. 滨州医学院基础医学院生理学教研室
慢性肾脏疾病(CKD)是一种临床病理综合征,以持续的肾脏结构和(或)功能发生改变为特征[1]。常见构建急性肾损伤(AKI)-CKD模型方法包括缺血再灌注和毒性物质诱导两种方式,其中前者包括单侧及双侧肾血管夹闭,后者包括白喉毒素、马兜铃酸、叶酸、顺铂等诱导[2]。顺铂是一种强效化疗药物,广泛用于治疗各种实体瘤。人体使用顺铂后会出现多种不良反应,而肾毒性是临床应用顺铂的主要不良反应[3]。过去数十年中,顺铂肾毒性的发病机制在AKI中被广泛研究[4-5]。然而,临床上顺铂治疗肿瘤往往每周1次或每月1次,顺铂长期应用导致了CKD。为了更好地模拟临床化疗药物对肾脏的慢性影响,通常应用多次低剂量顺铂注射的方法来制备模型。虽然不断有研究从小鼠、大鼠、猴子等不同动物到顺铂注射次数以及注射剂量,对多次低剂量顺铂诱导CKD进行摸索[6-8],但至今仍未有一个公认的模型来模拟临床长期使用顺铂所导致的慢性肾功能不全。本研究旨在改良并完善顺铂诱导小鼠CKD模型,研究其肾功能、组织结构及分子水平改变,为进一步研究顺铂导致肾纤维化和慢性炎症提供更好模型。
1 材料与方法 1.1 实验材料 1.1.1 实验动物选择成年健康雄性C57BL/6小鼠,SPF级,8、12和16周龄小鼠分别为90、20和20只,购自维通利华(CHN)公司。
1.1.2 药物与试剂顺铂(美国MCE生物科技有限公司);PCR引物(上海生工生物工程股份有限公司);小鼠血肌酐(Scr)、血尿素氮(BUN)酶联免疫吸附试验(ELISA)检测试剂盒(江苏酶标生物科技有限公司);马松三色(MT)染色试剂盒(北京索莱宝科技有限公司);TRIzol Reagent(15596026)、Po-werUpTM SYBRⓇ Green预混液、RIPA裂解液(美国Thermo Fisher公司);PrimeScript RT reagent Kit with gDNA Eraser(日本Takara公司);DAPI(北京索莱宝科技有限公司);兔多克隆抗体anti-Fibronectin(英国abcam公司),山羊单克隆抗体anti-Type Ⅰcollagen(美国SouthernBiotech公司),大鼠单克隆抗体anti-F4/80(美国Thermo Fisher公司),兔单克隆抗体anti-CD3(美国Novus Biologicals公司),羊抗兔二抗、兔抗大鼠二抗、兔抗小鼠二抗(美国Cell Signaling Technology公司)。
1.2 实验方法 1.2.1 动物模型建立及分组取40只8周龄雄性C57BL/6小鼠,随机分为2组(每组20只),用于观察不同剂量(7和9 mg/kg)顺铂注射后小鼠生存率。取8、12、16周龄雄性C57BL/6小鼠各20只,用于观察顺铂(7 mg/kg,每周1次,共4次)注射后小鼠生存率。取30只8周龄雄性C57BL/6小鼠(每只体质量22~25 g),随机分为对照组、实验1组和实验2组,每组10只。实验组小鼠以7 mg/kg剂量顺铂(溶解于生理盐水)腹腔注射,每周1次,连续注射4次,对照组则同法腹腔注射等体积的无菌生理盐水。对照组小鼠在注射后第42天,实验1组和实验2组小鼠分别在注射后第24和42天,摘眼球取血和剖腹取肾,进行后续实验分析。
1.2.2 血清的制备及保存将血液样本室温静置2 h,在4 ℃下以3 000 r/min离心15 min。用移液器小心收取上清,-80 ℃冻存保存。
1.2.3 肾组织取材腹腔注射戊巴比妥钠30 mg/kg麻醉小鼠,并固定小鼠四肢于实验台上,沿腹部中线剖开腹腔,暴露肾脏并剥去肾包膜。取出一侧肾脏保存于-80 ℃冰箱中备用;另一侧肾脏取出后用刀片沿纵轴对半切开,一半固定于40 g/L的多聚甲醛中,另一半用OCT包埋用于冷冻切片。
1.2.4 血清Scr和BUN水平的测定使用Scr和BUN的ELISA试剂盒测定其水平。
1.2.5 肾组织学检查常规方法制备肾组织石蜡切片[9],切片厚度为4 μm,进行苏木精-伊红(HE)染色和MT染色,光镜下拍照。HE染色用于观察小鼠肾组织结构改变和炎症细胞的浸润。MT染色后在光学显微镜(200倍)下观察蓝染胶原纤维,每组取5个视野,用Image J图像分析软件计算肾脏胶原纤维量。
1.2.6 肾组织免疫荧光(IF)检测取出-80 ℃保存的肾组织,切片(8 μm),用冰甲醇固定15 min,封闭液室温封闭1 h;加入一抗Ly6G(1∶200)、F4/80(1∶200)、CD3(1∶200)、胶原纤维1α1(Col1α1,1∶100)和纤连蛋白(Fn,1∶100),4 ℃孵育过夜;以PBS洗3次,每次10 min;加入对应二抗,室温孵育2 h;以PBS洗3次,每次10 min;使用DAPI染核5 min;以PBS洗4次,每次5 min;用moviol封片,激光共聚焦显微镜拍照观察。
1.2.7 肾组织RNA的提取及实时荧光定量PCR(RT-qPCR)检测取小鼠肾脏组织100 mg,放入1.5 mL Trizol中匀浆,取1 mL置于1.5 mL无酶无菌EP管中,匀浆机充分匀浆,利用沉淀法(氯仿、异丙醇)提取RNA。对相应RNA进行逆转录、实时荧光定量,以Actb作为内参照,计算目的基因的2-△△Ct值,以其作为目的基因的相对表达水平。实验所用引物序列见表 1。
| 表 1 小鼠RT-qPCR引物序列 |
|
|
应用GraphPad Prism 5软件进行统计学分析。正态分布计量数据以x±s表示,3组数据比较采用单因素方差分析,组间两两比较采用Tukey分析。
2 结果 2.1 不同剂量顺铂对小鼠生存率的影响注射第24天时,7 mg/kg顺铂注射小鼠的生存率为100%,9 mg/kg顺铂注射小鼠生存率为10%。注射第42天时,7 mg/kg顺铂注射小鼠生存率为90%。因此,选取7 mg/kg作为合适注射剂量进行后续实验。
2.2 顺铂注射对不同周龄小鼠生存率的影响顺铂注射第42天时,8周龄小鼠的生存率为90.0%,12周龄小鼠生存率为37.5%,16周龄小鼠生存率为0。因此,选用8周龄小鼠进行后续实验。
2.3 顺铂注射对肾功能的影响实验1组、实验2组小鼠血清Scr和BUN水平较对照组显著升高,实验2组小鼠血清Scr和BUN水平较实验1组显著升高,差异均有统计学意义(F=12.05、41.89,P<0.01)。见表 2。
| 表 2 各组小鼠血清Scr和BUN水平比较(n=7,ρ/mg·L-1,x±s) |
|
|
实验1组和实验2组小鼠肾小球和肾小管间质均发现胶原纤维沉积,以小管间质程度更重,可见肾间质增宽以及炎性细胞聚集。实验1组蓝染胶原纤维少,实验2组蓝染胶原纤维比实验1组显著增多。见图 1。对小鼠肾纤维化程度进行定量检测结果显示,与对照组相比,实验1组和实验2组小鼠肾纤维化面积显著增加,实验2组肾纤维化面积则较实验1组显著增加(F=78.87,P<0.01)。见表 3。
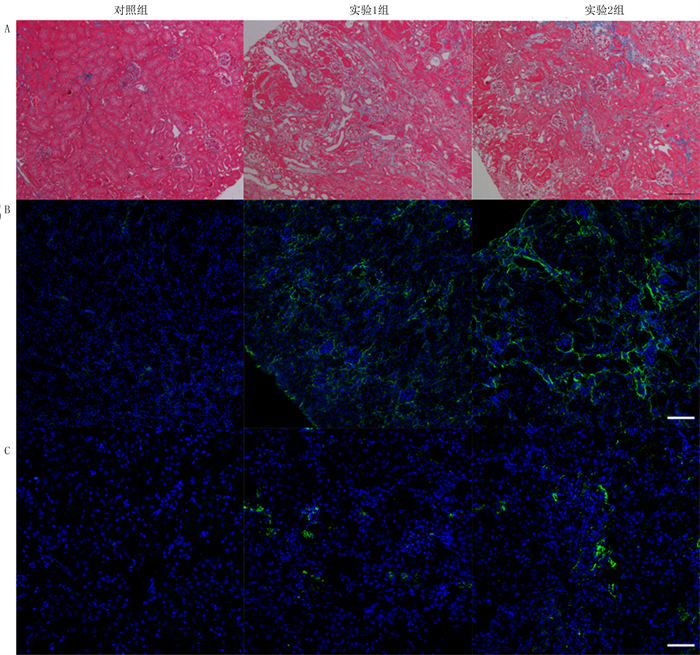 |
| A:MT染色,200倍;B、C:IF检测肾组织Col1α1和Fn表达,200倍。 图 1 顺铂注射对小鼠肾纤维化的影响 |
| 表 3 各组小鼠肾组织纤维化面积及相关基因表达水平的比较(n=7,x±s) |
|
|
mRNA及蛋白表达水平变化与对照组相比,实验1组和实验2组小鼠肾组织中Col1α1和Fn mRNA表达水平明显升高,且实验2组二者水平比实验1组更高(F=37.01、57.10,P<0.01)。见表 3。IF染色结果显示,对照组Col1α1和Fn基本无阳性信号,实验1组阳性信号增多不明显,但实验2组阳性信号显著增多。见图 1。
2.5 顺铂注射对肾脏炎症反应的影响HE染色结果显示,实验1组和实验2组小鼠肾组织结构紊乱,小管扩张,小管刷状缘部分脱落和坏死,大量白细胞浸润;相较于实验1组,实验2组炎性细胞浸润显著增多。IF结果显示,与对照组比较,实验1组和实验2组CD3+T细胞和F4/80+巨噬细胞浸润增多,以实验2组更加明显。见图 2。RT-qPCR结果显示,与对照组相比,实验1组和实验2组小鼠肾组织炎症相关细胞因子白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、单核细胞趋化蛋白1(MCP-1)和肿瘤坏死因子α(TNF-α)mRNA表达水平显著升高,且实验2组IL-1β、MCP-1和TNF-α mRNA的表达水平比实验1组更高(F=10.24~86.82,P<0.01)。见表 4。
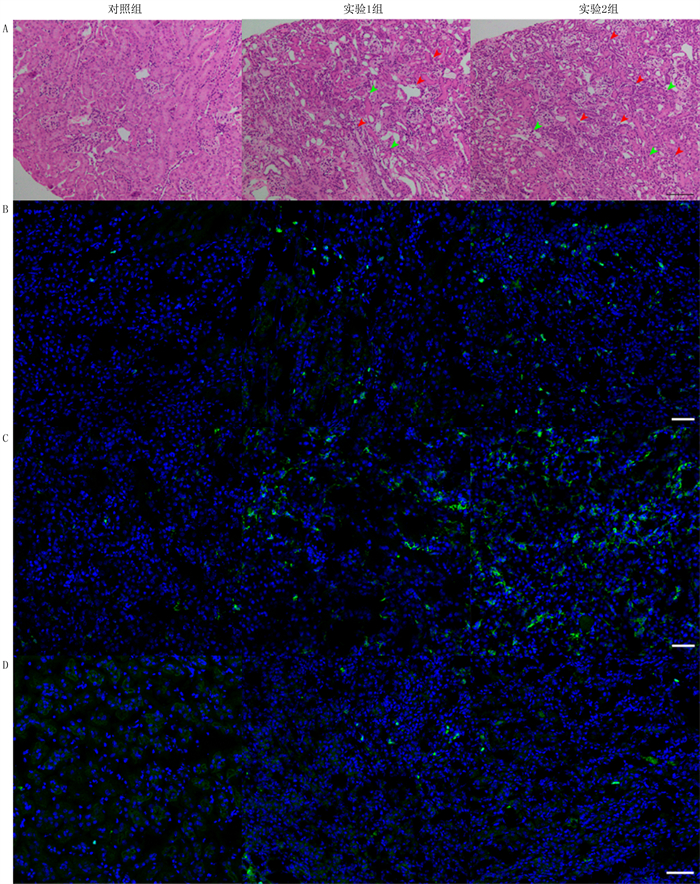 |
| A:HE染色,200倍,红色箭头示淋巴细胞,绿色箭头示巨噬细胞;B、C、D:IF检测CD3+T淋巴细胞、F4/80+巨噬细胞和Ly6G中性粒细胞表达,200倍。 图 2 顺铂注射对小鼠肾脏炎症反应的影响 |
| 表 4 各组小鼠肾组织炎性细胞因子mRNA表达水平的比较(n=6,x±s) |
|
|
CKD发生发展过程中,伴随持续的肾功能和结构改变,肾小球滤过及肾小管重吸收、排泄功能均发生不同程度障碍。肾纤维化,尤其是肾小管间质纤维化是所有肾脏疾病最终导致慢性肾衰竭的共同途径[10]。临床上顺铂化疗引起的肾毒性一直是个棘手的问题。因此,探寻一个好的动物模型来模拟临床上顺铂导致的CKD,对于研究顺铂长期肾毒性的机制尤为重要。
本研究采用反复低剂量顺铂注射的方法构建小鼠CKD模型。首先本研究根据文献报道对小鼠注射9 mg/kg的顺铂(每周1次,共4次)[11],结果显示注射第24天时小鼠的存活率仅为10%,而将顺铂剂量降低为7 mg/kg,则注射第24天时小鼠的存活率达100%,故选取7 mg/kg作为合适的注射剂量。另外,有研究表明,小鼠周龄因素和顺铂诱导的肾毒性具有相关性[12]。故本研究对不同周龄小鼠进行7 mg/kg顺铂注射,结果显示,8、12、16周龄小鼠注射第42天时的存活率分别为90.0%、37.5%和0,因此选用8周龄小鼠进行后续实验。顺铂注射第24、42天时,小鼠血清Scr和BUN水平显著升高,说明肾功能严重受损。进一步观察肾组织的病理变化,MT染色结果显示,在顺铂注射第24、42天时,小鼠肾纤维化明显,且第42天时的纤维化程度显著高于第24天。与此同时,在顺铂所致的CKD模型中,炎性细胞浸润明显,尤其是CD3+T细胞以及F4/80+巨噬细胞浸润明显增强,部分细胞因子(IL-1β、IL-6、MCP-1、TNF-α)水平显著升高。上述实验结果在一定程度上说明肾脏慢性炎症与肾纤维化和肾功能障碍有着密切联系。
既往大多数研究结果表明,顺铂肾毒性急性期伴随着大量炎性细胞浸润和炎症相关细胞因子水平升高[13-14],但尚未明确顺铂肾毒性慢性期慢性炎症和肾纤维化的关系[15]。本研究通过小鼠肾脏HE染色和炎性细胞IF检测证实,雄性C57BL/6小鼠顺铂注射后,肾脏炎症细胞浸润程度和肾纤维化程度具有一定相关性。
本研究构建的CKD小鼠模型与有关文献报道的模型相比有一定的优势。首先,从注射剂量来看,有研究注射10、15 mg/kg顺铂导致小鼠生存率过低[16],无法保证实验研究顺利进行,而本研究使用7 mg/kg剂量顺铂,小鼠耐受性高,注射第42天时生存率能够达到90%,可以保证实验顺利进行。其次,从顺铂注射次数来看,有研究结果显示,注射1次、2次诱导的肾纤维化不明显[17],而本研究采用4次注射较易诱导出明显的肾纤维化。有文献报道,7 mg/kg剂量顺铂注射在第24天时不能诱导出明显的肾纤维化[11]。本研究结果显示,顺铂注射第24天时肾纤维化程度轻微,当时间延长至第42天时,肾纤维化非常明显,与部分研究造模时间长达数月相比,极大提高了构建模型的效率[18]。
综上所述,低剂量顺铂反复注射(7 mg/kg,每周1次,共4次)既能保证小鼠生存率,又能较好地引起肾纤维化,且在病变过程中伴随着较强烈的炎症反应和一定程度的肾功能障碍。此模型能够很好地模拟临床上顺铂导致的CKD,能够为顺铂导致肾损伤的研究提供简便可靠的动物实验模型。
| [1] |
ZOCCALI C, VANHOLDER R, MASSY Z A, et al. The systemic nature of CKD[J]. Nature Reviews Nephrology, 2017, 13(6): 344-358. DOI:10.1038/nrneph.2017.52 |
| [2] |
FU Y, TANG C Y, CAI J, et al. Rodent models of AKI-CKD transition[J]. American Journal of Physiology Renal Physiology, 2018, 315(4): F1098-F1106. DOI:10.1152/ajprenal.00199.2018 |
| [3] |
SÁNCHEZ-GONZÁLEZ P D, LÓPEZ-HERNÁNDEZ F J, LÓPEZ-NOVOA J M, et al. An integrative view of the pathophysiological events leading to cisplatin nephrotoxicity[J]. Critical Reviews in Toxicology, 2011, 41(10): 803-821. DOI:10.3109/10408444.2011.602662 |
| [4] |
SANTOS N A G, CARVALHO RODRIGUES M A, MARTINS N M, et al. Cisplatin-induced nephrotoxicity and targets of nephroprotection: an update[J]. Archives of Toxicology, 2012, 86(8): 1233-1250. DOI:10.1007/s00204-012-0821-7 |
| [5] |
谢立平. 顺铂肾毒性早期发病机理的初步研究[J]. 实用肿瘤杂志, 1996(6): 268-270. |
| [6] |
BLACK L M, LEVER J M, TRAYLOR A M, et al. Divergent effects of AKI to CKD models on inflammation and fibrosis[J]. American Journal of Physiology Renal Physiology, 2018, 315(4): F1107-F1118. DOI:10.1152/ajprenal.00179.2018 |
| [7] |
AL ZA'ABI M, AL SALAM S, AL SULEIMANI Y, et al. Effects of repeated increasing doses of cisplatin as models of acute kidney injury and chronic kidney disease in rats[J]. Naunyn- Schmiedeberg's Archives of Pharmacology, 2021, 394(2): 249-259. DOI:10.1007/s00210-020-01976-1 |
| [8] |
MOGHADASALI R, HAJINASROLLAH M, ARGANI H, et al. Autologous transplantation of mesenchymal stromal cells tends to prevent progress of interstitial fibrosis in a rhesus Macaca mulatta monkey model of chronic kidney disease[J]. Cytotherapy, 2015, 17(11): 1495-1505. DOI:10.1016/j.jcyt.2015.06.006 |
| [9] |
方薇. Gpr97在急性肾损伤中的作用及机制研究[D]. 济南: 山东大学, 2018.
|
| [10] |
KUNCIO G S, NEILSON E G, HAVERTY T. Mechanisms of tubulointerstitial fibrosis[J]. Kidney International, 1991, 39(3): 550-556. DOI:10.1038/ki.1991.63 |
| [11] |
SEARS S M, SHARP C N, KRUEGER A, et al. C57BL/6 mice require a higher dose of cisplatin to induce renal fibrosis and CCL2 correlates with cisplatin-induced kidney injury[J]. American Journal of Physiology Renal Physiology, 2020, 319(4): F674-F685. DOI:10.1152/ajprenal.00196.2020 |
| [12] |
ESPANDIARI P, ROSENZWEIG B, ZHANG J, et al. Age-related differences in susceptibility to cisplatin-induced renal toxicity[J]. Journal of Applied Toxicology: JAT, 2010, 30(2): 172-182. |
| [13] |
TAN R Z, LIU J, ZHANG Y Y, et al. Curcumin relieved cisplatin-induced kidney inflammation through inhibiting Mincle-maintained M1 macrophage phenotype[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2019, 52: 284-294. DOI:10.1016/j.phymed.2018.09.210 |
| [14] |
CANO-PEÑALVER J L, GRIERA M, GARCÍA-JEREZ A, et al. Renal integrin-linked kinase depletion induces kidney cGMP-axis upregulation: consequences on basal and acutely damaged renal function[J]. Molecular Medicine (Cambridge, Mass), 2016, 21(1): 873-885. |
| [15] |
SHARP C N, DOLL M, DUPRE T V, et al. Moderate aging does not exacerbate cisplatin-induced kidney injury or fibrosis despite altered inflammatory cytokine expression and immune cell infiltration[J]. American Journal of Physiology Renal Physiology, 2019, 316(1): F162-F172. DOI:10.1152/ajprenal.00463.2018 |
| [16] |
GO R S, ADJEI A A. Review of the comparative pharmacology and clinical activity of cisplatin and carboplatin[J]. Journal of Clinical Oncology, 1999, 17(1): 409. DOI:10.1200/JCO.1999.17.1.409 |
| [17] |
SU H, YE C, LEI C T, et al. Subcellular trafficking of tubular MDM2 implicates in acute kidney injury to chronic kidney disease transition during multiple low-dose cisplatin exposure[J]. FASEB Journal, 2020, 34(1): 1620-1636. DOI:10.1096/fj.201901412R |
| [18] |
陆斯斯. 单次临床剂量顺铂诱导大鼠肾间质纤维化及金纳多注射液对其改善作用的研究[D]. 南宁: 广西医科大学, 2018.
|
 2021, Vol. 57
2021, Vol. 57

