2. 四川省骨科医院膝关节运动损伤科, 四川 成都 610041
类风湿关节炎(RA)是人体关节滑膜病变出现的慢性炎症反应,导致病人出现不同程度关节破坏的疾病[1-2]。目前我国RA患病率为0.42%,病程越长病人致残率越高,其中病程超过15年者致残率可高达61.3%[3-4]。既往资料显示,成纤维样滑膜细胞(FLS)在RA病人中呈病态上升,而其凋亡下降,形成血管翳侵蚀软骨,最终导致关节功能障碍甚至丧失,严重影响病人身心健康及生活质量[5-6]。在RA中,激活FLS由多信号通路决定,而Wnt信号通路具有重要性,被认为参与了RA发生发展[6-7]。锌指环指蛋白3(ZNRF3)是一种Wnt通路调控蛋白,可经泛素化降解细胞膜表面Wnt蛋白受体卷曲蛋白,从而对Wnt信号通路活性产生抑制作用[8-9]。目前关于ZNRF3的研究主要集中于肿瘤细胞中,对RA研究较少。本研究探讨ZNRF3在RA病人滑膜组织及细胞中表达,并分析其与疾病发生的关系。现将结果报告如下。
1 资料与方法 1.1 实验材料 1.1.1 对象选择2018年3月—2020年3月,选择我院收治一侧RA膝关节病变病人20例,男6例,女14例,年龄(44.32±9.65)岁。红细胞沉降率为(39.84±16.56)mm/1 h,C反应蛋白为(20.42±12.65)mg/L。根据病人病灶组织位置分为观察组(病变侧,RA侧)与对照组(正常侧,C侧)。纳入标准:①符合《2018中国类风湿关节炎诊疗指南》中相关诊断标准[10];②临床资料完整;③正常组织侧滑膜组织及检测部位无外伤,无其他炎症性疾病或一侧关节慢性疾病。排除标准:①其他肌肉骨骼疾病者;②合并重要脏器疾病者。本研究通过我院医学伦理委员会批准,所有病人及家属均知情同意。
1.1.2 主要试剂与仪器包括免疫组化、实时定量聚合酶链反应(qPCR)、Western blot方法的主要试剂与仪器。仪器:Rigel S2流式细胞仪(上海睿钰生物科技有限公司),微量分光光度仪(美国哈希,DR 6000型),光学显微镜(奥林巴斯,CX43型),PCR仪(美国罗氏,LC480型)。试剂:Anti-ZNRF3一抗(上海瑞齐生物技术有限公司),ZNRF3二抗(微蒙上海生物科技有限公司),CD29、CD90抗体(英国BioLegend公司),Vimentin、CD68一抗(美国Santa Cruz公司),Ⅱ型胶原酶(美国Sigma公司),TRIzal试剂(赛默飞世尔科技中国有限公司),RT Master Mix试剂盒(上海力敏实业有限公司),GAPDH一抗(武汉赛维尔公司)。
1.2 实验方法 1.2.1 标本收集与处理采用膝关节穿刺术收集RA病人两侧滑膜。将滑膜组织置入含体积分数为0.10双抗磷酸盐缓冲液(PBS)的离心管中(存放冰盒)送检。在生物安全柜中采用体积分数0.10的PBS清洗标本,并分离标本上血管和脂肪组织。将处理后标本分3份:第1份用于多聚甲醛固定;第2份处理成小块,放入冻存管中置液氮罐内10 min,再置入-80 ℃冰箱中备用;第3份放入新培养皿中,用于提取FLS。
1.2.2 苏木精-伊红(HE)染色及评分RA滑膜常规进行HE染色后,采用光学显微镜观察RA滑膜病理变化并记录。滑膜HE染色评分标准见表 1。
| 表 1 RA滑膜染色评分标准 |
|
|
按照文献方法[11]进行免疫组化染色。采用光镜高倍视野观察细胞改变。免疫组化染色半定量评分标准[12]如下。阳性细胞百分比评分:0分,无阳性细胞;1分,阳性细胞<25%;2分,阳性细胞25%~50%;3分,阳性细胞51%~75%;4分,阳性细胞>75%。阳性细胞染色强弱评分:0分,无着色;1分,淡黄色;2分,棕黄色;3分,棕褐色。
1.2.4 FLS分离与培养及细胞鉴定FLS分离及培养参考文献方法[13]进行。细胞鉴定采用PBS清洗第3代冻存FLS共2次,胰蛋白酶消化后终止消化。1 200 r/min离心5 min,去培养基、PBS清洗。加1 mL单细胞悬液,并加CD90、CD29抗体行免疫荧光染色,设阴性对照。避光孵育20 min,用PBS清洗,加缓冲重悬液,采用Rigel S2流式细胞仪进行检测。
1.2.5 qPCR检测提取细胞RNA后去培养基,PBS清洗后在培养板中滴入500 μL的RA2液混匀,吹打细胞移至内套管内。以12 000 r/min离心1 min,去外套管中液体,内套管内滴500 μL洗脱液;重复操作1次。弃外套管,将内套管移入新EP管内,在膜中央加入洗脱液30 μL,室温下静置后以12 000 r/min离心1 min,获取细胞总RNA。取100 mg组织剪碎研磨,加入1 mL的TRIzal震荡30 s,室温放置至组织裂解。以8 500 r/min离心5 min取上清液,加氯仿200 μL,震荡30 s,室温放置;再离心15 min取上清液,加等量异丙醇,室温静置10 min,再离心10 min,弃上清液,加500 μL体积分数0.75的乙醇,离心5 min;重复此操作。将沉淀存放室温晾干,加10~20 μL的DEPC液溶解RNA后,提取组织RNA。应用微量分光光度仪分别检测细胞和组织RNA浓度。使用RT Master Mix试剂盒,反转录cDNA保存于-20 ℃冰箱中备用。qPCR反应采用两步法进行:①预变,195 ℃条件下持续30 s;②PCR,40、90 ℃条件下进行5 s反应或60 ℃条件下进行30 s反应。qPCR反应体系按照试剂盒说明配制,所用引物及其序列见表 2。
| 表 2 qPCR扩增引物及其序列 |
|
|
细胞、组织蛋白提取后备用。取电泳缓冲液粉,参照说明书溶解于1 L纯水内制成电泳缓冲液。200 A电泳90 min转膜后,取出膜用50 g/L脱脂牛奶室温闭封2 h。加入一抗(1∶2 000 GAPDH抗体,1∶1 000 ZNRF3抗体)4 ℃冰箱摇床上摇动孵育10 h。次日洗膜3次,加入辣根过氧化物酶(HRP)标记的二抗(1∶2 000),室温孵育2 h,再洗膜3次。取ECL试剂A、B底物液1∶1混匀,将冲洗后的膜置入避光反应后进行显影。使用Adobe Photoshop测量各条带灰度值,采用相对灰度值表示蛋白表达量。
1.3 统计学分析应用SPSS 20.0统计软件对数据进行分析。计量资料数据用x±s表示,组间均数比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 两侧滑膜组织HE染色评分比较观察组炎性细胞浸润、纤维组织增生、滑膜细胞增生和新生血管形成等评分均高于对照组,差异均有统计学意义(t=54.243~98.522,P < 0.05)。见表 3和图 1。
| 表 3 病人两侧HE染色评分比较(n=20,分,x±s) |
|
|
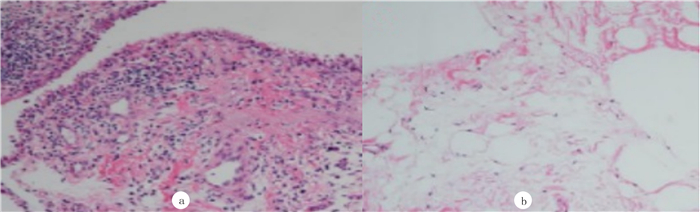 |
| a、b分别为RA患病侧和对照侧滑膜。HE染色,200倍。 图 1 RA病人两侧滑膜组织HE染色 |
本研究观察到FLS细胞核呈卵圆形,位于细胞中部,细胞形态呈梭形、星形和纺锤状,边界清晰,周围见聚集性分泌物,还混杂卵圆形巨噬样滑膜细胞(MLS)。细胞传至第3代,MLS分裂、增殖作用丧失,其后FLS、RA-FLS、C-FLS细胞形态相似。从原代FLS细胞图可见观察组(图 2a、b)生长速度较对照组(图 2c、d)增快。
 |
| a、b为RA病人患病侧FLS细胞,c、d为病人对照侧原代FLS细胞。免疫组化染色,400倍。 图 2 FLS细胞形态观察 |
本研究的细胞检测抗体为CD90、CD29,用于第3代RA-FLS、C-FLS细胞鉴定,若两者阳性率超过90%,则表示提取细胞为纯化FLS。本文检测结果表明,CD90、CD29两者阳性率为93.19%,提示提取细胞为纯化FLS。见图 3。
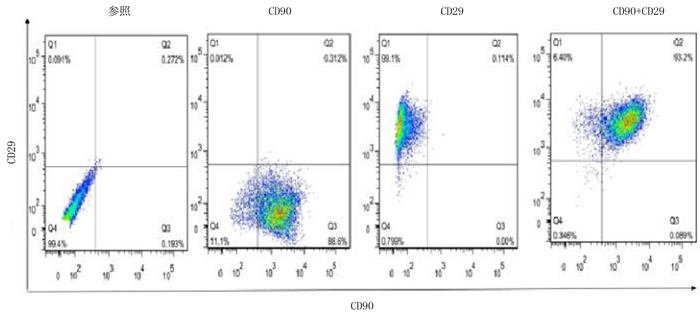 |
| 图 3 FLS流式细胞检测 |
ZNRF3在观察组的免疫组化评分、mRNA和蛋白表达均明显高于对照组,差异均有统计学意义(t=8.963~105.292,P < 0.05)。见表 4和图 4。
| 表 4 ZNRF3在病人两侧滑膜组织表达比较(n=20,x±s) |
|
|
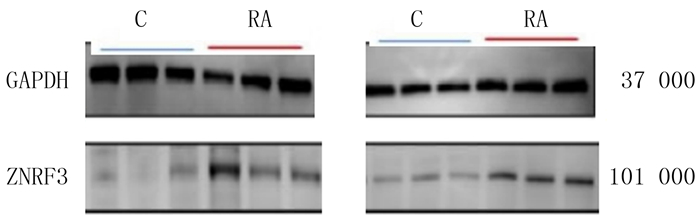 |
| 图 4 Western blot检测ZNRF3蛋白在病人两侧滑膜组织表达 |
免疫荧光法检测结果显示,ZNRF3(荧光绿)在RA-FLS和C-FLS的质膜、细胞质均有表达,但RA-FLS的荧光明显强于C-FLS。见图 5。qPCR和Western blot检测结果表明,ZNRF3在RA-FLS的mRNA和蛋白表达量均明显高于C-FLS,差异均有统计学意义(t=43.330、62.721,P < 0.05)。见表 5和图 6。
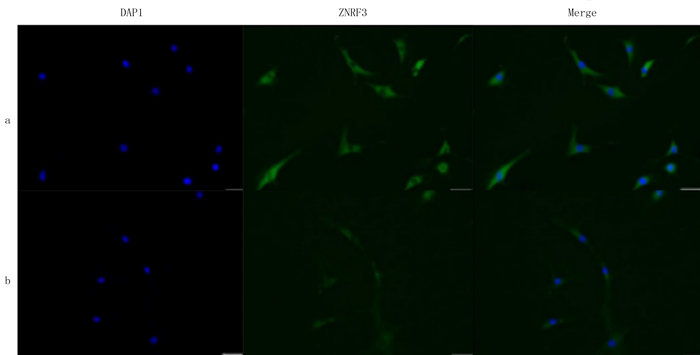 |
| a:RA-FLS;b:C-FLS。DAPI:4, 6-二脒基-2-苯基吲哚染色;Merge方法:重叠。免疫荧光染色,400倍。 图 5 滑膜FLS的免疫荧光检测 |
| 表 5 ZNRF3在病人两侧滑膜FLS细胞中的表达(n=20,x±s) |
|
|
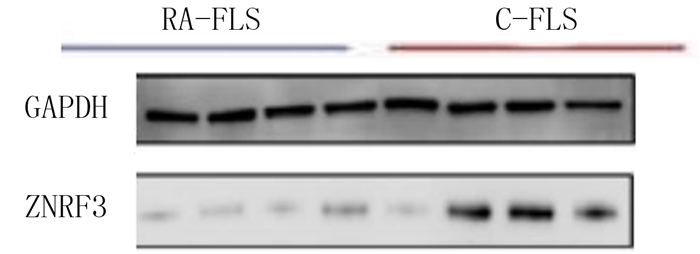 |
| 图 6 Western blot检测ZNRF3蛋白在RA-FLS和C-FLS表达 |
ZNRF3是一种调控蛋白,其细胞外结构与R脊柱蛋白相互作用,与富含亮氨酸的G蛋白偶联受体生成复合物,致使ZNRF3自动膜清除、泛素化,使胞膜表面卷曲受体蛋白稳定,维持Wnt信号活性通路;细胞表面ZNRF3结合巢乱蛋白某区,识别Wnt巢乱蛋白,诱导该蛋白泛素化降解,从而抑制Wnt信号通路[14-16]。有学者认为,ZNRF3对Wnt/β-catenin、Wnt/PCP信号通路呈负性调控性[17]。目前关于ZNRF的研究以肿瘤为主。已有学者指出,在肿瘤疾病中R-spondin-ZNRF3板块常发生突变[18]。有研究表明,ZNRF3对Wnt/β-catenin信号通路的调控属负性,其在肿瘤组织中表达不尽相同[19]。有学者对乳头状甲状腺癌组织与正常甲状腺组织的研究结果显示,ZNRF3在乳头状甲状腺癌组织内呈下调,且与其分化等级呈负相关[20-21]。而ZNRF3在原发性结直肠癌表达上调[22]。ZNRF3在骨关节的研究有待明确,但考虑RA病变与Wnt信号通路存在联系,推测ZNRF3可能与RA病变的发生发展有关。
本研究对膝关节RA病人的RA侧与C侧滑膜组织、细胞采用免疫组化、qRCR和Westen blot法研究显示,病人RA侧滑膜组织中ZNRF3表达高于C侧。相关研究已表明,RA侧Wnt信号通路与其组织发病有关;在RA侧组织、FLS中,β-catenin表达上调,表示Wnt通路过度激活,并抑制RA侧的成骨细胞[23-25]。由此推测,ZNRF3在RA侧滑膜组织中表达增高与Wnt信号通路在滑膜炎症中过度激活相关,ZNRF3在RA发病中可抑制被过度激活的Wnt通路,而且呈负增长表达[26-27]。进一步分析ZNRF3在RA发病中的作用,采用酶消法从滑膜组织中分离原代FLS细胞,使用Ⅱ型胶原酶将组织离散成单个细胞,并用含FBS培养基培养数天,使细胞贴壁达80%~90%[28-30]。本文光镜下观察显示,经HE染色的RA侧滑膜组织明显增生,细胞[LL]层数增加,并见大量炎性细胞浸润滑膜间质中,且伴大量新生血管生成,部分组织中见淋巴滤泡形成、间质纤维化。本文应用流式细胞检测术、免疫荧光检测对第3代细胞进行鉴定,并观察ZNRF3在FLS中的表达,结果显示,RA-FLS和C-FLS中ZNRF3均定位于细胞质和质膜,RA-FLS中ZNRF3表达明显增高,而C-FLS中无明显表达,qRCR与Westen blot检测结果也相同。上述结果均提示,激活Wnt信号通路后可诱导ZNRF3生成并在细胞核外分泌,从而调控Wnt信号通路活性。
总而言之,RA病人病变侧滑膜组织、FLS中的ZNRF3表达量升高,推测与Wnt信号通路过度激活诱导ZNRF3生成增加有关,而ZNRF3高表达可负反馈调节Wnt通路活性。
| [1] |
李凌汉, 麦培根, 陈宝红. 雷公藤多甙联合免疫抑制剂治疗类风湿关节炎疗效及对炎性因子的影响[J]. 现代中西医结合杂志, 2017, 26(10): 1088-1090. DOI:10.3969/j.issn.1008-8849.2017.10.022 |
| [2] |
邵克忠, 陈利民, 李素蘋, 等. 超声造影在类风湿关节炎腕关节炎活动期病变中的诊断价值[J]. 中华全科医学, 2018, 16(6): 980-982, 1035. |
| [3] |
蔡辉, 张群燕, 郭郡浩, 等. 类风湿关节炎患者外周血血浆中TNF-α、IL-1β及IL-10的表达及临床意义[J]. 中华中医药学刊, 2017, 35(3): 519-521. |
| [4] |
刘洋, 曹玲, 张朝霞. 流式细胞CD64检测在鉴别类风湿关节炎合并感染中的意义[J]. 检验医学与临床, 2018, 15(19): 2872-2875. DOI:10.3969/j.issn.1672-9455.2018.19.009 |
| [5] |
PARK S, CUI J, YU W S, et al. Differential activities and mechanisms of the four R-spondins in potentiating Wnt/β-catenin signaling[J]. J Biol Chem, 2018, 293(25): 9759-9769. DOI:10.1074/jbc.RA118.002743 |
| [6] |
赵紫琴, 徐瑾, 王瑞琳, 等. 类风湿性关节炎滑膜组织中NLRP3炎性小体及下游因子IL-1β/IL-18的表达及意义[J]. 临床与实验病理学杂志, 2019, 35(5): 534-538. |
| [7] |
李春龙, 周洁, 曹炬, 等. IL-27诱导人成纤维样滑膜细胞产生IL-6的免疫机制[J]. 重庆医科大学学报, 2018, 43(6): 824-828. |
| [8] |
梁菁菁, 肖涟波, 陈勇, 等. 环指蛋白43对类风湿关节炎滑膜成纤维细胞基质金属蛋白酶的影响[J]. 中华风湿病学杂志, 2019, 23(4): 217-219. DOI:10.3760/cma.j.issn.1007-7480.2019.04.001 |
| [9] |
朱林波, 李鹏飞, 张鹏斌, 等. 环指蛋白43基因在肿瘤中的表达[J]. 中华全科医学, 2020, 18(2): 136-138. |
| [10] |
中华医学会风湿病学分会. 2018中国类风湿关节炎诊疗指南[J]. 中华内科杂志, 2018, 57(4): 242-251. DOI:10.3760/cma.j.issn.0578-1426.2018.04.004 |
| [11] |
王曦晖, 薛成, 周谅仙, 等. Netrin-1在类风湿关节炎滑膜组织中的表达及作用研究[J]. 中国骨与关节杂志, 2020, 9(2): 114-118. DOI:10.3969/j.issn.2095-252X.2020.02.007 |
| [12] |
马雅茹, 阿艳妮, 张丽芳, 等. 联合应用P16、Ki-67免疫组化染色对CIN分级诊断的影响及其与宫颈HPV感染的相关性分析[J]. 中国性科学, 2018, 27(10): 94-98. DOI:10.3969/j.issn.1672-1993.2018.10.028 |
| [13] |
黄宪章, 王前, 郑磊, 等. 人类风湿性关节炎成纤维样滑膜细胞培养及生物学特性研究[J]. 南方医科大学学报, 2009, 29(3): 462-465. DOI:10.3321/j.issn:1673-4254.2009.03.019 |
| [14] |
HAO H X, XIE Y, ZHANG Y, et al. ZNRF3 promotes Wnt receptor turnover in an R-spondin-sensitive manner[J]. Nature, 2012, 485(7397): 195-200. DOI:10.1038/nature11019 |
| [15] |
SZENKER-RAVI E, ALTUNOGLU U, LEUSHACKE M, et al. Author Correction: RSPO2 inhibition of RNF43 and ZNRF3 governs limb development independently of LGR4/5/6[J]. Nature, 2018, 561(7722): E7. DOI:10.1038/s41586-018-0296-7 |
| [16] |
HARRIS A, SIGGERS P, CORROCHANO S, et al. ZNRF3 functions in mammalian sex determination by inhibiting canonical WNT signaling[J]. Proc Natl Acad Sci U S A, 2018, 115(21): 5474-5479. DOI:10.1073/pnas.1801223115 |
| [17] |
CHANG L S, KIM M, GLINKA A, et al. The tumor suppressor PTPRK promotes ZNRF3 internalization and is required for Wnt inhibition in the Spemann organizer[J]. Elife, 2020, 9: e51248. DOI:10.7554/eLife.51248 |
| [18] |
BASHAM K J, RODRIGUEZ S, TURCU A F, et al. A ZNRF3-dependent Wnt/β-catenin signaling gradient is required for adrenal homeostasis[J]. Genes Dev, 2019, 33(3/4): 209-220. |
| [19] |
刘立, 盖金娜, 尹作文, 等. 趋化因子CXCL5调控NF-κB与Wnt/β-catenin信号通路抑制肿瘤免疫促进胃癌的机制研究[J]. 肿瘤防治研究, 2020, 47(5): 340-345. DOI:10.3971/j.issn.1000-8578.2020.19.1156 |
| [20] |
邱旺旺, 杨治力, 阎钧, 等. ZNRF3在甲状腺肿瘤组织中的表达以及在甲状腺癌细胞中的功能研究[J]. 国际肿瘤学杂志, 2016, 43(4): 246-249. DOI:10.3760/cma.j.issn.1673-422X.2016.04.002 |
| [21] |
LIANG J J, LI H R, CHEN Y, et al. ZNRF3 regulates collagen-induced arthritis through NF-κB and Wnt pathways[J]. Inflammation, 2020, 43(3): 1077-1087. DOI:10.1007/s10753-020-01193-1 |
| [22] |
李建华, 田勇, 李俊. LncRNA-POU3F3在甲状腺癌组织中的表达情况及对预后的预测价值[J]. 中华地方病学杂志, 2021, 40(7): 540-544. DOI:10.3760/cma.j.cn231583-20201028-00278 |
| [23] |
李正萍, 袁慧慧. Wnt信号通路及其在类风湿性关节炎中的作用进展[J]. 中国医药导报, 2019, 16(36): 29-32. |
| [24] |
BOND C E, MCKEONE D M, KALIMUTHO M, et al. RNF43 and ZNRF3 are commonly altered in serrated pathway colorectal tumorigenesis[J]. Oncotarget, 2016, 7(43): 70589-70600. DOI:10.18632/oncotarget.12130 |
| [25] |
王凡, 刘林, 高维强. 前列腺癌细胞中Wnt/β-catenin信号通路激活可增强细胞干性[J]. 肿瘤, 2019, 39(7): 525-533, 567. DOI:10.3969/j.issn.2095-252X.2019.07.010 |
| [26] |
BRONDANI V B, LACOMBE A M F, MARIANI B M P, et al. Low protein expression of both ATRX and ZNRF3 as novel negative prognostic markers of adult adrenocortical carcinoma[J]. Int J Mol Sci, 2021, 22(3): 1238. DOI:10.3390/ijms22031238 |
| [27] |
PACLÍKOVÁ P, RADASZKIEWICZ T W, POTẼIL D, et al. Roles of individual human Dishevelled paralogs in the Wnt signalling pathways[J]. Cell Signal, 2021, 85(6): 110058. |
| [28] |
SZENKER-RAVI E, ALTUNOGLU U, LEUSHACKE M, et al. RSPO2 inhibition of RNF43 and ZNRF3 governs limb development independently of LGR4/5/6[J]. Nature, 2018, 557(7706): 564-569. DOI:10.1038/s41586-018-0118-y |
| [29] |
COLOZZA G, KOO B K. Ub and Dub of RNF43/ZNRF3 in the WNT signalling pathway[J]. EMBO Rep, 2021, 22(5): e52970. |
| [30] |
WANG Z W, WANG Y L, MA X L, et al. RSPO2 silence inhibits tumorigenesis of nasopharyngeal carcinoma by ZNRF3/Hedgehog-Gli1 signal pathway[J]. Life Sci, 2021, 282(2): 119817. |
 2021, Vol. 57
2021, Vol. 57

