心肌纤维化是心血管疾病终末期共同的生理病理过程[1]。心肌成纤维细胞(CFs)异常增殖和胶原蛋白合成增多是心肌纤维化的重要表现,研究影响CFs增殖和胶原蛋白合成的分子机制,寻找有效的干预靶点对心血管疾病的治疗具有重要意义。还原型烟酰胺腺嘌呤双核苷酸磷酸(NADPH)氧化酶非吞噬细胞氧化酶4(NOX4)是NADPH NOX家族成员,在成纤维细胞、内皮细胞和平滑肌细胞等中广泛表达,与肺、肾、肝和心脏等多种组织纤维化过程密切相关[2-3]。本研究通过观察转染NOX4小干扰RNA(siRNA)对血管紧张素Ⅱ(AngⅡ)诱导的CFs增殖和胶原蛋白的影响,揭示NOX4在心肌纤维化过程中的作用机制。
1 材料与方法 1.1 实验材料出生2 d雄性清洁级SD乳鼠(河南省实验动物中心)。AngⅡ(美国Sigma),胎牛血清和胰蛋白酶(美国Hyclone),青霉素-链霉素(青链霉)双抗和DMEM培养基(美国Gibico公司),转染试剂LipofectineTM2000(美国Invitrogen公司),RIPA裂解液和SDS-PAGE凝胶配制试剂盒(碧云天生物技术研究所),CCK-8试剂盒(日本同仁化学研究所),ECL化学发光剂和BCA蛋白浓度测定试剂盒(索莱宝生物公司),Collagen Ⅰ、Collagen Ⅲ抗体(武汉博士德生物公司),GAPDH、p38MAPK、p-p38MAPK和NOX4抗体(美国CST公司),HRP标记山羊抗鼠IgG(天津三箭生物公司)。CO2培养箱、酶标仪和凝胶成像分析系统(美国Bio-Rad公司)。
1.2 实验方法 1.2.1 CFs分离与培养无菌条件下取SD乳鼠的心肌组织并剪碎后,加入1.25 g/L胰蛋白酶消化,收集上清液,加入含体积分数0.01青链霉双抗和体积分数0.10胎牛血清的DMEM培养基,置于37 ℃含体积分数0.05 CO2培养箱中培养。根据CFs比心肌细胞贴壁速度快的特点采用差速贴壁法贴壁培养2 h。除去未贴壁的细胞,获得的贴壁的细胞多数为CFs,并采用波形蛋白免疫荧光法鉴定为CFs(纯度达98%)。培养达80%融合度时,胰蛋白酶消化并按1∶2传代,收集第3~5代对数生长期细胞进行实验。
1.2.2 实验分组与转染本实验分为如下4组。①对照组(A组):正常培养;②AngⅡ组(B组):加10-6mol/L AngⅡ刺激48 h;③AngⅡ+siNC组(C组):阴性对照NC-siRNA转染CFs后加10-6mol/L AngⅡ刺激48 h;④AngⅡ+siNOX4组(D组):采用NOX4干扰序列NOX4-siRNA转染CFs后,加入10-6mol/L AngⅡ刺激48 h。每组设3个重复。将对数生长期的CFs以每孔106个接种至6孔细胞板上,置于37 ℃、含有体积分数0.05 CO2培养箱,培养至达70%融合时进行瞬时转染。其中,NOX4-siRNA和NC-siRNA由上海吉玛公司合成。NOX4-siRNA和NC-siRNA的RNA序列见表 1。参照转染试剂LipofectineTM2000说明书,根据实验分组将NC-siRNA和NOX4-siRNA转染至CFs中。转染5 h后更换新鲜培养液,继续培养48 h。
| 表 1 NOX4-siRNA和NC-siRNA的RNA序列 |
|
|
采用免疫印迹法检测。收集AngⅡ刺激48 h的AngⅡ组、AngⅡ+siNC组、AngⅡ+siNOX4组和正常培养的对照组CFs,加入RIPA裂解液抽提各组细胞总蛋白后,参照BCA蛋白检测试剂盒说明书检测总蛋白的浓度。将热变性处理后的蛋白样品以每孔70 μg上样至SDS-PAGE凝胶中进行电泳分离,待分离结束后转膜。使用50 g/L脱脂奶粉封闭处理2 h后,NOX4抗体(1∶500)、GAPDH抗体(1∶1 000)4 ℃孵育过夜。次日,再以HRP标记山羊抗鼠IgG抗体(1∶2 000)室温孵育2 h。以ECL在暗室内显影后,将GAPDH作为内参照,采用凝胶成像系统扫描分析。实验重复3次。
1.2.4 细胞增殖活力检测采用CCK-8法检测。将AngⅡ处理结束后的CFs和正常培养的对照组CFs以每孔104个接种至96孔细胞板,在37 ℃、含体积分数0.05 CO2培养箱中常规培养48 h后,参照CCK-8试剂盒说明书检测各组细胞在450 nm波长处的光密度值。光密度值越大代表细胞增殖越活跃。实验重复3次。
1.2.5 Collagen Ⅰ、Collagen Ⅲ、p-p38MAPK和p38MAPK蛋白表达的检测采用免疫印迹法检测。详细步骤可参照1.2.3。其中,在脱脂奶粉封闭后,分别采用Collagen Ⅰ抗体(1∶1 000)、Collagen Ⅲ抗体(1∶1 000)、p-p38MAPK抗体(1∶800)和p38MAPK抗体(1∶800)孵育。
1.3 统计学方法采用SPSS 22.0软件进行统计学分析。计量资料数据以x±s形式表示,多组间比较使用单因素方差分析,组间多重比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 转染NOX4-siRNA对CFs中NOX4蛋白表达的影响免疫印迹法检测的结果表明,对照组、AngⅡ组、AngⅡ+siNC组和AngⅡ+siNOX4组细胞中NOX4蛋白的表达水平分别为0.35±0.03、0.57±0.04、0.62±0.05和0.12±0.02,各组间NOX4蛋白的表达水平之间存在明显差异(F=349.556,P<0.001)。见图 1。两两比较结果显示,与对照组相比,AngⅡ组细胞中NOX4蛋白表达水平明显升高(q=17.963,P < 0.05);与AngⅡ组比较,AngⅡ+siNC组NOX4蛋白表达无明显改变(P>0.05), 但AngⅡ+siNOX4组NOX4蛋白表达水平明显降低(q=36.742,P < 0.05)。
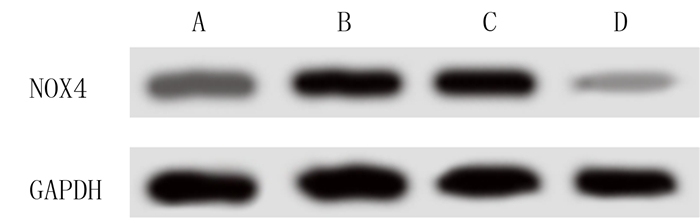 |
| A:对照组,B:AngⅡ组,C:AngⅡ+siNC组,D:AngⅡ+siNOX4组。 图 1 免疫印迹法检测NOX4蛋白的表达 |
CCK-8实验检测结果表明,对照组、AngⅡ组、AngⅡ+siNC组和AngⅡ+siNOX4组细胞增殖活力存在明显差异(F=140.134,P<0.001)。两两比较结果显示,与对照组相比,AngⅡ刺激明显促进了CFs增殖活力(q=25.587,P < 0.05);与AngⅡ组相比,NOX4-siRNA转染后CFs增殖活力明显降低(q=15.839,P < 0.05),而转染NC-siNRA对CFs增殖活力无明显影响(P>0.05)。见图 2。
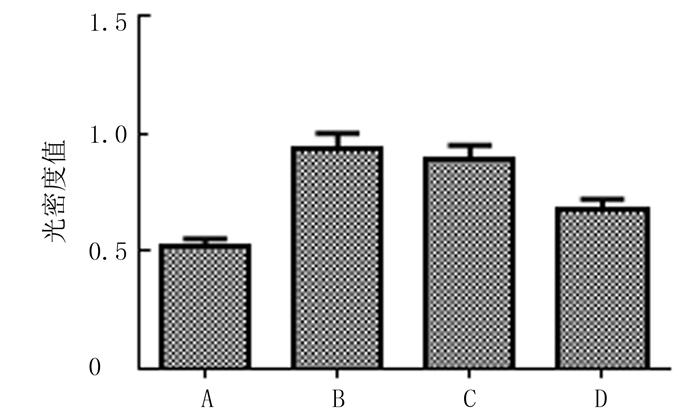 |
| A:对照组,B:AngⅡ组,C:AngⅡ+siNC组,D:AngⅡ+siNOX4组。 图 2 转染NOX4-siRNA对CFs增殖的影响 |
免疫印迹法检测各组细胞中胶原蛋白CollagenⅠ和Collagen Ⅲ的表达结果表明,与对照组相比,AngⅡ刺激可引起CollagenⅠ和Collagen Ⅲ蛋白的表达水平升高(F=142.742、404.800,P < 0.001)。与AngⅡ组相比,转染NC-siNRA后CFs中CollagenⅠ和Collagen Ⅲ蛋白的表达无明显变化(P>0.05),但转染NOX4-siRNA可使CFs中CollagenⅠ和Collagen Ⅲ蛋白的表达水平明显降低(q=17.242、27.727,P < 0.05)。见图 3和表 2。
 |
| A:对照组,B:AngⅡ组,C:AngⅡ+siNC组,D:AngⅡ+siNOX4组。 图 3 免疫印迹法检测CollagenⅠ和Collagen Ⅲ蛋白的表达 |
| 表 2 各组细胞中CollagenⅠ和Collagen Ⅲ蛋白表达的比较(n=3, x±s) |
|
|
免疫印迹法检测各组细胞中p38MAPK信号通路相关蛋白p-p38MAPK和p38MAPK的表达结果显示,各组细胞中p38MAPK蛋白的表达水平无明显差异,但AngⅡ刺激后CFs中p-p38MAPK蛋白的表达水平较对照组明显升高(F=182.909,P<0.001);转染NOX4-siRNA组p-p38MAPK蛋白的表达水平明显降低(q=18.434,P < 0.05),而转染NC-siRNA组p-p38MAPK蛋白的表达无明显变化(P>0.05)。见图 4和表 3。
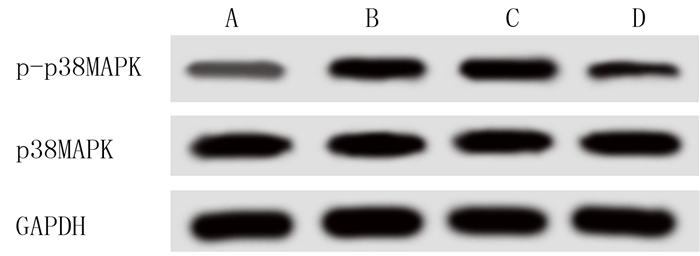 |
| A:对照组,B:AngⅡ组,C:AngⅡ+siNC组,D:AngⅡ+siNOX4组。 图 4 免疫印迹法检测p38MAPK信号通路相关蛋白的表达 |
| 表 3 各组细胞中p38MAPK信号通路相关蛋白表达的比较(n=3, x±s) |
|
|
AngⅡ是经典的肾素-血管紧张素系统的重要活性成分,可刺激CFs增生和胶原蛋白的分泌等,在心肌的纤维化过程中发挥着重要作用,常被用来作为体外研究心肌纤维化的诱导因子[4-5]。本研究参照文献的方法[6]选用浓度为10-6mol/L AngⅡ刺激体外培养的CFs构建心肌纤维化细胞模型。结果显示,AngⅡ刺激后CFs增殖活力和胶原蛋白CollagenⅠ、Collagen Ⅲ表达水平均明显升高。这表明本研究中10-6mol/L AngⅡ可诱导CFs增殖和胶原蛋白合成,心肌纤维化细胞模型构建成功。
NOX4是一种与肝组织发生纤维化密切相关的NADPH氧化酶,可以通过ROS信号通路在细胞的增殖、分化和凋亡等过程中发挥着重要作用;抑制NOX4信号通路可以减弱结核性胸膜纤维化[7-8]。NOX4在非小细胞肺癌细胞增殖过程中发挥着重要的促进作用,siRNA抑制NOX4表达可通过PI3K/Akt信号传导抑制人神经母细胞瘤SH-SY5Y细胞增殖[9]。此外,NOX4抑制剂可以逆转TGF-β1诱导的肺癌细胞胶原蛋白CollagenⅠ的表达;靶向干扰NOX4可抑制TGF-β1诱导CFs胶原合成[10-11]。本研究结果显示,AngⅡ可诱导CFs中NOX4蛋白表达上调。这提示NOX4在AngⅡ诱导的CFs纤维化过程中发挥着重要作用。转染NOX4-siRNA后AngⅡ诱导CFs增殖和胶原蛋白CollagenⅠ、Collagen Ⅲ的表达明显受到抑制。这提示,NOX4在AngⅡ诱导的CFs增殖和胶原合成过程中发挥着重要的促进作用。
p38MAPK信号通路是MAPK通路的重要分支,可通过磷酸化作用影响相关基因的表达,在细胞增殖、分化和发育等过程中发挥重要作用[12]。研究显示,在AngⅡ诱导的CFs增殖和胶原合成过程中p38MAPK信号通路发挥着重要的促进作用[13-14]。已有研究指出,沉默NOX4表达可抑制胰腺癌细胞中p38MAPK信号通路活化[15]。为了探讨NOX4调控CFs增殖和胶原合成的分子机制,本研究进一步检测结果表明,转染NOX4-siRNA后AngⅡ诱导p38MAPK磷酸化水平明显降低,p38MAPK信号通路的活化明显受到抑制。结果表明,在AngⅡ诱导的CFs中NOX4可调控p38MAPK信号通路。这提示NOX4介导的CFs增殖和胶原合成可能与p38MAPK信号通路的活化有关。
综上所述,NOX4-siRNA转染可抑制AngⅡ诱导的CFs增殖和胶原合成,其作用机制可能与抑制p38MAPK信号通路活化有关。该研究结果进一步阐述了心肌成纤维化发生发展的分子机制,也为以NOX4为靶点预防和改善心肌纤维化提供了新的参考依据。然而,本研究未涉及体内实验探究NOX4对心肌成纤维化的影响尚显不足,后续研究将通过动物模型对此进行补充和探究。
| [1] |
韩巍, 韩艳丛, 邱拥华, 等. 高血压合并左心室肥厚患者血清miRNA-29a-3p水平与心肌纤维化的相关性[J]. 河北医科大学学报, 2019, 40(7): 773-776, 793. |
| [2] |
TSUBOUCHI K, ARAYA J, MINAGAWA S, et al. Azithromycin attenuates myofibroblast differentiation and lung fibrosis development through proteasomal degradation of NOX4[J]. Autophagy, 2017, 13(8): 1420-1434. DOI:10.1080/15548627.2017.1328348 |
| [3] |
吴龙龙, 申凤俊. NOX4与肝纤维化关系的研究进展[J]. 国际消化病杂志, 2016, 36(6): 333-335, 359. |
| [4] |
杨丽红, 刘瑞涛, 魏庆民, 等. CXCR4 siRNA对AngⅡ诱导的H9c2心肌细胞凋亡的影响[J]. 郑州大学学报(医学版), 2019, 54(4): 583-586. |
| [5] |
李泽, 孟哲, 李宇娜, 等. 丹参酮ⅡA磺酸钠对血管紧张素Ⅱ诱导的大鼠心肌纤维化的影响[J]. 中国现代医学杂志, 2018, 28(12): 17-23. |
| [6] |
李文杰, 郭冰冰, 路明. siRNA抑制HMGB1表达对AngⅡ诱导的CFs增殖及胶原分泌的影响[J]. 徐州医学院学报, 2015(8): 517-520. |
| [7] |
薛腾, 赫欣, 任亚南, 等. NOX4在BEAS-2B细胞上皮间质转化过程中的作用[J]. 郑州大学学报(医学版), 2018, 53(3): 316-319. |
| [8] |
KIM Y, PARK S Y, JUNG H, et al. Inhibition of NADPH oxidase 4 (NOX4) signaling attenuates tuberculous pleural fibrosis[J]. J Clin Med, 2019, 8(1): E116. DOI:10.3390/jcm8010116 |
| [9] |
YU T, LI L, LIU W Y, et al. Silencing of NADPH oxidase 4 attenuates hypoxia resistance in neuroblastoma cells SH-SY5Y by inhibiting PI3K/Akt-dependent glycolysis[J]. Oncol Res, 2019, 27(5): 525-532. DOI:10.3727/096504018X15179668157803 |
| [10] |
董年, 余垭妮, 吴登敏, 等. NOX-4调控PI3K信号通路参与TGF-β1诱导肺癌细胞表达Ⅰ型胶原蛋白[J]. 中国病理生理杂志, 2018, 34(6): 58-63. |
| [11] |
CHAN E C, PESHAVARIYA H M, LIU G S, et al. Nox4 modulates collagen production stimulated by transforming growth factor β1 in vivo and in vitro[J]. Biochem Biophys Res Commun, 2013, 430(3): 918-925. DOI:10.1016/j.bbrc.2012.11.138 |
| [12] |
张频捷, 朱立新, 耿小平. p38 MAPK信号传导通路及其抑制剂的研究现状[J]. 安徽医药, 2010, 14(5): 596-598. |
| [13] |
辛博, 陈力, 万丽丽, 等. 野黄芩苷对血管紧张素Ⅱ诱导的新生大鼠心肌成纤维细胞的增殖及ERK1/2、p38 MAPK信号通路的影响[J]. 中国药房, 2018, 29(5): 629-633. |
| [14] |
CHEN Z, DING H S, GUO X, et al. MiR-33 promotes myocardial fibrosis by inhibiting MMP16 and stimulating p38 MAPK signaling[J]. Oncotarget, 2018, 9(31): 22047-22057. DOI:10.18632/oncotarget.25173 |
| [15] |
WITTE D, BARTSCHT T, KAUFMANN R, et al. TGF-β1-induced cell migration in pancreatic carcinoma cells is RAC1 and NOX4-dependent and requires RAC1 and NOX4-dependent activation of p38MAPK[J]. Oncology Reports, 2017, 38(6): 3693-3701. |
 2021, Vol. 57
2021, Vol. 57

