2. 青岛大学附属医院影像科;
3. 山东省数字医学与计算机辅助手术重点实验室
胃癌目前在全球癌症发病率中位居第5,死亡率位居第3,严重威胁人类健康[1]。东亚是胃癌高发病及高死亡地区,尤其是中国及日本[2]。中国胃癌病人占全球胃癌发病人数的42.6%,占相关死亡人数的45.0%[3-4]。尽管目前手术是治愈胃癌的唯一方法,但是新辅助化疗的应用可以明显提高胃癌的治愈率及病人的生存率[5]。中国临床肿瘤学会建议,新辅助化疗适用于T3期及以上胃癌病人,T2期及更早的胃癌建议行手术治疗[6]。因此,为了提高治愈率及降低新辅助化疗的不利影响,需要对T3/4期胃癌病人进行有效筛选[7]。CT由于具有非侵入性、实用性、便利性及稳定性等优点,是术前评估胃癌分期的常规检查方法[8]。但是,CT预测胃癌T分期的总体准确率为43%~82%,容易对胃癌T分期产生误判,造成不必要的姑息性手术及过度的放化疗治疗[9-12]。在这种情况下,需要一种替代技术对T3/4期胃癌病人进行有效的筛选。
人工智能处理数据具有运算速度快、精度高等优点[13-14]。近年来,在临床实践中卷积神经网络(CNN)越来越多地被用来识别和区分医学图像。该技术在影像图片诊断中已经显示出具有较高的诊断性能,例如在检测冠状动脉粥样硬化、乳癌、转移淋巴结[15-17]、皮肤病变的分类[18]及糖尿病视网膜病变筛查[19]等时,在各种深度学习模型中CNN是最成熟的算法。本研究主要基于CNN在图像处理及识别方面的强大能力,探索利用上腹部增强CT图像建立CNN对T3/4期胃癌的自动识别平台,并验证、评估其准确性。现将结果报告如下。
1 资料和方法 1.1 病人选择回顾性收集2018年6月—2019年12月在青岛大学附属医院行根治性胃癌手术的564例病人的上腹部增强CT图片。病人的纳入标准:术前行胃镜检查经病理诊断为胃癌;术前于我院行上腹部增强CT检查;于我院行根治性切除手术,术后病理确诊为T3/4期胃癌。排除标准:肿瘤直径较小无法勾画感兴趣区域(ROI);术前接受新辅助放化疗;胃腔充盈状态不理想或胃部蠕动导致成像不理想病人;手术后复发的病人。最终共208例病人被纳入研究,其中T3期病人90例,T4期病人118例。收集病人性别、年龄及肿瘤病理分期、部位等基本信息。本研究经青岛大学附属医院伦理委员会批准。
1.2 病人分组及CT检查方法以肿瘤分期及肿瘤部位为分类标准将病人按7∶1比例随机分入训练集(182例)和验证集(26例)。研究小组在训练集中共挑选出1 200张优质图像确定为阳性图像,同理在测试集中挑选出210张阳性图像。本研究所有病人均采用飞利浦Brilliance iCT扫描仪行上腹部增强CT扫描,扫描层厚为1 mm,层间隔为1 mm,间距为0.985。检查前所有病人均签署碘对比剂知情同意书,禁食4~6 h,检查前20 min给予病人500~1 000 mL饮用水。通过高压注射器以3 mL/s的流量将90 mL非离子造影剂碘海醇注入前肘静脉进行增强扫描。在动脉期延迟扫描33 s,在静脉期延迟扫描65 s,在平衡期延迟扫描120 s。扫描范围为横膈膜到脐部平面。
1.3 图像标识及数据增强处理利用labelImg软件对图像进行标识,由两名高年资放射科医师分别独立阅读CT图像并标记肿瘤病变,标识方法采用肿瘤分割方法。根据相关文献的研究结果,与邻近胃壁相比,局灶性胃壁增厚≥6 mm确定为异常增厚和癌变[20]。两名影像科医师结合病人胃镜报告及术后最终病理结果,仅标识影像图像中肿瘤浸润胃壁最深的位置。根据术后病理结果,由第三位影像科医师检查上腹部增强CT图像上肿瘤标识部位,以保证增强CT图像中病变部位的准确性及一致性。
利用CNN提取上腹部增强CT图像上不同大小的ROI,然后对1 200张阳性图片中的ROI使用裁剪、翻转等数据增强方法进行数据扩增,最后筛选出2 500张阳性图像作为训练数据集,以增强研究数据集,同时减轻模型处理数据集时产生的过度拟合问题[21]。
1.4 识别平台构建及验证 1.4.1 构建识别平台构建识别平台前对图像进行预处理,包括采用图像强度范围归一化和直方图均衡化方法来处理图像[22]。统一将训练图像缩放为512×557像素大小,然后对识别平台进行训练,识别平台在学习阳性图像同时,将训练集中正常胃部解剖图像默认为阴性图像一并学习。本研究采用的CNN是一个具有101层深度的CNN,可以对图像特征进行提取。每个层面的模型分别经过800个epoch的训练。优化器采用SGD优化器,初始学习率为0.000 2。对CNN学习成果分析采用Python编程语言,提取Metric模块里面的结果生成结论。
1.4.2 平台验证利用验证集中210张阳性图像和200张阴性图像对该平台识别性能进行验证。对比影像科医师对胃癌肿瘤区域标注结果,判定平台对验证集识别结果准确性。通过绘制受试者工作特征(ROC)曲线,计算ROC曲线下面积(AUC),评估诊断平台识别T3/4期胃癌图像的准确性,并统计识别的准确度、灵敏度、特异度、阳性预测值及阴性预测值等指标。
1.5 统计学分析应用SPSS 20.0软件对数据进行统计学处理。统计所有结点处的真阳性和假阳性的数目,计算得到不同概率阈值下真阳性率和假阳性率,从而绘制出ROC曲线,通过计算AUC,得出平台识别T3/4期胃癌的准确率。
2 结果 2.1 平台的学习效果为评估平台的学习效果,研究小组将验证集输入经过训练的识别平台中进行验证。由诊断平台学习结果的损失函数(loss)学习曲线可知,诊断平台在进行800个epoch学习后达到最佳优化参数。用于识别T3/4期胃癌诊断平台的AUC为0.924,准确度、灵敏度、特异度分别为0.927、0.924、0.930,阳性预测值为0.933,阴性预测值为0.921。见图 1。
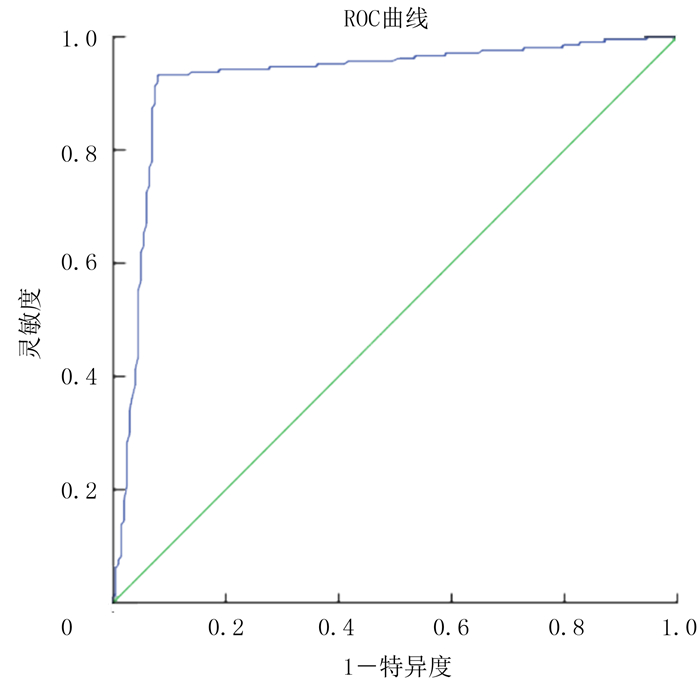 |
| 图 1 T3/4期胃癌自动识别平台的ROC曲线 |
如图 2所示,A、C图片是影像科医师基于病理结果手动标识的肿瘤位置,B、D图片是识别平台对图片中肿瘤的分割及识别。可以得出结论,基于上腹部增强CT图像,该识别平台识别T3/4期胃癌具有很高的准确性。
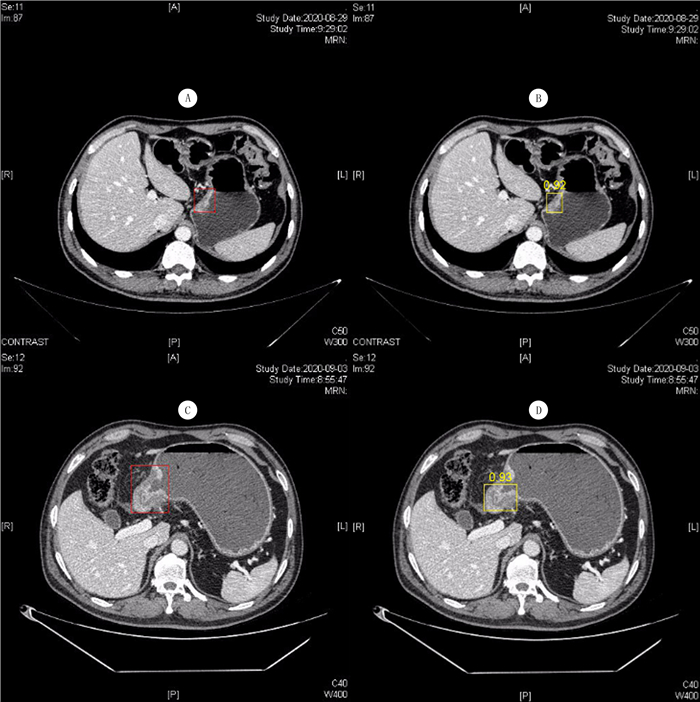 |
| A、B为T3期肿瘤,C、D为T4期肿瘤,A、C为影像科高年资医师根据病理结果标注,B、D为平台识别后分割并标注。 图 2 自动识别平台对T3/4期胃癌图像的识别 |
准确的术前T分期对胃癌病人围手术期选择治疗方案以及评估预后均至关重要[23]。有研究证实,胃癌病理T3/4期是术后切缘阳性的独立危险因素,术后切缘阳性病人总体预后较差[24]。中国临床肿瘤学会建议治疗胃癌之前需要准确地区分胃癌T分期以制定精准的治疗计划。第8版美国国立综合癌症网络指南(NCCN指南)提出上腹部增强CT是诊断胃癌T分期的主要影像学方法。影像科医师主要通过术前腹部CT等影像资料评估胃癌病人T分期,继而指导临床医师选择治疗方案。然而,目前实际临床工作中术前通过腹部CT判断T分期还存在一些问题:①不同影像科医师通过上腹部增强CT评估胃癌病人T分期存在主观差异;②在目前国内各三级甲等医院病人数量庞大的背景下,面对通过CT等影像资料进行胃癌临床分期的复杂性,影像科医生承受着巨大的工作量。因此,迫切需要一种新的方法来提高临床诊断效率。而深度学习网络技术的发展,为解决这一问题创造了可能。有研究报道,CNN-CAD系统已经应用于乳房组织病理学图像的分类检测[25]和结肠直肠癌的检测[26]。本研究基于CNN建立了识别T3/4期胃癌的诊断平台,实现了术前利用上腹部增强CT对胃癌进行快速精确筛选。
本研究小组在前期已经开发出基于深度学习网络的直肠癌转移淋巴结的MRI图像自动识别系统[27]。在前期经验的基础上,本研究建立了基于CNN的T3/4期胃癌自动识别平台,并评估了其临床价值。上腹部增强CT为胃癌病人的常规辅助检查手段,有研究证实,上腹部增强CT静脉期图像对胃癌肿瘤浸润的诊断性能优于动脉期图像,所以本研究选用上腹部增强CT静脉期图像[28]。最新版胃癌NCCN指南指出,上腹部CT对胃癌T分期的识别准确率为43%~82%[23]。兰州大学第二医院的一项回顾性研究将胃癌术后病理结果与影像科高年资医师读片报告对比,结果显示,增强CT评估T3、T4期胃癌的准确度分别为76.7%和92.7%[29]。本研究中通过放射科高年资医生结合病理结果对增强CT图片的标识,对T3/4期胃癌识别平台进行深度训练,经验证识别平台对于T3/4期胃癌病人增强CT静脉期图像具有较高的识别准确度,其AUC为0.924。表明识别平台的准确性接近于影像科高年资医师的诊断水平。考虑其原因可能为:①T4期胃癌肿瘤较大、浸透浆膜层,在CT图片中易于辨认;②T3期胃癌侵犯至胃壁的固有肌层,而固有肌层在增强CT中构成了低密度条纹层的外层[30],在病理切片中占据了胃壁的大部分,这降低了识别T分期的难度;③T3/4期胃癌图片较多,诊断平台参数优化较完善。基于诊断平台对病人全静脉期连续图像的T分期最终判定结果与术后病理T分期诊断结果完全相符。上述结果表明,该诊断平台具有较高的可行性、准确性、客观性和高效性,可以辅助放射科医生完成胃癌的筛选工作,减少放射科医生的工作量;可以辅助临床医生制定诊疗方案,从而有利于胃癌病人接受更加精准和高效的治疗。
本研究的局限性:①本研究为单中心试验研究,数据量有限;②本研究是基于CNN的监督学习,平台的训练准确性依赖于放射科医师对增强CT图片肿瘤区域的精确标识。因此,为了进一步提升人工智能辅助平台的可靠性,今后研究将联合多中心增加数据量,并优化算法和提升标识效率,最终实现临床验证,以达到辅助医师诊断与治疗的目的。
综上所述,本研究建立的T3/4期胃癌自动识别平台能够利用上腹部增强CT图像自动分割识别T3/4期胃癌,显示出了与经验丰富的影像科医师相当的准确性,有望协助影像科医师做出更为精准、直观及高效的诊断,极大减轻影像科医师的工作负担;有望指导临床医师制定诊疗方案,利于病人接受更加精准及个性化的治疗。
| [1] |
Global Burden Of Disease Cancer Collaboration, FITZMAURICE C, ALLEN C, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: a systematic analysis for the global burden of disease study[J]. JAMA Oncology, 2017, 3(4): 524-548. DOI:10.1001/jamaoncol.2016.5688 |
| [2] |
RAHMAN R, ASOMBANG A W, IBDAH J A. Characteristics of gastric cancer in Asia[J]. World Journal of Gastroenterology, 2014, 20(16): 4483-4490. DOI:10.3748/wjg.v20.i16.4483 |
| [3] |
FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [4] |
WANG Z, XING J, CAI J, et al. Short-term surgical outcomes of laparoscopy-assisted versus open D2 distal gastrectomy for locally advanced gastric cancer in north China: a multicenter randomized controlled trial[J]. Surg Endosc, 2019, 33(1): 33-45. DOI:10.1007/s00464-018-6391-x |
| [5] |
BIONDI A, LIROSI M C, D'UGO D, et al. Neo-adjuvant chemo (radio) therapy in gastric cancer: Current status and future perspectives[J]. World J Gastrointest Oncol, 2015, 7(12): 389-400. DOI:10.4251/wjgo.v7.i12.389 |
| [6] |
WANG F H, SHEN L, LI J, et al. The Chinese Society of Clinical Oncology (CSCO): clinical guidelines for the diagnosis and treatment of gastric cancer[J]. Cancer Communications (London, England), 2019, 39(1): 10. |
| [7] |
FUKAGAWA T, KATAI H, MIZUSAWA J, et al. A prospective multi-institutional validity study to evaluate the accuracy of clinical diagnosis of pathological stage Ⅲ gastric cancer (JCOG1302A)[J]. Gastric Cancer, 2018, 21(1): 68-73. DOI:10.1007/s10120-017-0701-1 |
| [8] |
LIU S, SHI H, JI C, et al. Preoperative CT texture analysis of gastric cancer: correlations with postoperative TNM staging[J]. Clinical Radiology, 2018, 73(8): 756.e1-756.e9. DOI:10.1016/j.crad.2018.03.005 |
| [9] |
TAN C Q, PENG L B, ZENG X H, et al. Cost-utility analysis of the newly recommended adjuvant chemotherapy for resectable gastric cancer patients in the 2011 Chinese National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology: Gastric Cancer[J]. PharmacoEconomics, 2014, 32(3): 235-243. DOI:10.1007/s40273-013-0065-2 |
| [10] |
YAN C, ZHU Z G, YAN M, et al. Value of multidetector-row computed tomography in the preoperative T and N staging of gastric carcinoma: a large-scale Chinese study[J]. Journal of Surgical Oncology, 2009, 100(3): 205-214. DOI:10.1002/jso.21316 |
| [11] |
SAITO T, KUROKAWA Y, TAKIGUCHI S, et al. Accuracy of multidetector-row CT in diagnosing lymph node metastasis in patients with gastric cancer[J]. European Radiology, 2015, 25(2): 368-374. DOI:10.1007/s00330-014-3373-9 |
| [12] |
JOO I, LEE J M, KIM J H, et al. Prospective comparison of 3 T MRI with diffusion-weighted imaging and MDCT for the preoperative TNM staging of gastric cancer[J]. Journal of Magnetic Resonance Imaging: JMRI, 2015, 41(3): 814-821. DOI:10.1002/jmri.24586 |
| [13] |
KUMAR V, GU Y, BASU S, et al. Radiomics: the process and the challenges[J]. Magn Reson Imaging, 2012, 30(9): 1234-1248. DOI:10.1016/j.mri.2012.06.010 |
| [14] |
LAMBIN P, RIOS-VELAZQUEZ E, LEIJENAAR R, et al. Radiomics: extracting more information from medical images using advanced feature analysis[J]. European Journal of Cancer, 2012, 48(4): 441-446. DOI:10.1016/j.ejca.2011.11.036 |
| [15] |
TATSUGAMI F, HIGAKI T, NAKAMURA Y, et al. Deep learning-based image restoration algorithm for coronary CT angiography[J]. Eur Radiol, 2019, 29(10): 5322-5329. DOI:10.1007/s00330-019-06183-y |
| [16] |
GERAS K J, MANN R M, MOY L. Artificial intelligence for mammography and digital breast tomosynthesis: current concepts and future perspectives[J]. Radiology, 2019, 293(2): 246-259. DOI:10.1148/radiol.2019182627 |
| [17] |
EHTESHAMI B B, MITKO V, JOHANNES V D P, et al. Diagnostic assessment of deep learning algorithms for detection of lymph node metastases in women with breast cancer[J]. JAMA, 2017, 318(22): 2199-2210. DOI:10.1001/jama.2017.14585 |
| [18] |
ESTEVA A, KUPREL B, NOVOA R A, et al. Corrigendum: dermatologist-level classification of skin cancer with deep neural networks[J]. Nature, 2017, 546(7660): 686. |
| [19] |
VARUN G, LILY P, MARC C, et al. Development and validation of a deep learning algorithm for detection of diabetic retinopathy in retinal fundus photographs[J]. JAMA, 2016, 316(22): 2402-2410. DOI:10.1001/jama.2016.17216 |
| [20] |
KIM H J, KIM A Y, OH S T, et al. Gastric cancer staging at multi-detector row CT gastrography: comparison of transverse and volumetric CT scanning[J]. Radiology, 2005, 236(3): 879-885. DOI:10.1148/radiol.2363041101 |
| [21] |
ZHONG Z, ZHENG L, KANG G L, et al. Random erasing data augmentation[J]. Proceedings of the AAAI Conference on Artificial Intelligence, 2020, 34(7): 13001-13008. DOI:10.1609/aaai.v34i07.7000 |
| [22] |
DROZDZAL M, CHARTRAND G, VORONTSOV E, et al. Learning normalized inputs for iterative estimation in medical image segmentation[J]. Comput Vis Pattern Recognit, 2017, 44: 1-10. |
| [23] |
AJANI J A, D'AMICO T A, ALMHANNA K, et al. Gastric cancer, version 3.2016, NCCN clinical practice guidelines in oncology[J]. Journal of the National Comprehensive Cancer Network: JNCCN, 2016, 14(10): 1286-1312. DOI:10.6004/jnccn.2016.0137 |
| [24] |
SCHUHMACHER C, GRETSCHEL S, LORDICK F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954[J]. J Clin Oncol, 2010, 28(35): 5210-5218. DOI:10.1200/JCO.2009.26.6114 |
| [25] |
GANDOMKAR Z, BRENNAN P C, MELLO-THOMS C. MuDeRN: multi-category classification of breast histopathological image using deep residual networks[J]. Artificial Intelligence in Medicine, 2018, 88: 14-24. DOI:10.1016/j.artmed.2018.04.005 |
| [26] |
HORNBROOK M C, GOSHEN R, CHOMAN E, et al. Early colorectal cancer detected by machine learning model using gender, age, and complete blood count data[J]. Dig Dis Sci, 2017, 62(10): 2719-2727. DOI:10.1007/s10620-017-4722-8 |
| [27] |
LU Y, YU Q, GAO Y, et al. Identification of metastatic lymph nodes in MR imaging with faster region-based convolutional neural networks[J]. Cancer Res, 2018, 78(17): 5135-5143. |
| [28] |
CHEN X H, REN K, LIANG P, et al. Spectral computed tomography in advanced gastric cancer: can iodine concentration non-invasively assess angiogenesis?[J]. World Journal of Gastroenterology, 2017, 23(9): 1666-1675. DOI:10.3748/wjg.v23.i9.1666 |
| [29] |
武赞凯, 王宇, 张耕源, 等. 增强CT对进展期胃癌术前的评估价值[J]. 中华普通外科学文献(电子版), 2016, 10(2): 133-137. |
| [30] |
KIM J W, SHIN S S, HEO S H, et al. Diagnostic performance of 64-section CT using CT gastrography in preoperative T staging of gastric cancer according to 7th edition of AJCC cancer staging manual[J]. Eur Radiol, 2012, 22(3): 654-662. DOI:10.1007/s00330-011-2283-3 |
 2021, Vol. 57
2021, Vol. 57

