2. 青岛大学附属医院风湿免疫科, 山东 青岛 266003
慢性肾脏病(CKD)的患病率为6%~8%[1]。而肾纤维化是CKD终末期的共同病理特征,包括肾小球硬化和肾小管间质纤维化,且肾小管间质纤维化与CKD的预后密切相关,其过程不可逆,目前尚无有效药物逆转终末期肾病的进展[2]。转化生长因子-β(TGF-β)是目前发现的最强的促肾纤维化因子,其与受体结合触发Smad转录因子磷酸化,实现信号转导作用[3]。据报道,抑制TGF-β1/Smad3信号通路可减缓肾纤维化过程[3-4]。MicroRNAs是一类内源性的非编码RNA,通过碱基互补配对识别靶mRNA调控基因表达[5-6]。在所有microRNAs中,microRNA-21不仅能促进肿瘤的生长,还参与肾脏疾病的进展[6-7]。既往研究结果已证实,microRNA-21的过表达可显著促进体外培养的人肾小管上皮细胞系HK-2的凋亡与细胞外基质沉积,下调E-钙黏蛋白水平,促进肾间质纤维化[8]。在单侧输尿管结扎的肾纤维化模型鼠中,由受损的近端小管上皮细胞表达的microRNA-21可以通过激活PTEN/AKT通路参与肾纤维化进展[9]。1, 25-(OH)2D3是维生素D3的主要活性形式,其经典作用是参与调节体内钙磷代谢,但其他的药理作用近年来也逐渐受到关注[10]。1, 25-(OH)2D3在一定程度上可减少促炎细胞因子,下调某些microRNAs的表达,抑制CKD炎症状态[11-12]。有研究表明,1, 25-(OH)2D3可以通过抑制TGF-β/Smad3通路,发挥抗纤维化的作用[13]。在由猪血清诱导的大鼠肝纤维化模型中,microRNA-21可激活ERK与TGF-β/smad3通路促进肝纤维化的进展[14],由此推测microRNA-21与1, 25-(OH)2D3在体内存在共同的调控纤维化的通路。但1, 25-(OH)2D3对microRNA-21在肾纤维化中表达是否可以产生调控作用尚未见研究报道。因此,本研究通过建立肾纤维化模型,进一步探讨1, 25-(OH)2D3对实验性SD大鼠肾纤维化组织中microRNA-21表达的影响,同时检测大鼠肾功能、肾脏损伤和纤维化情况,以期为1, 25-(OH)2D3用于肾纤维化治疗提供更多的理论及实验依据。
1 材料与方法 1.1 动物与试剂清洁级健康雄性SD大鼠36只,体质量(200±20)g,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2016-0002,饲养于青岛大学医学部(松山校区)动物房。1, 25-(OH)2D3(商品名罗盖全,上海罗氏制药有限公司),Trizol试剂(美国Invitrogen),cDNA反转录试剂盒和RT-PCR反应试剂盒(日本Takara),引物由青岛擎科梓熙生物技术有限公司合成。
1.2 实验方法 1.2.1 动物分组及处理将36只SD大鼠随机分为假手术组(Sham组)、单侧(左)输尿管结扎组(UUO组)、1, 25-(OH)2D3干预组(干预组),每组12只。参考文献的方法造模[15]。以30 g/L戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,于腹正中切口翻开肠襻,找到左肾下极,在其内侧找到输尿管,游离输尿管旁组织; UUO组、干预组于左侧肾脏近肾门处结扎输尿管,Sham组仅游离左侧输尿管而不结扎; 最后还纳肠襻,缝合腹部切口。手术严格遵守无菌操作原则。干预组术后当天开始给予1, 25-(OH)2D3(溶于2 mL花生油)0.06 μg/(kg·d)每日1次灌胃,Sham组和UUO组给予等体积的花生油灌胃。1, 25-(OH)2D3的剂量选择参考金瑞日等[16]的研究。
1.2.2 标本采集分别于术后14、28 d,各组随机抽取6只大鼠,腹主动脉取血,在4 ℃下以12 000 r/ min离心5 min分离血清,保存于-80 ℃冰箱中; 取各组大鼠肾脏相同部位组织置于40 g/L多聚甲醛中固定,石蜡包埋制作病理切片; 其余部分肾组织用液氮快速冷冻,置于-80 ℃冰箱中保存,以备提取microRNA-21。
1.2.3 血清指标的检测应用HITACHI 7600系列全自动生化分析仪分别检测血肌酐(Scr)、尿素氮(BUN)、钙(Ca)、磷(P)等水平。
1.2.4 肾脏病理学检查肾脏组织经40 g/L多聚甲醛固定、石蜡包埋,切成3 μm厚的切片后,行苏木精-伊红(HE)及Masson染色,中性树胶封片,在光学显微镜下观察各组肾组织结构并拍照。
1.2.5 RT-PCR检测肾组织microRNA-21的表达取各组大鼠肾组织,置冰上研磨,用Trizol提取总RNA,反转录成cDNA后,以U6为内参照,检测microRNA-21的相对表达量。反应体系共20 μL:SYBR Premix Ex TaqⅡ10.0 μL,上、下引物各0.8 μL,cDNA 2.0 μL,无酶水6.4 μL。反应条件:95 ℃、30 s,95 ℃、15 s,60 ℃、30 s,72 ℃、30 s,共39个循环。用2-△△Ct计算各组microRNA-21的表达水平。引物序列见表 1。
| 表 1 RT-PCR引物序列 |
|
|
采用GraphPad Prism 5软件进行统计学分析,所得计量数据以x±s表示,均数间比较采用双因素方差分析,继以Bonferroni法进行多重比较,相关性检验采用Spearman相关性分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组大鼠肾脏外观Sham组大鼠两侧肾脏红润,大小正常。UUO组和干预组大鼠梗阻侧肾脏明显水肿,纵向剖开后,可见肾内积水,积液清亮,且随梗阻时间延长肾脏体积增大。
2.2 血清指标的比较 2.2.1 Scr时间主效应显著(F=20.339,P<0.05),组别主效应显著(F=60.566,P<0.05),组别与时间无交互效应(F=2.023,P>0.05)。干预组、UUO组大鼠各时间点的Scr水平均高于Sham组,干预组低于UUO组,差异具有统计学意义(t=3.242~8.695,P<0.05)。组内比较,Sham组术后14 d与28 d比较差异无显著性,干预组和UUO组术后28 d Scr水平高于术后14 d,差异具有统计学意义(t=3.667、3.156,P<0.05)。见表 2。
| 表 2 各组大鼠肾脏相关血清指标的比较(n=6,x±s) |
|
|
时间主效应显著(F=8.585,P<0.05),组别主效应显著(F=280.706,P<0.05),组别与时间交互效应显著(F=5.822,P<0.05)。干预组、UUO组大鼠各时间点BUN水平均高于Sham组,干预组低于UUO组,差异有统计学意义(t=6.188~17.980,P<0.05)。组内比较,Sham组和UUO组术后14 d与28 d比较差异无统计学意义,干预组术后28 d高于术后14 d,差异具有统计学意义(t=4.087,P<0.05)。见表 2。
2.2.3 Ca和P各组大鼠各时间点Ca、P水平比较差异均无显著性(P>0.05)。见表 2。
2.3 病理学改变 2.3.1 HE染色Sham组大鼠肾组织未见明显病理改变。术后14 d,UUO组可见肾小管上皮细胞弥漫性肿胀、变性、萎缩,管腔扩张,肾小管结构紊乱、变形,多数肾小管基底膜丧失; 肾间质增宽,间质内炎症细胞浸润; 肾小球病理改变不明显。术后28 d,肾间质明显增宽,大量炎症细胞浸润,纤维化程度加深。相对于UUO组,干预组同一时间点肾间质病变程度较轻,肾小管基底膜多呈不规则改变,部分视野肾间质、肾小管损伤不明显,肾间质纤维化相对面积明显减少。各组均未见钙化点、钙化灶。
2.3.2 Masson染色Sham组大鼠肾间质未见明显阳性染色。随梗阻时间延长,UUO组大鼠肾间质中胶原纤维阳性染色面积增大,术后14 d可见多数肾小管管腔扩张,肾间质增宽,纤维组织增生,炎症细胞浸润; 术后28 d上述情况加剧。与UUO组相比,干预组在相同时间点的胶原沉积程度和肾小管管腔扩张程度显著减轻。见图 1。
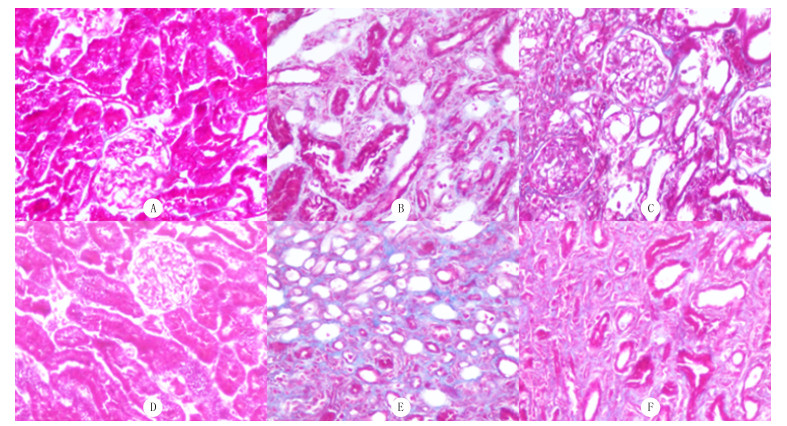 |
| A、D为Sham组14 d和28 d; B、E为UUO组14 d和28 d; C、F为干预组14 d和28 d。Masson染色,200倍。 图 1 各组大鼠肾间质损伤及纤维化表现 |
时间主效应显著(F=25.170,P<0.05),组别主效应显著(F=34.051,P<0.05),组别与时间交互效应显著(F=7.088,P<0.05)。干预组、UUO组大鼠各时间点microRNA-21表达均高于Sham组,干预组较UUO组降低,差异具有统计学意义(t=3.093~8.330,P<0.05)。组内比较,Sham组和干预组术后14 d与28 d比较差异无显著意义,UUO组术后14 d的microRNA-21表达水平低于术后28 d(1.00±0.00 vs 2.16±0.60),差异具有统计学意义(t=2.801,P<0.05)。见表 3。
| 表 3 各组大鼠肾组织microRNA-21表达的比较(n=6,x±s) |
|
|
参考崔炯等[17]的方法对Masson染色肾间质纤维化程度进行评分,并与microRNA-21的表达进行相关性分析,结果显示,microRNA-21表达与肾间质纤维化程度呈显著正相关(r=0.881,P<0.05)。
3 讨论肾纤维化以成纤维细胞和细胞外基质蛋白的异常沉积为特征,伴随肾小球硬化、肾小管萎缩、肾间质炎症、实质细胞丢失,肾功能逐渐丧失,其过程复杂,如何逆转或延缓肾纤维化进展仍是目前研究的重点[18]。1, 25-(OH)2D3与维生素D受体(VDR)特异性结合发挥生物学效应。VDR分为膜VDR(mVDR)和核VDR(nVDR)两大类。mVDR主要参与控制矿物质的动态平衡; nVDR参与基因的表达,调控细胞的增殖、分化,在抗炎、抗癌、抗氧化、抗纤维化以及免疫调节中起重要作用[19-21]。目前,活性维生素D用于CKD与透析病人中以纠正钙磷代谢紊乱已达成专家共识[22]。
随着研究的深入,microRNAs作为生物学靶点治疗各种疾病已受到学界的广泛关注。既往研究结果表明,肾纤维化与microRNAs的表达有着密切的关系[12]。TGF-β是肾纤维化的关键因子,既可由microRNA-21进行调节,又可通过Smad3信号传导诱导microRNA-21表达,microRNA-21与TGF-β/Smad3信号途径之间存在正反馈调节[23]。UUO(单侧输尿管梗阻)模型是以加速的方式模仿人类慢性阻塞性肾病[24]。在本研究中,UUO组大鼠Scr水平升高,肾小管扩张明显,多数肾小管基底膜完全丧失,间质显著增宽,可见到大量单核细胞浸润、纤维组织增生,肾间质损伤及纤维化程度增高,提示UUO模型建立成功。随着UUO模型大鼠肾纤维化的进展,microRNA-21的表达水平增加且与肾纤维化程度呈显著正相关,表明microRNA-21参与肾纤维化的过程并随肾纤维化的进展其表达水平增高。与UUO组相比,干预组大鼠Scr水平降低,且HE染色、Masson染色结果也显示,干预组大鼠肾小管间质损伤及纤维化程度明显改善,表明1, 25-(OH)2D3在一定程度上具有延缓UUO模型大鼠肾小管间质纤维化、保护肾功能的作用,这与既往研究结果一致[12, 16, 25]。随着时间的进展,Sham组大鼠肾脏组织形态未见明显变化,而UUO组和干预组大鼠肾脏组织的纤维化面积逐渐增大,提示1, 25-(OH)2D3虽然可以延缓UUO模型大鼠肾纤维化进展,但不能逆转肾纤维化。各组血Ca、P水平比较差异无统计学意义,说明1, 25-(OH)2D3的抗纤维化作用不依赖于钙磷调节途径。据文献报道,1, 25-(OH)2D3与其受体结合可降低Smad3的转录活性,抑制TGF-β的表达,从而抑制肾纤维化[16, 25]。因此,1, 25-(OH)2D3与microRNA-21存在共同的调控肾纤维化的途径,即TGF-β/Smad3。本文研究结果显示,Sham组大鼠肾组织microRNA-21的表达水平低于UUO组和干预组,而干预组大鼠肾组织microRNA-21的表达低于UUO组,差异有统计学意义,说明1, 25-(OH)2D3可能下调了大鼠肾组织中microRNA-21的表达水平。
综上所述,1, 25-(OH)2D3可能通过下调UUO肾纤维化模型大鼠肾组织中microRNA-21的表达而延缓肾纤维化的进展。但本研究由于样本数有限以及未进行相关的体外实验,关于1, 25-(OH)2D3调控microRNA-21表达延缓肾纤维化的具体机制还未充分阐明,有待今后继续研究。
| [1] |
CHEN T K, KNICELY D H, GRAMS M E. Chronic kidney disease diagnosis and management: a review[J]. JAMA, 2019, 322(13): 1294-1304. DOI:10.1001/jama.2019.14745 |
| [2] |
XIAO Y, JIANG X H, PENG C, et al. BMP-7/Smads-induced inhibitor of differentiation 2 (Id2) upregulation and Id2/Twist interaction was involved in attenuating diabetic renal tubulointerstitial fibrosis[J]. The International Journal of Biochemistry & Cell Biology, 2019, 116: 105613. |
| [3] |
曾锦江, 米华. TGF-β/Smad信号通路在肾纤维化中的研究进展[J]. 广东医学, 2017, 38(15): 2412-2415. |
| [4] |
SIERRA-MONDRAGON E, RODRÍGUEZ-MUÑOZ R, NAMORADO-TONIX C, et al. All-trans retinoic acid atte-nuates fibrotic processes by downregulating TGF-β1/Smad3 in early diabetic nephropathy[J]. Biomolecules, 2019, 9(10): 525-544. DOI:10.3390/biom9100525 |
| [5] |
FAN Y L, CHEN H T, HUANG Z X, et al. Emerging role of miRNAs in renal fibrosis[J]. RNA Biol, 2020, 17(1): 1-12. DOI:10.1080/15476286.2019.1667215 |
| [6] |
TRIONFINI P, BENIGNI A. MicroRNAs as master regulators of glomerular function in health and disease[J]. J Am Soc Nephrol: JASN, 2017, 28(6): 1686-1696. DOI:10.1681/ASN.2016101117 |
| [7] |
LV W, FAN F, WANG Y G, et al. Therapeutic potential of microRNAs for the treatment of renal fibrosis and CKD[J]. Physiol Genom, 2018, 50(1): 20-34. |
| [8] |
LYU H Y, LI X, WU Q, et al. Overexpression of microRNA-21 mediates Ang Ⅱ-induced renal fibrosis by activating the TGF-β1/Smad3 pathway via suppressing PPARα[J]. Journal of Pharmacological Sciences, 2019, 141(1): 70-78. DOI:10.1016/j.jphs.2019.09.007 |
| [9] |
ZHENG S B, ZHENG Y, JIN L W, et al. Microvesicles containing microRNA-21 secreted by proximal tubular epithelial cells are involved in renal interstitial fibrosis by activating AKT pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(3): 707-714. |
| [10] |
TUCKEY R C, CHENG C Y S, SLOMINSKI A T. The se-rum vitamin D metabolome: What we know and what is still to discover[J]. J Steroid Biochem Mol Biol, 2019, 186: 4-21. DOI:10.1016/j.jsbmb.2018.09.003 |
| [11] |
SHEN Q Q, BI X, LING L L, et al. 1, 25-dihydroxyvitamin D3 attenuates angiotensin Ⅱ-induced renal injury by inhibiting mitochondrial dysfunction and autophagy[J]. Cell Physiol Biochem: Int J Exp Cell Physiol Biochem Pharmacol, 2018, 51(4): 1751-1762. DOI:10.1159/000495678 |
| [12] |
HU X F, LIU W L, YAN Y L, et al. Vitamin D protects against diabetic nephropathy: evidence-based effectiveness and mechanism[J]. Eur J Pharmacol, 2019, 845: 91-98. DOI:10.1016/j.ejphar.2018.09.037 |
| [13] |
SHANY S, SIGAL-BATIKOFF I, LAMPRECHT S. Vitamin D and myofibroblasts in fibrosis and cancer: at cross-purposes with TGF-β/SMAD signaling[J]. Anticancer Research, 2016, 36(12): 6225-6234. DOI:10.21873/anticanres.11216 |
| [14] |
HUANG Q F, ZHANG X L, BAI F C, et al. Methyl helic-terte ameliorates liver fibrosis by regulating miR-21-mediated ERK and TGF-β1/Smads pathways[J]. Int Immunopharmacol, 2019, 66: 41-51. DOI:10.1016/j.intimp.2018.11.006 |
| [15] |
陈香美. 肾脏病学实验技术操作规程[M]. 北京: 人民军医出版社, 2011: 206-208.
|
| [16] |
金瑞日, 鲍晓荣. 活性维生素D3对大鼠肾小管间质纤维化的影响及其机制研究[J]. 中国临床医学, 2015, 22(6): 722-726. |
| [17] |
崔炯, 吴小婷, 尤丹瑜, 等. 巨噬细胞清除对补体C3缺失的单侧输尿管梗阻小鼠肾间质纤维化的影响[J]. 中华肾脏病杂志, 2019, 35(9): 690-698. |
| [18] |
ZHANG X F, YANG Y, ZHANG J, et al. Microvesicle-containing miRNA-153-3p induces the apoptosis of proximal tubular epithelial cells and participates in renal interstitial fibrosis[J]. Eur Rev Med Pharmacol Sci, 2019, 23(22): 10065-10071. |
| [19] |
GALLO D, MORTARA L, GARIBOLDI M B, et al. Immunomodulatory effect of vitamin D and its potential role in the prevention and treatment of thyroid autoimmunity: a narrative review[J]. Journal of Endocrinological Investigation, 2020, 43(4): 413-429. DOI:10.1007/s40618-019-01123-5 |
| [20] |
MURDACA G, TONACCI A, NEGRINI S, et al. Emerging role of vitamin D in autoimmune diseases: an update on evidence and therapeutic implications[J]. Autoimmunity Reviews, 2019, 18(9): 102350. DOI:10.1016/j.autrev.2019.102350 |
| [21] |
HARRISON S R, LI D Y, JEFFERY L E, et al. Vitamin D, autoimmune disease and rheumatoid arthritis[J]. Calcif Tissue Int, 2020, 106(1): 58-75. DOI:10.1007/s00223-019-00577-2 |
| [22] |
JEAN G, SOUBERBIELLE J, CHAZOT C. Vitamin D in chronic kidney disease and dialysis patients[J]. Nutrients, 2017, 9(4): 328. DOI:10.3390/nu9040328 |
| [23] |
LAI JENNIFER Y, LUO JH, O'CONNOR C, et al. MicroRNA-21 in glomerular injury[J]. J Am Soc Nephrol, 2015, 26(4): 805-816. |
| [24] |
MARTÍNEZ-KLIMOVA E, APARICIO-TREJO O E, TAPIA E, et al. Unilateral ureteral obstruction as a model to investigate fibrosis-attenuating treatments[J]. Biomolecules, 2019, 9(4): 141-169. DOI:10.3390/biom9040141 |
| [25] |
刘萍, 席春生. 活性维生素D在肾纤维化中的治疗作用及机制[J]. 中国中西医结合肾病杂志, 2018, 19(9): 841-843. |
 2020, Vol. 56
2020, Vol. 56

