在当今发达国家和发展中国家中, 肥胖患病率正逐步上升[1-2]。肥胖会导致多种疾病的发生发展, 包括心血管疾病、糖尿病[3], 同时肥胖也是焦虑症和抑郁症等精神疾病的危险因素[4], 这严重影响了肥胖者正常的社交和生活。有研究认为, 肥胖特别是伴有进食障碍者存在脑部前额叶皮质异常, 特别是在腹内侧前额叶皮质(vmPFC)和背外侧前额叶皮质(DLPFC)区域, 这些脑区的异常可能与肥胖者的行为表现有关[5]。
决策是对选择的后果进行反思后作出选择的认知过程, 其中前额叶皮质区的DLPFC和vmPFC起关键的作用[6]。决策通常通过爱荷华州赌博任务(IGT)来进行评估, IGT是一个以赚钱为目标的简单纸牌任务, 用来评估风险偏好, 通过考虑不确定性、奖励和惩罚来模拟现实生活中的决策策略[7]。IGT允许模糊性和风险下的决策, 其中的Block1对应以未知事件为特征的模糊性决策, 而Block2~5对应以可能结果的已知概率分布为特征的风险决策[8]。该任务可应用于评估vmPFC病变的行为特点, 其结果表明vmPFC损伤可能导致IGT表现异常[9]。有研究表明, 肥胖经常与进食障碍尤其是暴饮暴食和相关疾病导致的决策受损有关[10-13]。但是目前对于非进食障碍肥胖病人决策情况的相关临床对照试验较少, 样本量不足, 难以全面评估这类人群的决策差异。故本研究通过检索国内外已发表的文献, 利用Meta分析方法进行综合统计、定量分析与评价, 探讨非进食障碍肥胖者的决策情况, 为实现有效控制体质量和减肥的治疗策略提供理论依据。现将结果报告如下。
1 资料和方法 1.1 资料来源由两名研究者独立检索万方中文科技期刊数据库、中国知网、Pubmed、Web of Science及Elsevier ScienceDirect数据库中所有关于IGT测量非进食障碍肥胖者决策的随机对照试验, 并将检索结果进行合并, 根据纳入标准和排除标准选取符合标准的中英文文献, 若有分歧, 则经两名研究者讨论后达成一致。中文数据库检索关键词为肥胖、决策、爱荷华州赌博任务, 检索式为“肥胖”和“决策或爱荷华州赌博任务或赌博任务”。英文数据库的检索策略为, 以“Obesity”AND“Decision making OR Iowa Gambling Task OR Gambling Task”为检索式进行检索。检索年限为数据库建库至2019年7月。根据初次检索所得文献的参考文献, 再行扩大检索。
1.2 文献纳入和排除标准纳入标准:①原始文献有明确的分组, 明确没有暴饮暴食或者其他进食障碍; ②研究结果报告了IGT得分; ③非进食障碍肥胖组(简称肥胖组, 体质量指数(BMI)≥30 kg/m2)与正常体质量(BMI<30 kg/m2)的健康对照组进行了比较。排除标准:①暴饮暴食病人和具有其他进食障碍者; ②重复报告、质量差、报道信息太少及无法利用的文献; ③研究类型为动物实验。
1.3 质量评价文献的质量采用Jadad质量评分表评价, 总评分1~3分为低质量, 4~7分为高质量。分别从以下几个方面进行评价:随机分组序列产生方法(0~2分), 分配隐藏(0~2分), 双盲法(0~2分), 退出与失访(0~1分)。
1.4 数据提取由两名研究者单独对纳入文献进行数据提取, 提取的数据包括文献的第一作者和发表时间, 以及肥胖组和健康对照组的样本数、年龄、性别、BMI、受教育年限和IGT净得分(有利选择减去不利选择)等。对IGT中5个Block分别提取IGT得分, 区别模糊决策和风险决策。
1.5 统计分析应用Cochrane协作网提供的Meta分析软件RevMan 5.3进行统计学分析。采用Q统计量评估研究异质性:当I2<25%时, 认为不存在异质性; 当25%≤I2<50%时, 则认为研究存在轻度异质性; 当50%≤I2<75%时, 认为存在中度异质性; 当I2≥75%时, 认为存在重度异质性。采用随机效应模型进行Meta分析, Meta分析中的连续变量以x±s表示, 计算均数差(MD)及其95%置信区间(CI), 当95%CI不为0且P<0.05时, 即认为差异有显著性。采用漏斗图评估发表偏倚。
2 结果 2.1 纳入文献基本特征初步筛选后得到文献1 190篇, 排除重复出现的文献及与研究目的无关的文献后剩余108篇, 通过进一步阅读全文排除了综述、动物实验性研究, 纳入文献13篇, 其中4篇由于数据不全被排除, 最终纳入文献9篇[14-22]。9篇均为英文文献, 其中5篇为低质量文献, 4篇为高质量文献。纳入文献特征见表 1。
| 表 1 纳入文献特征(x±s) |
|
|
异质性分析结果显示, 各研究间异质性可以被接受(P>0.1;Q=4.94, df=8, I2=0)。采用随机效应模型进行Meta分析, 结果显示, 肥胖组IGT净得分低于健康对照组, 差异具有统计学意义(MD=-12.28, 95%CI=-15.52~-9.04, P<0.001)。见图 1。有4篇文献提供了5个环节的具体数据, 对这4篇文献的Meta分析结果显示, 在模糊环境下(Block1环节), 肥胖组与健康对照组的IGT得分差异无显著性(MD=0.26, 95%CI=-0.68~1.20, P>0.05);在风险环境下(Block2~5环节), 肥胖组的IGT得分明显低于健康对照组, 差异具有统计学意义(Block2:MD=-2.93, 95%CI=-4.39~-1.47, P<0.001;Block3:MD=-2.94, 95%CI=-4.44~-1.45, P<0.001;Block4:MD=-3.45, 95%CI=-4.80~-2.10, P<0.001;Block5:MD=-3.59, 95%CI=-5.60~-1.58, P<0.001)。见图 2。从漏斗图中可以看出, 纳入的各项研究基本呈对称分布, 提示不存在发表偏倚。两组IGT净得分比较漏斗图见图 3。
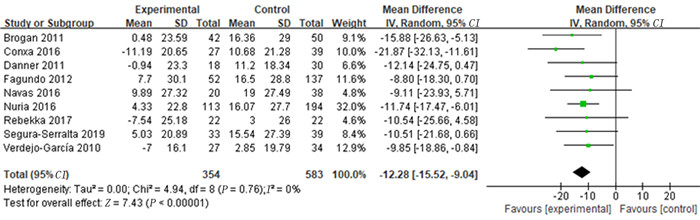 |
| 图 1 肥胖组和健康对照组总IGT净得分比较的Meta分析 |
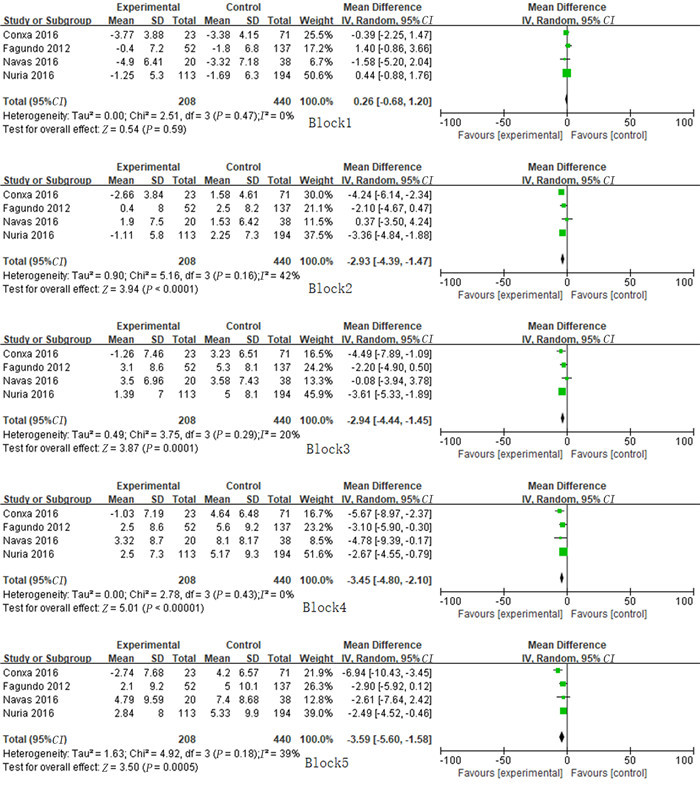 |
| 图 2 肥胖组和健康对照组各环节IGT得分比较的Meta分析 |
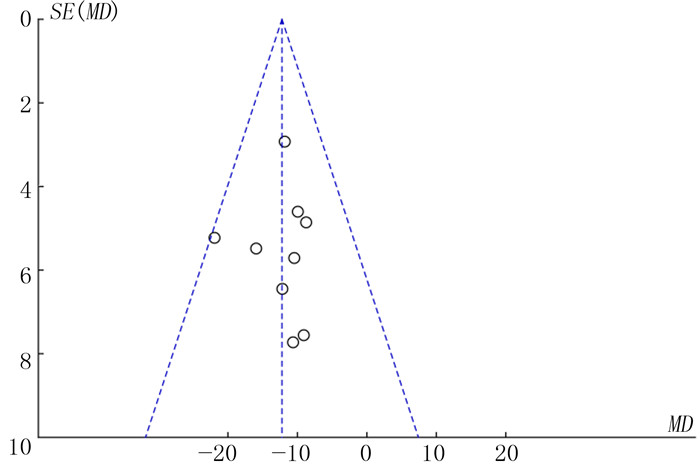 |
| 图 3 肥胖组和健康对照组IGT净得分比较的漏斗图 |
本研究通过对纳入的9篇文献进行Meta分析, 旨在探讨非进食障碍肥胖者的决策特点。结果显示, 非进食障碍肥胖人群决策功能出现障碍, 具体来说, 在情况不明确时(模糊环境), 两组的决策能力没有差异, 而在知道有风险的情况下(风险环境), 非进食障碍肥胖人群的决策能力比健康对照组要差, 对负面长期结果的敏感性降低, 对偶然环境线索的敏感性更高, 倾向于高风险即时的选择而不是低风险长期有利的选择。
本研究结果与另一非食物相关的决策任务, 即“延迟奖励折扣任务(DRD任务)”的研究结果相一致[23]。DRD任务是一种量化即时的、较小的奖励相对于延迟的、大的奖励的价值程度的方法[24]。该研究结果表明, 高DRD与不佳的行为模式和健康结果有关, 如上瘾障碍, 包括药物和乙醇依赖[25]、吸烟[26]和病态赌博[27]等。同时, 该研究首次提出, 肥胖人群存在对短期奖励较高的敏感性和对长期奖励较低的敏感性, 并且这种行为与性别没有关系。
有研究表明, 非进食障碍肥胖者存在决策受损的原因可能与DLPFC和vmPFC密切相关[28]。因为DLPFC主要负责更高的认知功能, 如奖励评估、工作记忆和注意力的维持、运动规划以及对饮食/情绪的认知控制等[29-30], 在评估选择的不确定性时其作用更为重要[31]。所以, DLPFC活动与决策能力具有相关性。而vmPFC活动可能反映了主观或客观选择的期望值, 但同时也与处理奖励结果和产生学习信号有关[32-33], 因此决策能力改变与其存在相关性。DLPFC、vmPFC受损与较差的反应抑制(即抑制对特定刺激的冲动反应的能力)也有关[34-35], 因此, 肥胖人群可能会优先考虑与可能的高即时回报相关的选择, 而不是低但有长期回报的相关选择[36]。IGT是一个以赚钱为目标的简单纸牌任务, 用来评估决策偏好, 通过考虑不确定性、奖惩行为和脑加工模式来模拟现实生活中的决策策略[7, 37]。许多决策或赌博任务, 不管有没有食物刺激, 都可能涉及不同的认知过程, 例如模糊的或有风险的决策, 这些决策可以通过标准化的IGT版本来解决[12]。本文Meta分析结果显示, 非进食障碍肥胖者决策功能出现明显障碍。由此可以推断非进食障碍肥胖者vmPFC和DLPFC的功能可能受损。
总而言之, 本研究为非进食障碍肥胖人群的决策特点的研究提供了新的证据, 但本研究所采用文献的数据并未进行人群种族的区分, 因此, 所得结果是否存在种族差异有待进一步研究。此外, Meta分析方法受到纳入文献质量及数量的影响, 故准确了解非进食障碍肥胖人群在非食物环境下的决策表现, 仍需进行更多随机对照研究。本研究结果提示, 在非食物环境下, 非进食障碍肥胖人群的行为表现可能与大脑决策功能障碍有关, 但是, 大脑决策功能障碍对这类肥胖人群日常生活表现和减肥效果是否存在影响还有待进一步研究。
| [1] |
HORSTMANN A, FRANZISKA P B, DAVID M, et al. Obesity-related differences between women and men in brain structure and goal-directed behavior[J]. Frontiers in Human Neuroscience, 2011, 5(58): 1-9. |
| [2] |
PUIG E P, ROBLES N, SAIGÍ-RUBIÓ F, et al. Assessment of the efficacy, safety, and effectiveness of weight control and obesity management mobile health interventions: systematic review[J]. JMIR mHealth and uHealth, 2019, 7(10): e12612. DOI:10.2196/12612 |
| [3] |
BOATENG D, GALBETE C, NICOLAOU M, et al. Dietary patterns are associated with predicted 10-year risk of cardiovascular disease among ghanaian populations: the research on obesity and diabetes in African migrants (RODAM) study[J]. The Journal of Nutrition, 2019, 149(5): 755-769. DOI:10.1093/jn/nxz002 |
| [4] |
MUNIM M, ABDULLAH M, SUHAIL D, et al. Prospective associations between depression and obesity for adolescent males and females-a systematic review and Meta-analysis of longitudinal studies[J]. PLoS One, 2016, 11(6): e0157240. DOI:10.1371/journal.pone.0157240 |
| [5] |
HANS-RUDOLF B, HEIKE M, CHRISTOPHER D M. Blaming the brain for obesity: integration of hedonic and homeostatic mechanisms[J]. Gastroenterology, 2017, 152(7): 1728-1738. DOI:10.1053/j.gastro.2016.12.050 |
| [6] |
HOLSTEIN M V, FLORESCO S B. Dissociable roles for the ventral and dorsal medial prefrontal cortex in cue-guided risk/reward decision making[J]. Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology, 2020, 45(4): 683-693. DOI:10.1038/s41386-019-0557-7 |
| [7] |
GIUSTINIANI J, JOUCLA C, BENNABI D, et al. Behavioral and electrophysiological arguments in favor of a relationship between impulsivity, risk-taking, and success on the Iowa gambling task[J]. Brain Sciences, 2019, 9(10): 248. DOI:10.3390/brainsci9100248 |
| [8] |
KATRIN S, AGORKU J D, BRAND M. Exposure to unsolvable anagrams impairs performance on the Iowa gambling task[J]. Frontiers in Behavioral Neuroscience, 2017, 11(5): 114-122. |
| [9] |
BECHARA A, ANTONIO R D, DAMASIO H, et al. Insensitivity to future consequences following damage to human prefrontal cortex[J]. Cognition, 1994, 50(1/3): 7-15. |
| [10] |
FITZPATRICK S, GILBERT S, SERPELL L. Systematic review: are overweight and obese individuals impaired on behavioural tasks of executive functioning[J]. Neuropsychology Review, 2013, 23(2): 138-156. DOI:10.1007/s11065-013-9224-7 |
| [11] |
CORTESE S, ERIKA C, VINCENZI B, et al. Attention-deficit/hyperactivity disorder and impairment in executive functions: a barrier to weight loss in individuals with obesity[J]. BMC Psychiatry, 2013, 13(1): 286-293. |
| [12] |
ANDREA M R, HANS-JOCHEN H, SCHLAGENHAUF F, et al. Impaired flexible reward-based decision-making in binge eating disorder: evidence from computational modeling and functional neuroimaging[J]. Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology, 2017, 42(3): 628-637. |
| [13] |
HORSTMANN A. It wasn't me; it was my brain-obesity-associated characteristics of brain circuits governing decision-making[J]. Physiology & Behavior, 2017, 176(4): 125-133. |
| [14] |
FAGUNDO A B, DE LA TORRE R, JIMÉNEZ-MURCIA S, et al. Executive functions profile in extreme eating/weight conditions: from anorexia nervosa to obesity[J]. PLoS One, 2012, 7(8): e43382. |
| [15] |
DANNER U N, OUWEHAND C, VAN HAASTERT N L, et al. Decision-making impairments in women with binge eating disorder in comparison with obese and normal weight women[J]. European Eating Disorders Review: the Journal of the Eating Disorders Association, 2012, 20(1): e56-e62. DOI:10.1002/erv.1098 |
| [16] |
BROGAN A, HEVEY D, O'CALLAGHAN G, et al. Impaired decision making among morbidly obese adults[J]. Journal of Psychosomatic Research, 2011, 70(2): 189-196. DOI:10.1016/j.jpsychores.2010.07.012 |
| [17] |
VERDEJO-GARCÍA A, PÉREZ-EXPÓSITO M, SCHMIDT-RÍO-VALLE J, et al. Selective alterations within executive functions in adolescents with excess weight[J]. Obesity, 2010, 18(8): 1572-1578. DOI:10.1038/oby.2009.475 |
| [18] |
PERPIÑÁ C, SEGURA M, SÁNCHEZ-REALES S. Cognitive flexibility and decision-making in eating disorders and obesity[J]. Eating and Weight Disorders-Studies on Anorexia Bulimia and Obesity, 2017, 22(3): 435-444. DOI:10.1007/s40519-016-0331-3 |
| [19] |
KITTEL R, SCHMIDT R, HILBERT A. Executive functions in adolescents with binge-eating disorder and obesity[J]. International Journal of Eating Disorders, 2017, 50(8): 933-941. DOI:10.1002/eat.22714 |
| [20] |
NAVAS J F, VILAR-LÓPEZ R, PERALES J C, et al. Altered decision-making under risk in obesity[J]. PLoS One, 2016, 11(6): e0155600. DOI:10.1371/journal.pone.0155600 |
| [21] |
MALLORQUÍ-BAGUÉ N, FAGUNDO A B, JIMENEZ-MURCIA S, et al. Decision making impairment: a shared vulnerability in obesity, gambling disorder and substance use disorders[J]. PLoS One, 2016, 11(9): e0163901. DOI:10.1371/journal.pone.0163901 |
| [22] |
SEGURA-SERRALTA M, PERPIÑÁ C, CÍSCAR S, et al. Funciones ejecutivas y regulación emocional en obesidad y trastornos alimentarios[J]. Nutricion Hospitalaria, 2019, 36(1): 167-172. |
| [23] |
THOMAS J G, SEIDEN A, KOFFARNUS M N, et al. Delayed reward discounting and grit in men and women with and without obesity[J]. Obesity Science & Practice, 2015, 1(2): 131-135. |
| [24] |
OSHRI A, HALLOWELL E, LIU S, et al. Socioeconomic hardship and delayed reward discounting: associations with working memory and emotional reactivity[J]. Developmental Cognitive Neuroscience, 2019, 37(6): 100642-100653. |
| [25] |
MACKILLOP J, MICHAEL T A, LAUREN R F, et al. Delayed reward discounting and addictive behavior: a meta-analysis[J]. Psychopharmacology, 2011, 216(3): 305-321. |
| [26] |
BICKEL W K, ODUM A L, MADDEN G J. Impulsivity and cigarette smoking: delay discounting in current, never, and ex-smokers[J]. Psychopharmacology, 1999, 146(4): 447-454. |
| [27] |
ALESSI S M, PETRY N M. Pathological gambling severity is associated with impulsivity in a delay discounting procedure[J]. Behavioural Processes, 2003, 64(3): 345-354. DOI:10.1016/S0376-6357(03)00150-5 |
| [28] |
MARCI E G, VISWANATH P, STINSON E J. Obesity, appetite, and the prefrontal cortex[J]. Current Obesity Reports, 2017, 6(4): 380-388. DOI:10.1007/s13679-017-0289-0 |
| [29] |
XIA Xu, DENG Zhangyan, QIN Huang, et al. Prefrontal cortex-mediated executive function as assessed by Stroop task performance associates with weight loss among overweight and obese adolescents and young adults[J]. Behavioural Brain Research, 2017, 321(3): 240-248. |
| [30] |
BOGDANOV M, RUFF C C, SCHWABE L. Transcranial stimulation over the dorsolateral prefrontal cortex increases the impact of past expenses on decision-making[J]. Cereb Cortex, 2017, 27(2): 1094-1102. |
| [31] |
CLAUDIO G, PHILIPP G, ADRIAN M, et al. Food craving, food choice and consumption: the role of impulsivity and sham-controlled tDCS stimulation of the right dlPFC[J]. Physiology & Behavior, 2017, 177(4): 20-26. |
| [32] |
BLANKENSTEIN N E, JISKA S P, EVELINE A C, et al. Neural mechanisms underlying risk and ambiguity attitudes[J]. Journal of Cognitive Neuroscience, 2017, 29(11): 1845-1859. DOI:10.1162/jocn_a_01162 |
| [33] |
HISER J, KOENIGS M. The multifaceted role of the ventromedial prefrontal cortex in emotion, decision making, social cognition, and psychopathology[J]. Biological Psychiatry, 2018, 83(8): 638-647. DOI:10.1016/j.biopsych.2017.10.030 |
| [34] |
TONG T, CHIGNELL M, DEGUZMAN C A. Using a serious game to measure executive functioning: response inhibition ability[J]. Applied Neuropsychology: Adult, 2019, 1-12. DOI:10.1080/23279095.2019.1683561 |
| [35] |
KIM S, LEE D. Prefrontal cortex and impulsive decision making[J]. Biological Psychiatry, 2011, 69(12): 1140-1146. DOI:10.1016/j.biopsych.2010.07.005 |
| [36] |
LEVY I. Neuroanatomical substrates for risk behavior[J]. The Neuroscientist, 2017, 23(3): 275-286. |
| [37] |
KUMAR R, KUMAR K J, BENEGAL V. Underlying decision making processes on Iowa Gambling Task[J]. Asian J Psychiatr, 2019, 39(1): 63-69. |
 2020, Vol. 56
2020, Vol. 56

