2. 青岛大学附属青岛市妇女儿童医院重症医学中心, 山东 青岛 266034
体外循环(CPB)的非生理性灌注、血液成分与管道界面的非生理性接触、手术创伤、主动脉阻断后再开放导致的心肌缺血-再灌注损伤等均可激活人体的补体、凝血、纤溶系统,继而使单核细胞、巨噬细胞和中性粒细胞等释放炎症细胞因子,造成全身炎症反应综合征(SIRS),导致降钙素原(PCT)、白细胞介素6(IL-6)及C反应蛋白(CRP)水平升高[1-2],从而造成组织器官损害,最终诱发多种CPB术后并发症。PCT在鉴别感染与非感染方面具有一定价值。近年来,关于PCT水平与CPB术后炎症反应相关性方面的研究逐渐增多。有研究结果表明,即使先天性心脏病(简称先心病)病儿CPB术后早期不存在感染,PCT水平也明显升高,且升高程度与手术时间有关[3]。有研究认为,PCT在CPB术后较早期表达,是CPB术后全身炎症反应严重程度的一个理想预警指标[2]。PCT在成人心脏手术中的表达变化研究相对较多,而有关先心病病儿CPB下心内直视手术围手术期血清PCT水平变化的研究则较少。本研究系统观察了先心病病儿围手术期血清PCT、IL-6及CRP水平的动态变化,旨在精确评估CPB术后全身炎症反应情况,为围手术期的临床处理提供依据。
1 对象与方法 1.1 研究对象收集2018年6—8月我院收治的63例先心病病儿,其中男32例,女31例;年龄1 d~132月,平均(15.7±23.4)月。所有病儿均经超声心动图确诊先心病,并拟行CPB下先心病矫治术。术前1 h及术后48 h内按照诊疗常规给予抗生素预防感染,均采用相同的CPB预充方式及静吸复合气管插管全麻。排除标准:①术前感染;②既往有肝肾功能异常、自身免疫性疾病、肿瘤等其他疾病;③术后全身感染(术后体温持续高于39 ℃,血培养结果提示感染,床旁胸部X线片、痰培养结果均提示存在肺部感染)。本研究经医院伦理委员会批准(QFELL-KY-2019-032),病儿家属均签署知情同意书。
根据先心病的复杂程度将病儿分为3组:A组8例,均为单纯房间隔缺损(ASD);B组45例,包括单纯室间隔缺损(VSD)41例,VSD合并ASD 4例;C组10例,均为复杂型先心病,包括完全房室间隔缺损(AVSD)2例,完全大动脉转位(TGA)3例,主动脉弓缩窄(COA)2例,主动脉瓣上狭窄(SVAS)1例,完全性肺静脉异位引流(TAPVC)1例,法洛四联症(TOF)1例。
1.2 检测方法分别于术前(T0)以及术后第1天(T1)、第2天(T3)、第3天(T3)、第7天(T4)采集先心病病儿的静脉血各2份。一份静脉血1 mL,送我院检验科常规检测CRP水平;另一份静脉血2 mL,用于检测PCT和IL-6水平。PCT和IL-6检测方法:先将静脉血以3 500 r/min离心5 min,取澄清透明血清100 μL垂直加入检测卡(深圳金准生物医学工程有限公司提供,检测卡批准号:20172401871)加样孔中,应用干式荧光免疫分析仪(深圳金准生物医学工程有限公司提供)同时检测PCT和IL-6水平。
1.3 统计学分析应用SPSS 21.0软件进行统计学处理,计量数据以x±s表示,组间比较采用Mann-Whitney检验,相关性检验采用Pearson相关性分析,以P<0.05为差异有显著性。
2 结果 2.1 先心病病儿的手术相关指标本文63例病儿,手术时间为90~320 min,平均(156.2±51.2)min;CPB时间为20~208 min,平均(74.9±41.4)min;住院时间为7~35 d,平均(17.5±7.3)d;监护室留置时间1~35 d,中位数时间为2 d。
2.2 先心病病儿围手术期血清PCT、CRP及IL-6水平的总体变化所有先心病病儿血清PCT、IL-6和CRP水平在CPB后开始升高,达峰值后逐渐下降。PCT、IL-6水平均在术后第1天达峰值,之后缓慢下降,术后第7天大致恢复正常水平;而CRP水平于术后第2天达峰值,术后第7天大致恢复正常水平。见图 1。
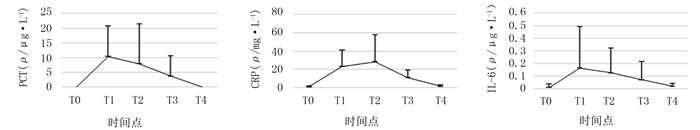 |
| 图 1 先心病病儿围手术期血清PCT、CRP及IL-6水平的总体变化规律 |
不同年龄、病种、术前NT-ProBNP水平先心病病儿的血清PCT、CRP和IL-6水平随时间的变化规律与先心病病儿的总体变化规律大致相同。术后第1、2、3天,>1岁病儿血清PCT水平明显低于≤1岁病儿(Z=2.30~3.78,P<0.05),但不同年龄组病儿的血清CRP和IL-6水平比较差异无统计学意义(P均>0.05)。术前NT-ProBNP>125 ng/L病儿术后第1、2、3天的血清PCT水平均明显高于NT-ProBNP≤125 ng/L病儿(Z=2.81~3.48,P<0.05),术后第3天的血清IL-6水平明显高于NT-ProBNP≤125 ng/L病儿(Z=8.04,P<0.05)。C组病儿术后第1、2、3天的血清PCT水平较A组病儿明显升高(Z=2.10~2.47,P<0.05),术后第1、3天的血清PCT水平亦较B组病儿明显升高(Z=2.04、2.22,P<0.05)。见表 1~3。
| 表 1 不同年龄病儿不同时间点血清PCT、IL-6和CRP水平的比较(x±s) |
|
|
| 表 2 不同NT-proBNP水平病儿不同时间点血清PCT、IL-6和CRP水平的比较(x±s) |
|
|
| 表 3 不同病种各组病儿不同时间点血清PCT、IL-6和CRP水平的比较(x±s) |
|
|
对63例病儿不同时间点血清PCT、IL-6及CRP水平与手术时间的相关性进行Pearson相关性分析,结果显示,术后第1天血清PCT峰值水平与手术时间相关(r=0.411,P<0.01),术后第2、3、7天的PCT水平与手术时间也存在相关性(r=0.259~0.286,P<0.05)。而各时间点血清IL-6、CRP水平与手术时间均无相关性(P>0.05)。
3 讨论PCT为降钙素前体,正常生理情况下主要由甲状腺C细胞和肺内的一些神经内分泌细胞产生,不具有激素活性。在细菌感染时,细菌内毒素和肿瘤坏死因子-α(TNF-α)、IL-6等细胞因子诱导肝脏的巨噬细胞、肺及肠道组织的淋巴细胞合成并分泌PCT,导致血清PCT水平迅速升高。目前,临床上常用的发热、白细胞计数、血红细胞沉降率及CRP等传统监测指标对炎症反应的灵感度较高,但特异度低[4],且很难区分CPB引起的非感染全身炎症及感染相关性炎症。1993年,ASSICOT等[3]首次提出PCT可作为败血症和感染的生物标志物,并报告其水平与细菌感染的严重程度有关。在大手术(如心胸及腹部手术等)、严重创伤、大面积烧伤等应激下,即使没有细菌感染也可以激发体内TNF-α、IL-6及IL-8等炎性细胞因子释放而诱导血清PCT水平升高,这是一种非特异性表现[5-6]。1998年,HEN-SEL等[7]在急性肺损伤的研究中发现,所有病人血清PCT浓度均显著升高。而手术后即使无感染,血清PCT水平亦会出现一过性升高,且常与CPB术后炎症反应密切相关。KILGER等[8]研究结果显示,术后血清PCT水平显著升高,且行CPB术病人的血清PCT水平比未行CPB术病人高。在CPB下行心内直视手术会影响血清PCT水平[9]。文献报道,在无全身感染情况下,术后血清PCT水平升高,可能与手术创伤、CPB时间、手术时间及主动脉阻断时间等有一定相关性[10-11]。但有关先心病病儿CPB术后血清PCT变化方面的研究较少。因此,本研究探讨了先心病病儿在CPB下行心内直视手术围手术期血清PCT水平的变化规律,结果显示,所有病儿术前血清PCT水平均在正常范围内,在CPB术后无感染的情况下,病儿血清PCT水平在术后24 h内升高并达峰值,术后第2、3天逐渐下降,术后第7天可降至正常水平。对多数病人来说,在无感染等并发症情况下,术后3~5 d内血清PCT水平逐渐下降到正常范围内[10];当发生术后感染等并发症时,SIRS可持续存在,从而导致血清PCT水平持续保持较高水平。另有临床研究发现,新生儿出生后2 d内血清PCT水平生理性增高,达峰值后逐渐恢复到成人水平[12]。不同年龄病儿行CPB后血清PCT水平是否有差异有待研究。本文研究结果显示,年龄≤1岁病儿术后第1、2、3天的血清PCT水平均较年龄>1岁病儿高,差异具有统计学意义。因此,年龄可能是影响CPB后血清PCT水平的重要因素。MALLAMACI等[13]研究显示,心功能不全病人血清PCT水平升高,原因可能与心功能不全时肺部充血显著,易导致肺部细菌生长,从而导致肺部感染率增高有关。国内外的研究均证实,NT-ProBNP在心力衰竭病人血清中的含量与心力衰竭的严重程度呈正相关[14-15]。本研究结果显示,术前NT-ProBNP>125 ng/L病儿术后第1、2、3天的血清PCT水平明显高于NT-ProBNP≤125 ng/L病儿。提示心功能状态亦可能是影响血清PCT水平的重要因素之一。先心病病种不同,手术的复杂程度就不同,对病儿血清PCT水平的变化也有所影响[16-17]。本研究用先心病病种复杂程度分类代表手术的复杂程度,结果表明手术复杂程度亦可影响血清PCT水平变化。
IL-6是一种由两条糖蛋白组成的多肽,主要由单核细胞和巨噬细胞产生,在炎症反应调节中起核心作用,可诱导肝细胞和肺内成纤维细胞合成释放CRP、PCT等急性时相蛋白。某些非感染因素亦会引起血清IL-6水平的非特异性升高[18]。血清IL-6水平升高的程度与病情严重程度及死亡率显著相关,可作为判断预后及观察疗效的指标之一[19-20]。IL-6可调节急性期蛋白质产生,终止B细胞免疫球蛋白分化和分泌,使T细胞失活,也是一种内源性致热原。IL-6主要来源于心肌,和心肌损害具有密切相关性[21]。有文献报道,在儿童心脏手术后IL-6水平升高[22]。本研究中,NT-ProBNP>125 ng/L病儿术后第3天的血清IL-6水平明显高于NT-ProBNP≤125 ng/L病儿,而术后其他时间点两组无明显差异,提示心功能不全可能对血清IL-6水平的下降程度具有一定影响,但这还需进一步研究。CRUICKSHANK等[23]对不同手术类型病人的检测结果显示,血清IL-6水平在切皮后2~4 h均升高,在术后24 h内达到峰值,后逐渐降至正常水平,这与本研究结果一致。CRUICKSHANK等[23]的研究还结果显示,血清IL-6水平与手术复杂程度有密切关系,手术越复杂,手术持续时间越长,IL-6水平越高。本研究结果则显示,手术复杂程度与血清IL-6水平无关,并且手术时间与血清IL-6水平也无明显相关性。本研究结果与上述文献报道不一致,可能是由于IL-6的半衰期短,两研究的标本采集时间差异较大有一定关系。
CRP是在机体受到创伤或炎症造成组织损伤时,由肝脏细胞在IL-6作用下合成释放入血的一种非特异性急性时相蛋白。在感染或任何组织创伤等应激状态下(包括急性创伤、烧伤及手术等非感染状态),CRP水平均显著增高[24]。已有研究显示,病人血清CRP水平均在心脏术后第3天达到峰值[10]。本研究结果显示,CPB术后在无感染状态下,血清CRP水平逐渐升高,在术后第2天达峰值后逐渐下降,至术后第7天大致恢复正常水平,且血清CRP水平不受年龄、心功能状态及手术时间的影响。
综上所述,在CPB术后无感染情况下,血清PCT水平一过性增高,与年龄、心功能状态、手术复杂程度及手术时间等存在一定关系。临床上可于CPB术后24 h开始检测血清PCT水平,若在术后第3天没有迅速下降,应警惕感染及并发症可能。了解CPB术后PCT的变化规律,对临床针对性治疗有一定指导作用,可合理指导抗生素的应用,预防术后并发症的发生。
| [1] |
SCHULTZ J M, KARAMLOU T, SWANSON J, et al. Hypothermic low-flow cardiopulmonary bypass impairs pulmonary and right ventricular function more than circulatory arrest[J]. The Annals of Thoracic Surgery, 2006, 81(2): 474-480. DOI:10.1016/j.athoracsur.2005.06.041 |
| [2] |
SULEIMAN M S, ZACHAROWSKI K, ANGELINI G D. Inflammatory response and cardioprotection during open-heart surgery: the importance of anaesthetics[J]. British Journal of Pharmacology, 2008, 153(1): 21-33. |
| [3] |
ASSICOT M, GENDREL D, CARSIN H, et al. High serum procalcitonin concentrations in patients with sepsis and infection[J]. Lancet, 1993, 341(8844): 515-518. DOI:10.1016/0140-6736(93)90277-N |
| [4] |
YUKIOKA H, YOSHIDA G, KURITA S, et al. Plasma procalcitonin in sepsis and organ failure[J]. Annals of the Academy of Medicine, Singapore, 2001, 30(5): 528-531. |
| [5] |
SCHUETZ P, AFFOLTER B, HUNZIKER S, et al. Serum procalcitonin, C-reactive protein and white blood cell levels following hypothermia after cardiac arrest: a retrospective cohort study[J]. European Journal of Clinical Investigation, 2010, 40(4): 376-381. DOI:10.1111/j.1365-2362.2010.02259.x |
| [6] |
SPONHOLZ C, SAKR Y, REINHART K, et al. Diagnostic value and prognostic implications of serum procalcitonin after cardiac surgery: a systematic review of the literature[J]. Critical Care (London, England), 2006, 10(5): R145. DOI:10.1186/cc5067 |
| [7] |
HENSEL M, VOLK T, DÖCKE W D, et al. Hyperprocalcitonemia in patients with noninfectious SIRS and pulmonary dysfunction associated with cardiopulmonary bypass[J]. Anesthesiology, 1998, 89(1): 93-104. DOI:10.1097/00000542-199807000-00016 |
| [8] |
KILGER E, PICHLER B, GOETZ A, et al. Procalcitonin as a marker of systemic inflammation after conventional or minimally invasive coronary artery bypass grafting[J]. The Thoracic and Cardiovascular Surgeon, 1998, 46(3): 130-133. DOI:10.1055/s-2007-1010209 |
| [9] |
ABDELLAH A, PIRIOU V, BASTIEN O, et al. Usefulness of procalcitonin for diagnosis of infection in cardiac surgical patients[J]. Critical Care Medicine, 2000, 28(9): 3171-3176. DOI:10.1097/00003246-200009000-00008 |
| [10] |
BEGHETTI M, RIMENSBERGER P C, KALANGOS A, et al. Kinetics of procalcitonin, interleukin 6 and C-reactive protein after cardiopulmonary-bypass in children[J]. Cardiology in the Young, 2003, 13(2): 161-167. |
| [11] |
ZANT R, STOCKER C, SCHLAPBACH L J, et al. Procalcitonin in the early course post pediatric cardiac surgery[J]. Pediatric Critical Care Medicine: a Journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies, 2016, 17(7): 624-629. |
| [12] |
彭蕾, 朱艳萍. 血清降钙素原和白细胞介素-6及高敏C反应蛋白对新生儿感染性疾病早期诊断价值的研究进展[J]. 中华实用诊断与治疗杂志, 2018, 32(4): 408-410. DOI:10.13507/j.issn.1674-3474.2018.04.030 |
| [13] |
MALLAMACI F, LEONARDIS D, PIZZINI P A, et al. Procalcitonin and the inflammatory response to salt in essential hypertension: a randomized cross-over clinical trial[J]. Journal of Hypertension, 2013, 31(7): 1424-1430. DOI:10.1097/HJH.0b013e328360ddd5 |
| [14] |
TAYLOR C J, ROALFE A K, ILES R, et al. The potential role of NT-proBNP in screening for and predicting prognosis in heart failure: a survival analysis[J]. BMJ Open, 2014, 4(4): e004675. DOI:10.1136/bmjopen-2013-004675 |
| [15] |
王正中, 王丽, 蒲毅, 等. 心力衰竭患者血浆BNP、NT-BNP及cTnⅠ水平的变化及其诊断价值研究[J]. 国际检验医学杂志, 2017, 38(9): 1283-1286. |
| [16] |
HAMMER S, ALEXANDRA T F, CARSTEN R, et al. Interleukin-6 and procalcitonin in serum of children undergoing cardiac surgery with cardiopulmonary bypass[J]. Acta Cardiologica, 2004, 59(6): 624-629. DOI:10.2143/AC.59.6.2005245 |
| [17] |
HÖVELS-GVRICH H H, SCHUMACHER K, VAZQUEZ-JIMENEZ J F, et al. Cytokine balance in infants undergoing cardiac operation[J]. The Annals of Thoracic Surgery, 2002, 73(2): 601-608. DOI:10.1016/S0003-4975(01)03391-4 |
| [18] |
徐瑛, 谢服役, 何立忠, 等. PCT、IL-6及hs-CRP在新生儿感染性疾病早期诊断中的价值[J]. 中华医院感染学杂志, 2011, 21(9): 1934-1935. |
| [19] |
BUTLER J, ROCKER G M, WESTABY S. Inflammatory response to cardiopulmonary bypass[J]. Annals Thorac Surg, 1993, 55(2): 552-559. DOI:10.1016/0003-4975(93)91048-R |
| [20] |
WAN S, LECLERC J L, VINCENT J L. Cytokine responses to cardiopulmonary bypass: lessons learned from cardiac transplantation[J]. The Annals of Thoracic Surgery, 1997, 63(1): 269-276. DOI:10.1016/S0003-4975(96)00931-9 |
| [21] |
HENNEIN H A, EBBA H, RODRIGUEZ J L, et al. Relationship of the proinflammatory cytokines to myocardial ischemia and dysfunction after uncomplicated coronary revascularization[J]. The Journal of Thoracic and Cardiovascular Surgery, 1994, 108(4): 626-635. DOI:10.1016/S0022-5223(94)70286-1 |
| [22] |
ARONEN M. Value of C-reactive protein in detecting complications after open-heart surgery in children[J]. Scandinavian Journal of Thoracic and Cardiovascular Surgery, 1990, 24(2): 141-145. DOI:10.3109/14017439009098058 |
| [23] |
CRUICKSHANK A M, FRASER W D, BURNS H J, et al. Response of serum interleukin-6 in patients undergoing elective surgery of varying severity[J]. Clinical Science (London, England:1979), 1990, 79(2): 161-165. DOI:10.1042/cs0790161 |
| [24] |
DELANNOY B, GUYE M L, SLAIMAN D H, et al. Effect of cardiopulmonary bypass on activated partial thromboplastin time waveform analysis, serum procalcitonin and C-reactive protein concentrations[J]. Critical Care, 2009, 13(6): R180. DOI:10.1186/cc8166 |
 2020, Vol. 56
2020, Vol. 56

