扁平苔癣是一种发生在皮肤、黏膜、指(趾)甲的慢性炎症性皮肤病,主要病理表现为基底细胞液化变性及真皮上部界面炎症反应带。其病因及发病机制目前尚未完全明了。近年来国内外关于口腔扁平苔癣组织中基质金属蛋白酶(MMPs)表达的研究较多,结果认为MMPs作为蛋白酶参与了细胞外基质(ECM)的降解,可能在扁平苔癣基底细胞及基底膜损伤中发挥重要作用[1-3]。作为MMPs的上游调控因子[4],CD147可诱导MMPs的活化并导致肿瘤的侵袭[5-7]。目前,国内外对于皮肤扁平苔癣中MMP-3、MMP-7、CD147表达的研究不多。本文检测扁平苔癣皮损组织中CD147、MMP-3、MMP-7的表达情况,探讨三者间关系及其临床意义。
1 资料与方法 1.1 研究对象2017年3月—2019年3月,选取我科收治、经组织病理检查确诊为皮肤扁平苔癣病人的组织标本40例,其中男20例,女20例; 年龄22~69岁,平均47.40岁; 病程1月~10年,平均13.9月; 14例取材于躯干,26例取材于四肢; 所有病人均排除其他系统性疾病,均未系统使用糖皮质激素治疗。同期选取我院美容外科手术切除的正常皮肤组织标本30例作为正常对照组,其中男12例,女18例; 年龄为17~70岁,平均32.20岁; 15例取材于躯干,15例取材于四肢; 均排除其他系统性疾病。两组年龄、性别及取材部位差异均无统计学意义。所取标本均经甲醛固定、石蜡包埋、切片。
1.2 主要试剂一抗:包括兔抗人MMP-3多克隆抗体、兔抗人MMP-7多克隆抗体、兔抗人CD147多克隆抗体(均购自北京博奥森生物技术有限公司); 通用型二抗PV-6001、二氨基联苯胺(DAB)试剂、免疫组化笔(北京中杉金桥公司)。
1.3 实验方法将标本切片置于64 ℃的烤片机上60 min后, 经脱蜡、抗原修复、体积分数0.03过氧化氢阻断内源性过氧化物酶、加一抗(CD147、MMP-3、MMP-7,滴度分别为1:300、1:150、1:150)、加二抗PV-6001、DAB显色、苏木精复染、脱水、中性树胶封片等步骤,光镜下观察染色情况。
1.4 结果判断CD147、MMP-3、MMP-7阳性细胞染色淡黄色至棕褐色。光镜下,每张切片随机选取5个视野,每个视野计数100个细胞。染色结果依据半定量法进行判断。染色强度评分:基本不着色0分,淡黄色为1分,棕褐色为2分; 阳性细胞百分比评分:< 5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。以细胞染色强度与阳性细胞百分比评分的乘积判定结果:0~1分为阴性,2~3分为阳性,4分及其以上为强阳性,分别用(-)、(+)、(╫)表示。
1.5 统计学处理采用SPSS 24.0软件进行统计学处理,计数资料组间比较均采用曼-惠特尼秩和检验,相关分析采用Spearman法。P < 0.05为差异有统计学意义。
2 结果扁平苔癣皮损组织中CD147阳性染色主要表现为表皮基底层、棘层、颗粒层细胞膜和细胞浆出现棕黄色颗粒,而正常对照组表皮基底层、棘层及颗粒层浅着色。扁平苔癣皮损组织中MMP-3阳性染色主要表现为表皮基底层细胞浆出现棕黄色颗粒,正常对照组表皮基底层细胞浆亦出现MMP-3阳性染色。扁平苔癣皮损组织MMP-7阳性染色表现为表皮基底层、棘层及颗粒层细胞浆和(或)细胞核均出现棕黄色颗粒,而正常对照组表皮基底层、棘层及颗粒层浅着色(图 1)。扁平苔癣组CD147、MMP-7表达高于正常对照组,差异具有显著意义(Z=-3.267、-2.331,P < 0.05);两组MMP-3表达差异无显著性(P>0.05)。见表 1。Spearman相关分析显示,扁平苔癣皮损组织中MMP-7与CD147表达呈正相关(r=0.587, P < 0.05)。
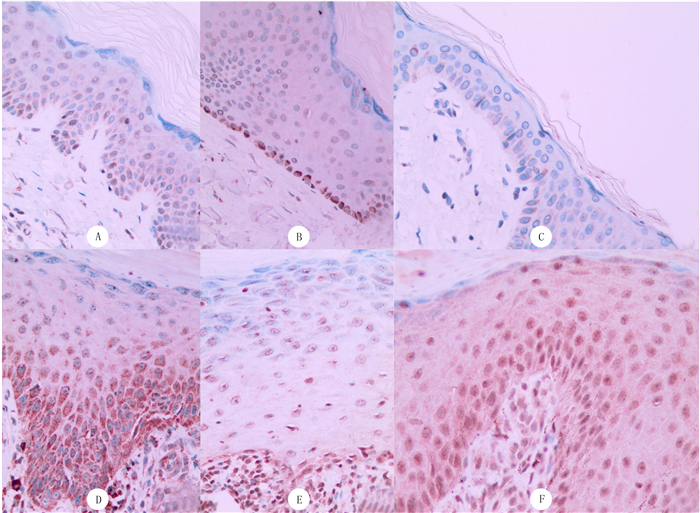 |
| A、B、C分别为正常皮肤组织CD147、MMP-3、MMP-7的表达(SP染色,400倍); D、E、F分别为扁平苔癣皮损组织CD147、MMP-3、MMP-7的表达(SP染色,400倍)。 图 1 正常皮肤与扁平苔藓皮损中CD147、MMP-3、MMP-7的表达 |
| 表 1 正常皮肤与扁平苔癣皮损组织中CD147、MMP-3、MMP-7表达比较(例) |
|
|
MMPs属于锌依赖性内肽酶家族,能够降解ECM的多种成分[8-10],正常表达水平的MMPs参与生长发育过程中ECM的重构以及细胞的增殖、迁移和黏附等,参与机体多种生理功能的调控; 而MMPs的异常表达往往与炎症、肿瘤以及心血管疾病有关[11-14]。既往研究显示,MMP-2、MMP-9与扁平苔癣的发病机制相关[15-18]。作为MMPs家族的重要成员,MMP-3、MMP-7是否参与了扁平苔癣发病尚不清楚。MMP-3能够降解Ⅲ、Ⅳ、Ⅴ型胶原及纤连蛋白、蛋白聚糖、层粘连蛋白、明胶等,不仅在破坏细胞间桥、导致细胞凋亡中发挥重要作用,还能激活前体MMP-1、前体MMP-9[19]。有研究结果显示,MMP-3表达上调与口腔扁平苔癣的发病机制相关[20-21]; 其表达水平与口腔扁平苔癣的严重程度有关[22],但其与皮肤扁平苔癣严重程度是否相关有待进一步研究。GUNDUZ等[1]研究显示,扁平苔癣皮损组织中MMP-2、MMP-3及纤连蛋白表达缺失,而正常皮肤组织上述因子尤其是MMP-3均有表达,主要表达在基底细胞层,认为上述因子表达缺失与扁平苔癣皮损组织炎症反应有关。本文研究结果显示,皮肤扁平苔癣中MMP-3表达虽有上调,但与对照组比较差异无统计学意义。分析其原因可能为:皮肤扁平苔癣与口腔扁平苔癣发病机制可能存在差异,或与研究样本量大小、染色方法及判断标准不同有关,其具体原因有待大样本研究进一步证实。
MMP-7也属于MMPs家族中重要的成员之一,是上皮特异性产物,有较强降解Ⅳ胶原的作用,并与上皮细胞凋亡相关。有研究表明,MMP-3与MMP-7在正常口腔黏膜、口腔扁平苔癣及口腔鳞癌中的表达逐渐增高,MMP-3、MMP-7在侵袭过程中表达上调,与侵袭性相关[23-25]。这或许为甄别口腔扁平苔癣的恶变提供了可能。还有研究显示,口腔扁平苔癣口腔黏膜上皮与结缔组织MMP-7的表达高于正常口腔黏膜[23],MMP-7与组织金属蛋白酶抑制剂(TIMPs)的比值高于对照组[24],认为MMP-7及MMP-7/TIMP的表达失调可能参与了口腔扁平苔癣的发病。本文研究显示,MMP-7在扁平苔癣皮损组织的基底层、棘层及颗粒层均有表达,并且MMP-7的表达明显高于正常对照组,表明MMP-7可能在扁平苔癣发病中发挥重要作用。
CD147又称细胞外基质金属蛋白酶诱导因子,是一种跨膜蛋白,属于免疫球蛋白家族,最初从恶性肿瘤细胞的质膜中分离得到[26],主要表达于肿瘤细胞、表皮细胞、免疫细胞、内皮细胞等[27],可诱导多种MMPs的活化,包括MMP-2、MMP-3、MMP-7及MMP-9等[5],在肿瘤进展中起重要作用[28-29]。有研究结果表明,CD147能刺激MMPs的分泌,但对TIMPs并不产生影响,导致MMPs与TIMPs的失衡,从而导致基底膜与肿瘤外基质的降解,引起肿瘤的侵犯与转移[30]。一项对于甲状腺滤泡癌(FTC)的研究显示,CD147、MMP-3、MMP-7、MMP-9在人FTC组织中表达上调,并且培养的PTC-131细胞中MMP-3、MMP-7、MMP-9的表达依赖于CD147的调节[5]。本文研究结果显示,与正常对照组比较,扁平苔癣皮损组织中MMP-3的表达差异无统计学意义,MMP-7、CD147表达上调,且MMP-7、CD147表达呈正相关,推测CD147可能通过诱导MMP-7的活化,促进其分泌而协同参与扁平苔癣的发病,其具体作用机制有待于进一步研究。
综上所述,扁平苔癣皮损组织中的CD147及MMP-7表达上调,且两者表达呈正相关,提示两者在扁平苔癣发病中可能发挥重要作用,至于两者是否直接导致扁平苔癣的发病需进一步研究证实。
| [1] |
GUNDUZ K, DEMIRELI P, INANIR I, et al. Expression of matrix metalloproteinases (MMP-2, MMP-3, and MMP-9) and fibronectin in lichen planus[J]. Journal of Cutaneous Pathology, 2006, 33(8): 545-550. DOI:10.1111/j.1600-0560.2006.00456.x |
| [2] |
PAULUSOVÁ V, LACO J, DRÍZHAL I, et al. Expression of matrix metalloproteinase 9 in patients with oral lichen planus[J]. Acta Medica (Hradec Kralove)/Universitas Carolina, Facultas Medica Hradec Kralove, 2012, 55(1): 23-26. |
| [3] |
SINGH P, GROVER J, BYATNAL A A, et al. Elucidating the role of Cyclooxygenase-2 in the pathogenesis of oral lichen planus-an immunohistochemical study with supportive histochemical analysis[J]. Journal of Oral Pathology & Medicine, 2017, 46(5): 381-386. |
| [4] |
WENG Yingzheng, CHEN Ting, REN Jianfei, et al. The association between extracellular matrix metalloproteinase inducer polymorphisms and coronary heart disease: a potential way to predict disease[J]. DNA and Cell Biology, 2020, 39(2): 244-254. DOI:10.1089/dna.2019.5015 |
| [5] |
YOKO O, SHIBATA N, OKAMOTO T, et al. The role of CD147 in the invasiveness of follicular thyroid carcinoma cells[J]. Thyroid, 2012, 22(4): 383-394. DOI:10.1089/thy.2010.0426 |
| [6] |
RODRIGUEZ C M, GILARDONI M B, REMEDI M M, et al. Tumor-stroma interaction increases CD147 expression in neoplastic B lymphocytes in chronic lymphocytic leukemia[J]. Blood Cells Molecules and Diseases, 2020, 82: 102405. DOI:10.1016/j.bcmd.2020.102405 |
| [7] |
LIAN Chengxiang, GUO Ye, ZHANG Jianglin, et al. Targeting CD147 is a novel strategy for antitumor therapy[J]. Current Pharmaceutical Design, 2017, 23(29): 4410-4421. |
| [8] |
GUO Lin, HAO Ruihu, TIAN Fengde, et al. Interferon regulatory factor 5 (IRF5) regulates the expression of matrix metalloproteinase-3 (MMP-3) in human chondrocytes[J]. International Immunopharmacology, 2018, 55: 231-236. DOI:10.1016/j.intimp.2017.11.035 |
| [9] |
浦光瑞, 张虹. 基质金属蛋白酶在口腔扁平苔癣、白斑及鳞癌中的研究进展[J]. 大连医科大学学报, 2013, 35(2): 193-196. |
| [10] |
杨雪娜, 熊咏民. 基质金属蛋白酶在骨关节疾病中的研究进展[J]. 国外医学(医学地理分册), 2019, 40(4): 470-474. DOI:10.3969/j.issn.1001-8883.2019.04.043 |
| [11] |
PAYERAS M R, CHERUBINI K, FIGUEIREDO M A, et al. Oral lichen planus: focus on etiopathogenesis[J]. Archives of Oral Biology, 2013, 58(9): 1057-1069. DOI:10.1016/j.archoralbio.2013.04.004 |
| [12] |
KUSUMAWADEE U, NATTISA N, BOON-EK Y, et al. Ethanolic extract of ocimum sanctum leaves reduced invasion and matrix metalloproteinase activity of head and neck cancer cell lines[J]. Asian Pacific Journal of Cancer Prevention, 2020, 21(2): 363-370. DOI:10.31557/APJCP.2020.21.2.363 |
| [13] |
LI Aoyu, YU Hua, LI Rongfeng, et al. Inhibitory effect of metalloproteinase inhibitors on skin cell inflammation induced by jellyfish nemopilema nomurai nematocyst venom[J]. Toxins, 2019, 11(3): 156. DOI:10.3390/toxins11030156 |
| [14] |
周雪. 基质金属蛋白酶在血管炎症中的作用[J]. 国际儿科学杂志, 2014, 41(3): 253-256. DOI:10.3760/cma.j.issn.1673-4408.2014.03.010 |
| [15] |
杜杰, 王君, 赵涵, 等. MMP-9, TIMP-1及ETS-1在扁平苔癣中的表达[J]. 中国皮肤性病学杂志, 2015, 29(6): 569-571. |
| [16] |
徐经琦, 王君, 史同新, 等. 扁平苔癣HIF-1α、GLUT-1及MMP-2表达及意义[J]. 青岛大学学报(医学版), 2019, 55(3): 350-353. |
| [17] |
CARNELIO S, AGARWAL N, RODRIGUES G. Immunohistochemical and clinical significance of matrix metalloproteinase-2 and its inhibitor in oral lichen planus[J]. Journal of Oral and Maxillofacial Pathology, 2019, 23(3): 476. |
| [18] |
万慧颖, 徐敏燕, 谢震, 等. 扁平苔癣皮损中基质金属蛋白酶-9、半胱氨酸蛋白酶-3的表达[J]. 四川医学, 2018, 39(8): 869-872. |
| [19] |
FARZIN M, MARDANI M, GHABANCHI J, et al. Serum level of matrix metalloproteinase-3 in patients with oral lichen planus[J]. Iranian Red Crescent Medical Journal, 2012, 14(1): 10-13. |
| [20] |
NOSRATZEHI T, ALIJANI E, MOODI M. Salivary MMP-1, MMP-2, MMP-3 and MMP-13 levels in patients with oral lichen planus and squamous cell carcinoma[J]. Asian Pacific Journal of Cancer Prevention, 2017, 18(7): 1947-1951. |
| [21] |
MIRZAII-DIZGAH I, AGHA-HOSSEINI F, MAHBOOBI N, et al. Serum and saliva MMP-3 in patients with OLP and oral SCC[J]. The Journal of Contemporary Dental Practice, 2015, 16(2): 107-111. DOI:10.5005/jp-journals-10024-1645 |
| [22] |
MAZZARELLA N, FEMIANO F, GOMBOS F, et al. Matrix metalloproteinase gene expression in oral lichen planus: erosive vs. reticular forms[J]. Journal of the European Academy of Dermatology and Venereology, 2006, 20(8): 953-957. |
| [23] |
LI Tiejun, JUN Cui. COX-2, MMP-7 expression in oral lichen planus and oral squamous cell carcinoma[J]. Asian Pacific Journal of Tropical Medicine, 2013, 6(8): 640-643. DOI:10.1016/S1995-7645(13)60110-8 |
| [24] |
RUBACI A H, HAKKI O K, OLGAC V, et al. The roles of matrix metalloproteinases-2, -7, -10 and tissue inhibitor of metalloproteinase-1 in the pathogenesis of oral lichen planus[J]. Journal of Oral Pathology & Medicine, 2012, 41(9): 689-696. |
| [25] |
MUNIZ J, BIBIANO B, BEGHINI M, et al. Galectin-9 as an important marker in the differential diagnosis between oral squamous cell carcinoma, oral leukoplakia and oral lichen planus[J]. Immunobiology, 2015, 220(8): 1006-1011. DOI:10.1016/j.imbio.2015.04.004 |
| [26] |
BISWAS C. Tumor cell stimulation of collagenase production by fibroblasts[J]. Biochemical and Biophysical Research Communications, 1982, 109(3): 1026-1034. DOI:10.1016/0006-291X(82)92042-3 |
| [27] |
王澄仪, 谢明, 焦婷. 细胞外基质金属蛋白酶诱导因子在炎症发生发展中的作用[J]. 口腔生物医学, 2018, 9(2): 95-101. |
| [28] |
LUCCHETTI D, COLELLA F, PERELLI L, et al. CD147 promotes cell small extracellular vesicles release during colon cancer stem cells differentiation and triggers cellular changes in recipient cells[J]. Cancers, 2020, 12(2): 260. DOI:10.3390/cancers12020260 |
| [29] |
GUO W T, ABUDUMIJITI H, XU L X, et al. CD147 promotes cervical cancer migration and invasion by up-regulating fatty acid synthase expression[J]. International Journal of Clinical and Experimental Pathology, 2019, 12(12): 4280-4288. |
| [30] |
陈加明, 仝林虎, 王梦霖. CD147与肿瘤关系的研究进展[J]. 世界最新医学信息文摘, 2017, 17(99): 90-93. |
 2020, Vol. 56
2020, Vol. 56

