原发性肝癌死亡率在消化系统恶性肿瘤中位居第3位,其病理类型中以肝细胞型多见。在我国慢性病毒性肝炎是肝细胞癌(HCC)的主要危险因素,HCC发生是一个多步骤的过程[1]。基因测序技术揭示了许多遗传变化,包括复发突变基因和信号通路失调[2],这些都与肝癌的发生和发展有关。但是肝癌仍然是一种致命的疾病,术后复发率高,关于其预测、诊断、治疗和预后监测仍有许多问题亟待解决[3]。亲环素家族(CYPs)在生物界广泛存在,其中亲环素A(CYPA)是发现最早、研究最深入的一个家族成员[4]。相关的研究结果已表明,CYPA在许多恶性肿瘤组织中高表达,并与肿瘤生长、转移和耐药等密切相关[5-6]。新环素J(CYPJ)为近期研究发现的新成员,又称PPIL3,包括PPIL3a和PPIL3b两条可变的剪切体[7]。CYPJ与CYPA序列相似度约为50%[8],参与免疫反应、细胞增殖和凋亡等过程[9-10]。然而,关于CYPJ在HCC的生物学功能尚不清楚。本实验研究CYPJ在HCC中表达情况及其与病人临床病理特征及预后的关系,并通过沉默CYPJ基因表达抑制SK-Hep1细胞生长,为评估病人预后和开发新的靶向药物提供依据。
1 材料和方法 1.1 数据来源和分析利用UALCAN(http://ualcan.path.uab.edu)在线网站,通过输入“PPIL3(CYPJ)”基因名称,分析TCGA数据库中HCC组织(371例)和癌旁正常组织(50例)中CYPJ mRNA表达情况,及其与临床病理分级的关系。利用cBioPortal(http://www.cbioprtal)在线网站,选择TCGA数据库中HCC,分析PPIL3表达情况与HCC病人预后的关系。
1.2 实验样本HCC癌组织和癌旁正常组织样本40对,均来自烟台毓璜顶医院肿瘤科2012年3月—2013年4月收治病人,入组前未接受放疗或化疗。其中37例HCC病人乙型肝炎表面抗原(HBsAg)阳性,31例HCC病人有肝硬化。40例病人中男35例,女5例;年龄40~71岁,平均(51.83±8.85)岁。电话随访,开始时间为病人确诊时间,结束时间为病人死亡或随访截止时间(2018年4月)。SK-Hep1细胞购自ATCC细胞库。本研究获得了病人或其家属的书面知情同意,并得到了我院伦理委员会的批准。
1.3 实验材料RPMI-1640培养基、胰蛋白酶、胎牛血清(美国Gibco公司产品);Trizol试剂、逆转录试剂盒(美国Invitrogen公司);MTT试剂盒(碧云天生物技术研究所)。
1.4 构建慢病毒介导的CYPJ基因沉默携带短发夹状干扰RNA(shRNA)的慢病毒载体由上海吉凯基因化学技术有限公司构建,其正向序列为:gCTGGAAGAGGAGGCAACAG;其反向序列为:CTGTTGCCTCCTCTTCCAGc;接头序列为:TTCAAGAGA。含有3′dUdU的小干扰RNA(siRNA)片段si-CYPJ(5′-CUGGAAGAGGAGGC- AACA-3′)和si-control(5′-TTCTCCGAACGTGTCACGT-3′)均由上海吉凯基因化学技术有限公司合成,并用Blast进行序列对比,检测结果显示构建的si-CYPJ序列与其他CYPS的mRNA没有显著的同源性,连接病毒载体进行下一步实验。
1.5 细胞培养与转染SK-Hep1细胞用25 cm×25 cm的培养瓶培养,置于37 ℃、含体积分数0.05 CO2的培养箱中,培养基为含体积分数0.01胎牛血清的RPMI-1640 5 mL。取对数生长期的SK-Hep1细胞,经消化、离心,以每孔2×105个细胞密度接种于6孔板中。随机分为实验组和对照组,待细胞生长至70%融合时按照慢病毒转染试剂盒说明书进行转染。实验组转入CYPJ表达干扰的慢病毒(CYPJ-RNAi-LV组),对照组转入空载慢病毒(NC-LV组)。转染完成后于培养箱中继续培养,为后续实验做准备。
1.6 实时荧光定量PCR(qPCR)检测组织和细胞中CYPJ mRNA表达水平取40对HCC癌组织和癌旁正常组织研磨,提取总RNA,逆转录为cDNA,加入引物进行qPCR。引物及其序列见表 1。PCR的最佳条件为:95 ℃预变性5 min,扩增40周期(95 ℃、50 s,63 ℃、1 min,72 ℃、30 s),以25 μL体积(内含SYBR Premix Ex 12.5 μL,TapⅡ1 μL,上下游引物各1 μL,模板DNA 2 μL,7.5 μL dH2O)进行PCR反应。实验重复3次,用2-△△Ct法计算HCC癌组织和癌旁正常组织中CYPJ mRNA相对表达量。细胞转染48 h后,收集CYPJ-RNAi-LV组和NC-LV组细胞,提取细胞总RNA,检测各组CYPJ mRNA表达水平,实验步骤同上。实验重复3次。
| 表 1 PCR引物及其序列 |
|
|
取对数生长期的SK-Hep1细胞接种于96孔板,分为CYPJ-RNAi-LV组和NC-LV组,每组设3个复孔。将病毒上清液分别加入到各组细胞中,感染复数(MOI)设置为0、0.2、2.0、20.0和200.0,孵育96 h后,各组细胞每孔加入MTT溶液20 μL(浓度为5 g/L),置于培养箱中培养4 h,然后每孔加入Formazan溶解液100 μL,混匀并使结晶溶解,在细胞培养箱内继续孵育4 h。用酶联免疫检测仪检测各孔570 nm波长处光密度(OD)值,绘制细胞生长曲线,以细胞增殖率(ODCYPJ-RNAi-LV组/ODNC-LV组×100%)表示细胞增殖情况。
1.8 统计学方法采用SPSS 22.0软件进行统计学分析,计数资料结果以x±s形式表示,组间比较采用t检验;采用Kaplan-Meier生存曲线进行生存分析。P < 0.05为差异有统计学意义。
2 结果 2.1 HCC癌组织和癌旁正常组织中CYPJ mRNA表达水平比较qPCR检测结果显示,40对HCC癌组织和癌旁正常组织中CYPJ mRNA的相对表达量分别为0.894±0.422、0.668±0.303,HCC癌组织中CYPJ mRNA表达高于癌旁正常组织,差异有统计学意义(t=2.759,P < 0.05)。该结果与TCGA数据库分析结果一致。见图 1。
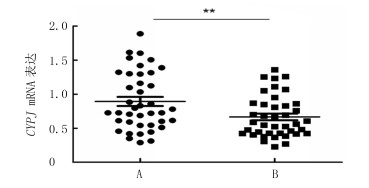 |
| A:癌组织;B:癌旁正常组织。注:**P < 0.05。 图 1 HCC癌组织和癌旁组织中CYPJ mRNA表达比较 |
HCC癌组织中CYPJ mRNA相对表达量与病人性别、年龄、甲胎蛋白(AFP)、肿瘤大小、HBsAg、有无肝硬化和有无癌栓等无相关性(P>0.05),而与临床病理分级有关(t=2.557,P < 0.05)。该结果与TCGA数据库分析结果一致。见表 2。
| 表 2 HCC癌组织CYPJ mRNA表达与临床病理特征相关性(x±s) |
|
|
以CYPJ mRNA表达水平中位数0.754为截点,将HCC病人分为低表达组和高表达组,采用Kaplan-Meier生存曲线分析显示,低表达组和高表达组生存时间分别为(53.8±10.1)、(36.1±14.2)个月;中位生存时间分别为55.3、28.9个月,5年生存率分别为55.0%、22.5%。Log-rank检验显示,低表达组病人的总生存时间(OS)较高表达组病人延长,两组比较差异有显著性(χ2=9.464,P < 0.01),与cBioPortal在线网站分析结果一致。见图 2。
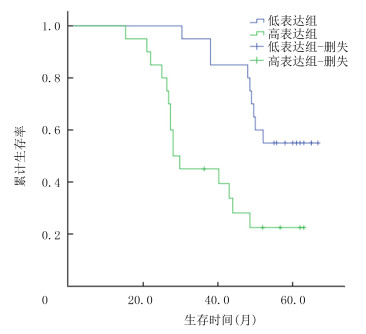 |
| 图 2 CYPJ mRNA表达水平对HCC病人总生存期的影响 |
CYPJ-RNAi-LV组和NC-LV组细胞的CYPJ mRNA相对表达量分别为0.414±0.047和0.846±0.542,两组相比较差异有显著意义(t=10.409,P < 0.01)。
2.5 沉默CYPJ基因表达对SK-Hep1细胞生长的影响MTT法检测结果显示,MOI为20.0、200.0时CYPJ-RNAi-LV组OD值明显低于NC-LV组,差异有统计学意义(t=3.231、8.976,P < 0.01)。沉默CYPJ基因表达可抑制SK-Hep1细胞增殖。见图 3。
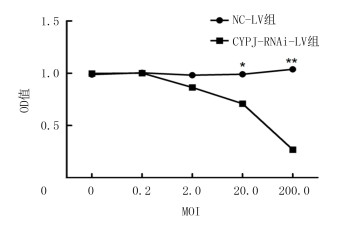 |
| 注:*P < 0.05,**P < 0.01。 图 3 沉默CYPJ基因表达对SK-Hep1细胞生长的影响 |
HCC多起病隐匿,多数病人就诊时已属中晚期,术后复发和肝内外转移是导致HCC预后不良的主要原因,因此需要早发现和早治疗以提高治疗效果[11]。导致HCC发生的危险因素有很多,包括肝炎病毒(HBV或HCV)感染、病毒性肝炎、乙醇性肝硬化以及非乙醇性脂肪性肝炎等[12]。据统计约有80%的HCC病人是HBV携带者,这表明HBV感染在肝癌的发生、发展中具有重要作用[13]。有研究结果显示,早期HCC病人通过有效的治疗5年生存率可显著提高[14]。常用的肿瘤标志物为AFP,但其灵敏度和特异度较低[15]。随着基因组学和蛋白质组学等技术的应用,有望获得特异性肝癌肿瘤标记物,为肝癌的早期发现提供依据[16]。
CYPs家族具有肽基脯氨酰基顺反式异构酶(PPlase)活性和分子伴侣功能,在多种疾病中发挥重要作用[17]。其中,CYPA参与病毒感染[18]、炎性疾病[19]和肿瘤形成[6]等病理过程。CYPA与环孢素A(Cs A)具有高度亲合力[17],二者在细胞内相互作用可以形成CYPA-Cs A复合物,该复合物可以阻断丝裂原激活蛋白激酶(MAPK)/p38信号通路的活化,从而抑制细胞的增殖[20]。另有研究发现,CYPA在非小细胞肺癌(NSCLC)中高表达,可以促进细胞增殖、侵袭和迁移,p38抑制剂SB 203580可以抑制细胞的迁移[21]。在治疗晚期NSCLC病人时发现,Cs A与吉非替尼组合比单独应用吉非替尼更有效[22]。ZHAO等[23]研究发现,含喹喔啉的ZX-J-19及其衍生物ZX-J-19j和ZX-J-19l可抑制PPIase活性,对肿瘤细胞生长有显著的抑制作用,且效果比Cs A好。还有研究发现,HCC病人CYPA高表达与耐药相关基因的表达及化疗耐药产生有关[24]。这些研究表明,CYPA在肿瘤发生、发展中具有重要作用,并与耐药产生有关,而亲环素抑制剂在治疗肿瘤方面具有重要的意义。由于CYPA和CYPJ序列相似度高,可能在某些功能上极为相似,CYPJ在肿瘤发生发展中的作用值得探讨。
在2005年,已有研究者通过基因芯片技术将CYPJ作为差异性基因,从脑胶质瘤组织中筛选出来[25]。另有研究通过对11项全基因组相关研究进行分析发现,CYPJ(2q33)可作为乳癌的风险基因,该研究结果有助于提高乳癌家族发病风险的预测[26]。PHILIPPE等[27]的研究结果显示,亲环素抑制剂(CRV431)可以抑制亲环素PPlase的活性,从而抑制小鼠肝脏内的HBV DNA水平。HBV感染是HCC最常见的危险因素,这一研究结果为HCC治疗带来了启示。GONG等[28]应用免疫组化实验对120例胃癌组织和癌旁组织研究发现,CYPJ在胃癌组织中高表达,且与肿瘤分化程度有关,在肿瘤生长过程中具有重要作用。本研究通过UALCAN在线网站分析显示CYPJ在HCC中高表达,与临床病理分级有关,并通过qPCR实验进一步验证了数据库分析的结果。有研究结果表明,在癌细胞中CYPJ与凋亡蛋白相互作用,影响其发挥作用,为研究凋亡蛋白在细胞中的定位机制提供了新的方向[29]。SELMANSBERGER等[30]在对核辐射后甲状腺癌研究时发现,CLIP2参与细胞凋亡、MAPK信号传导和遗传不稳定性等致癌过程,且影响CYPJ的表达水平。本文研究结果显示,通过沉默CYPJ基因的表达可以抑制SK-Hep1细胞的生长,证明了CYPJ可以促进癌细胞增殖,其具体作用机制有待下一步实验。本研究结果还显示,CYPJ基因高表达HCC病人预后差,结果与cBioPortal在线网站分析结果一致。其次,本文结果还显示,沉默CYPJ基因表达可抑制SK-Hep1细胞增殖,并选择高效率MOI为后续实验做准备;CYPJ在肿瘤生长过程中具有重要作用,并影响病人预后。目前关于CYPJ在肝癌中作用研究较少,值得进一步研究。
总之,CYPJ基因在HCC癌组织中表达升高,并影响病人预后。沉默CYPJ基因表达可以抑制细胞增殖,其作用机制可能与MAPK/p38信号通路有关,有待下一步研究证实。CYPJ可能成为评估病人预后、开发新型抗癌药物的潜在靶点。
| [1] |
ISLAMI F, CHEN W, YU X Q, et al. Cancer deaths and cases attributable to lifestyle factors and infections in China, 2013[J]. Annals of Oncology, 2017, 28(10): 2567-2574. DOI:10.1093/annonc/mdx342 |
| [2] |
NIU Zhaoshan, NIU Xiaojun, WANG Wenhong. Genetic alterations in hepatocellular carcinoma: an update[J]. World Journal of Gastroenterology, 2016, 22(41): 9069-9095. DOI:10.3748/wjg.v22.i41.9069 |
| [3] |
WEN T F, JIN C, FACCIORUSSO A, et al. Multidisciplinary management of recurrent and metastatic hepatocellular carcinoma after resection: an international expert consensus[J]. Hepatobiliary Surgery and Nutrition, 2018, 7(5): 353-371. DOI:10.21037/hbsn.2018.08.01 |
| [4] |
FENG Wenhua, XIN Yan, XIAO Yuping, et al. Cyclophilin a enhances cell proliferation and xenografted tumor growth of early gastric cancer[J]. Digestive Diseases and Sciences, 2015, 60(9): 2700-2711. DOI:10.1007/s10620-015-3694-9 |
| [5] |
QIAN Zhe, ZHAO Xiaoting, JIANG Mei, et al. Downregulation of cyclophilin A by siRNA diminishes non-small cell lung cancer cell growth and metastasis via the regulation of matrix metallopeptidase 9[J]. BMC Cancer, 2012, 12: 442. DOI:10.1186/1471-2407-12-442 |
| [6] |
NIGRO P, POMPILIO G, CAPOGROSSI M C. Cyclophilin A: a key player for human disease[J]. Cell Death & Disease, 2013, 4(10). |
| [7] |
ZHOU Z, YING K, DAI J, et al. Molecular cloning and cha-racterization of a novel peptidylprolyl isomerase (cyclophilin)-like gene (PPIL3) from human fetal brain[J]. Cytogenetics and Cell Genetics, 2001, 92(3/4): 231-236. |
| [8] |
HUANG Lili, ZHAO Xuemei, HUANG Chaoqun, et al. Structure of recombinant human cyclophilin J, a novel member of the cyclophilin family[J]. Acta Crystallographica Section D-Biological Crystallography, 2005, 61(Pt 3): 316-321. |
| [9] |
SHENG Chunjie, YAO Chen, WANG Ziyang, et al. Cyclophilin J limits inflammation through the blockage of ubiquitin chain sensing[J]. Nature Communications, 2018, 9(1): 4381. DOI:10.1038/s41467-018-06756-3 |
| [10] |
CHEN J, LIEFKE R, JIANG L X, et al. Biochemical features of recombinant human cyclophilin J[J]. Anticancer Research, 2016, 36(3): 1175-1180. |
| [11] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA-A Cancer Journal for Clinicians, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [12] |
HLADY R A, ROBERTSON K D. Genetic and epigenetic he-terogeneity in normal liver homeostasis and its implications for liver disease and hepatocellular cancer[J]. Seminars in Liver Disease, 2018, 38(1): 41-50. DOI:10.1055/s-0037-1621712 |
| [13] |
LI Zhiqin, WANG Hongyan, ZENG Qinglei, et al. p65/miR-23a/CCL22 axis regulated regulatory T cells recruitment in hepatitis B virus positive hepatocellular carcinoma[J]. Cancer Medicine, 2020, 9(2): 711-723. DOI:10.1002/cam4.2611 |
| [14] |
VILANA R, FORNER A, GARCÍA A, et al. Hepatocellular carcinoma: diagnosis, staging, and treatment strategy[J]. Radiologia, 2010, 52(5): 385-398. DOI:10.1016/j.rx.2010.05.003 |
| [15] |
WANG Ting, ZHANG Kunhe, HU Piaoping, et al. Combination of dual serum fluorescence, AFP and hepatic function tests is valuable to identify HCC in AFP-elevated liver diseases[J]. Oncotarget, 2017, 8(58): 97758-97768. DOI:10.18632/oncotarget.22050 |
| [16] |
LI Bo, LI Boan, GUO Tongsheng, et al. The clinical values of serum markers in the early prediction of hepatocellular carcinoma[J]. BioMed Research International, 2017, 2017: 5358615. |
| [17] |
DAVIS T L, WALKER J R, CAMPAGNA-SLATER V, et al. Structural and biochemical characterization of the human cyclophilin family of peptidyl-prolyl isomerases[J]. PLoS Bio-logy, 2010, 8(7): e1000439. DOI:10.1371/journal.pbio.1000439 |
| [18] |
KIM K, DAUPHIN A, KOMURLU S, et al. Cyclophilin a protects HIV-1 from restriction by human TRIM5α[J]. Nature Microbiology, 2019, 4(12): 2044-2051. DOI:10.1038/s41564-019-0592-5 |
| [19] |
GARIMELLA V, MCVOY J S, OH Unsong. The contribution of cyclophilin A to immune-mediated central nervous system inflammation[J]. Journal of Neuroimmunology, 2020, 339(339): 577118. |
| [20] |
BUKRINSKY M. Extracellular cyclophilins in health and di-sease[J]. Biochimica et Biophysica Acta, 2015, 1850(10): 2087-2095. DOI:10.1016/j.bbagen.2014.11.013 |
| [21] |
GUO Yinan, JIANG Mei, ZHAO Xiaoting, et al. Cyclophilin a promotes non-small cell lung cancer metastasis via p38 MAPK[J]. Thoracic Cancer, 2018, 9(1): 120-128. DOI:10.1111/1759-7714.12548 |
| [22] |
SHOU Jiawei, YOU Liangkun, YAO Junlin, et al. Cyclosporine a sensitizes human non-small cell lung cancer cells to gefitinib through inhibition of STAT3[J]. Cancer Letters, 2016, 379(1): 124-133. DOI:10.1016/j.canlet.2016.06.002 |
| [23] |
ZHAO Xuemei, XIA Chengcai, WANG Xiaodan, et al. Cyclophilin J PPIase inhibitors derived from 2, 3-Quinoxaline-6 amine exhibit antitumor activity[J]. Frontiers in Pharmacology, 2018, 9: 126. |
| [24] |
CHEN Shuai, ZHANG Mingjun, MA Honghui, et al. Oligo-microarray analysis reveals the role of cyclophilin A in drug resistance[J]. Cancer Chemotherapy and Pharmacology, 2008, 61(3): 459-469. DOI:10.1007/s00280-007-0491-y |
| [25] |
QI Zhenyu, HUI Guozhen, LI Yao, et al. cDNA microarray in isolation of novel differentially expressed genes related to human glioma and clone of a novel full-length gene[J]. Chinese Medical Journal, 2005, 118(10): 799-805. |
| [26] |
COUCH F J, KUCHENBAECKER K B, MICHAILIDOU K, et al. Identification of four novel susceptibility loci for oestrogen receptor negative breast cancer[J]. Nature Communications, 2016, 7: 11375. DOI:10.1038/ncomms11375 |
| [27] |
GALLAY P, URE D, BOBARDT M, et al. The cyclophilin inhibitor CRV431 inhibits liver HBV DNA and HBsAg in transgenic mice[J]. PLoS One, 2019, 14(6): e0217433. DOI:10.1371/journal.pone.0217433 |
| [28] |
GONG Zhaohua, MU Yuling, CHEN Jian, et al. Expression and significance of cyclophilin J in primary gastric adenocarcinoma[J]. Anticancer Research, 2017, 37(8): 4475-4481. |
| [29] |
HUO Dehua, YI Lina, YANG Jin′e. Interaction with Ppil3 leads to the cytoplasmic localization of apoptin in tumor cells[J]. Biochemical and Biophysical Research Communications, 2008, 372(1): 14-18. DOI:10.1016/j.bbrc.2008.04.178 |
| [30] |
SELMANSBERGER M, FEUCHTINGER A, ZURNADZHY L, et al. CLIP2 as radiation biomarker in papillary thyroid carcinoma[J]. Oncogene, 2015, 34(30): 3917-3925. DOI:10.1038/onc.2014.311 |
 2020, Vol. 56
2020, Vol. 56

