急性冠状动脉综合征(ACS)为一组发病率及死亡率均较高的临床综合征,其发病机制为冠状动脉内粥样硬化斑块的形成并继发斑块破裂或侵袭,造成血栓形成,从而引起相应冠状动脉管腔急剧减小或闭塞。已有研究表明,血小板和淋巴细胞的激活在ACS的发病过程中起到重要作用,前者主要是参与凝血酶的激活及血栓的形成,后者则通过释放多种炎性因子促进血管炎症反应、参与心肌再灌注损伤[1]。活化的血小板可以刺激内皮细胞和白细胞生成炎性物质,引起单核细胞黏附和迁移,进而促进动脉粥样硬化的发展[2-3]。相关研究显示,淋巴细胞是动脉粥样硬化过程中慢性炎症的重要组成部分,可以降低ACS发病期间缺血和再灌注心肌损伤的速率[4-5]。另一方面,血小板和淋巴细胞也可以通过直接结合或借助细胞因子相互作用,影响病变血管的进展[6]。血小板/淋巴细胞比值(PLR)为血小板和淋巴细胞计数的整合,被认为是ACS的一种潜在炎性标志物,近年来受到越来越多的关注。既往研究表明,PLR对于ACS病变的严重程度及预后有较强的预测作用[7-10]。然而,仍然存在多种因素影响着研究结果。本文应用Meta分析方法系统评价PLR与ACS的关系,为临床ACS疾病严重程度及预后的判断提供一定依据。
1 资料和方法 1.1 文献检索通过计算机检索PubMed、Cochrane Library、中国知网、中国生物医学文献数据库、维普数据库、万方数据库中公开发表的有关PLR与ACS及其各种亚型关系的中英文文献,检索时间自建库至2019年7月。英文数据库的检索关键词为“acute coronary syndrome”,“ST elevation myocardial infarction”,“non-ST elevated myocardial infarction”,“unstable angina”,“platelet-to-lymphocyte ratio”; 中文数据库检索词为“急性冠状动脉综合征”、“ST段抬高型心肌梗死”、“非ST段抬高型心肌梗死”、“不稳定性心绞痛”、“血小板/淋巴细胞比值”。同时,手工纳入入选文献的参考文献。
1.2 文献的纳入及排除标准纳入标准:①国内外研究的全文发表或学位论文数据库收录论文,语言限制为中文及英文; ②研究内容为PLR与ACS疾病严重程度或预后的关系; ③ACS预后情况应以死亡事件或主要不良心血管事件(MACE)的发生作为观察结局; ④PLR与ACS疾病严重程度关系的研究需以SYNTAX评分作为评价标准; ⑤PLR与ACS预后关系的研究需根据PLR值高低进行分组。排除标准:①综述、病例报告、个案或非临床研究; ②无法获得充分的原始数据或数据不完整; ③未给予研究对象明确的疾病诊断; ④未排除其他影响PLR结果的危险因素。
1.3 文献的筛选及资料提取由2名研究人员独立进行文献的检索及全文阅读,根据纳入及排除标准进行选择。将两者的结果进行交叉比对,若出现分歧,则由第3名研究人员共同讨论决定。根据Newcastle-Ottawa量表(NOS)对研究文献进行质量评估[11]。NOS的评价标准共包括3个部分,研究对象的选择、组间可比性、结局因素测量,分为8个条目共计9分,经评估后评分≥7分说明文献质量较好。提取的资料包括文章名称、第一作者、发表时间、研究类型、样本数大小、PLR数值资料、预后结果等。
1.4 统计学方法利用Rev Man 5.3版、Stata 14.0软件进行统计分析。采用I2检验确定研究间的异质性,若I2<50%,认为各项研究之间为同质,采用固定效应模型进行分析; 若I2≥50%,认为各项研究之间存在异质性,采用随机效应模型对纳入资料进行分析。在研究PLR与ACS病变严重程度的关系中,PLR为计量资料,采用加权均数差(MD)作为分析统计量。在研究PLR与ACS预后的关系时,不同PLR组的预后情况为计数资料,采用相对危险度(RR)作为分析效应量。Meta分析时以P<0.05为差异有统计学意义,发表偏倚分析及回归分析时以P<0.1为存在潜在发表偏倚或某因素可能为异质性来源。采用Egger检验、漏斗图法对纳入研究进行发表偏倚分析,采用逐一剔除纳入文献资料后再Meta分析的方法进行敏感性分析。
2 结果 2.1 纳入研究文献的基本情况按照检索策略及手工纳入文献参考文献的原则进行文献初步检索,共得到文献294篇,按纳入及排除标准进行文献的筛选,并通过NOS量表对文献进行质量评估,最终纳入文献16篇[10, 12-26],共包含15 016例ACS病人(图 1)。其中有3篇文献涉及PLR与ACS严重程度的关系,有15篇文献涉及PLR与ACS预后的关系。对纳入的文献进行质量评价,其中最高为9分,最低为7分,说明纳入分析的文献质量较高。纳入文献的基本信息及质量评分结果见表 1。
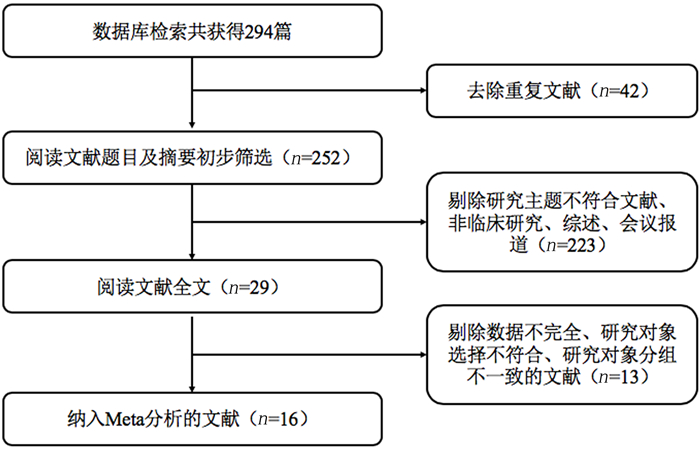 |
| 图 1 文献筛选流程图 |
| 表 1 纳入Meta分析文献的基本信息 |
|
|
提取纳入文献中关于PLR与ACS病变严重程度关系的文献研究结果,包括分组及其标准、病人例数、PLR值等资料,见表 2。提取纳入文献中关于PLR与ACS预后的研究结果,包括不同分组PLR值、住院期间及长期随访MACE发生率以及死亡事件发生率等资料,见表 3。在进行Meta分析时,将二等分、三等分或四等分的低、低中PLR组定义为低PLR组,其余组定义为高PLR组。
| 表 2 PLR与病变严重程度关系的文献情况 |
|
|
| 表 3 PLR与预后关系的文献情况 |
|
|
纳入文献中共有3项研究分析了PLR与ACS病变严重程度之间的关系。对纳入文献进行异质性检验,结果显示各项研究之间存在异质性(Chi2=24.45,df=2,P<0.01,I2=91%),故采用随机效应模型进行分析。Meta分析结果表明,病变严重组的PLR值明显高于病变非严重组,差异有统计学意义(MD=43.26,95%CI=14.62~71.90,P=0.003)。见图 2。
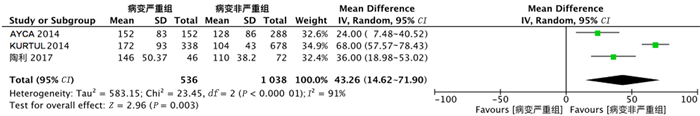 |
| 图 2 PLR与ACS病变严重程度关系的森林图 |
共有11项研究分析PLR与ACS病人住院期间发生死亡事件风险之间的关系。对纳入文献进行异质性检验,结果显示各项研究之间同质性较好(Chi2=15.22,df=10,P=0.12,I2=34%),故采用固定效应模型进行分析。Meta分析结果表明,与低PLR组相比,高PLR组病人住院期间发生死亡事件的风险较高(RR=2.26,95%CI=1.87~2.75,P<0.01)。见图 3。
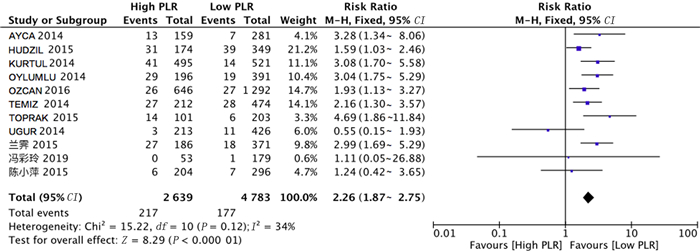 |
| 图 3 PLR与ACS住院期间死亡事件发生风险关系的森林图 |
共有8项研究分析PLR与ACS病人长期随访发生死亡事件风险之间的关系。对纳入文献进行异质性检验,结果显示各项研究之间存在异质性(Chi2=45.59,df=7,P<0.01,I2=85%),故采用随机效应模型进行分析。Meta分析结果表明,与低PLR组相比,高PLR组病人长期随访期间发生死亡事件风险较高(RR=2.14,95%CI=1.54~2.96,P<0.01)。见图 4。
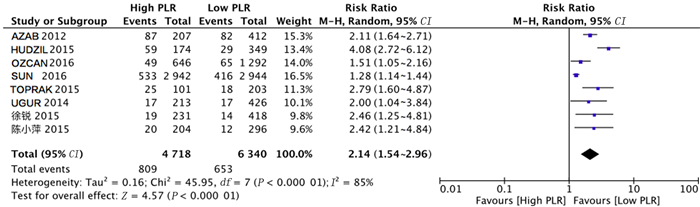 |
| 图 4 PLR与ACS长期随访死亡事件发生风险关系的森林图 |
共有8项研究分析PLR与ACS病人住院期间发生MACE事件风险之间的关系。对纳入文献进行异质性检验,结果显示各项研究之间存在异质性(Chi2=31.76,df=7,P<0.01,I2=78%),故采用随机效应模型进行分析。Meta分析表明,与低PLR组相比较,高PLR组病人住院期间发生MACE事件风险较高(RR=2.33,95%CI=1.73~3.14,P<0.01)。见图 5。
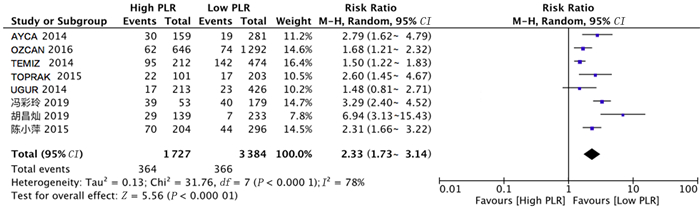 |
| 图 5 PLR与ACS住院期间MACE发生风险关系的森林图 |
共有5项研究分析PLR与ACS病人长期随访发生MACE事件风险之间的关系。对纳入文献进行异质性检验,结果显示各项研究之间存在异质性(Chi2=24.98,df=4,P<0.01,I2=84%),故采用随机效应模型进行分析。Meta分析结果表明,与低PLR组相比,高PLR组病人长期随访期间发生MACE事件的风险较高(RR=1.68,95%CI=1.29~2.19,P<0.01)。见图 6。
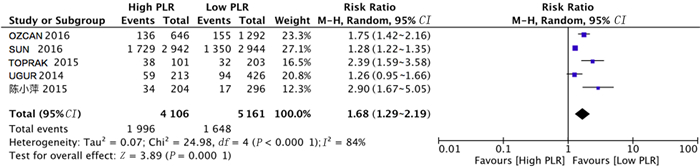 |
| 图 6 PLR与ACS长期随访MACE发生风险关系的森林图 |
PLR与ACS严重程度关系的研究由于纳入文献数量较少,可能存在潜在的发表偏倚。其余研究采用Egger检验、漏斗图法进行发表偏倚分析,结果表明PLR与ACS住院期间死亡事件(P=0.709)、MACE事件(P=0.112)发生风险关系的研究无发表偏倚,而PLR与ACS长期随访死亡事件(P=0.029)、MACE事件(P=0.07)发生风险关系的研究可能存在潜在的发表偏倚。其中PLR与ACS住院期间死亡事件发生风险关系在漏斗图中基本对称。见图 7。
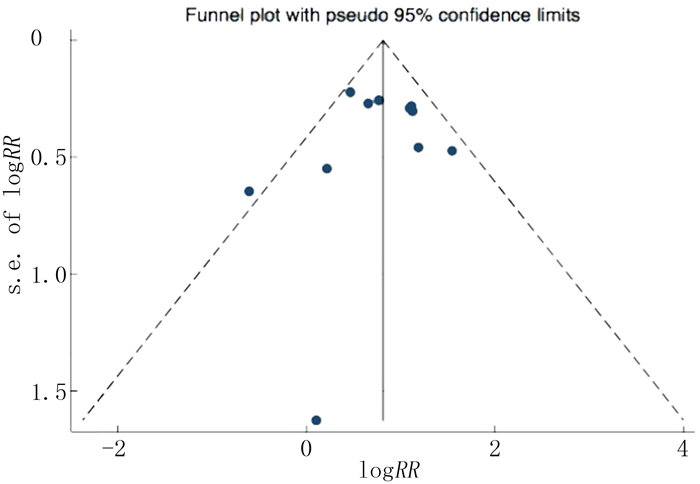 |
| 图 7 PLR与ACS住院期间发生死亡事件风险关系研究的漏斗图 |
根据疾病诊断亚型的不同将ACS分为单纯STEMI组和非单纯STEMI组进行PLR与预后关系的Meta分析,单纯STEMI组各结果分别为住院期间死亡事件(RR=1.89, 95%CI=1.29~2.77, P < 0.01)、长期随访期间死亡事件(RR=2.13, 95%CI=1.39~3.27, P < 0.01)、住院期间的MACE(RR=1.99, 95%CI=1.40~2.83, P<0.01)、长期随访期间MACE(RR=2.90, 95%CI=1.67~5.05, P < 0.01);非单纯STEMI组中各结果分别为住院期间死亡事件(RR=2.86, 95%CI=2.13~3.85, P<0.01)、长期随访期间死亡事件(RR=2.15, 95%CI=1.69~2.72, P<0.01)、住院期间的MACE(RR=3.22, 95%CI=1.86~5.57, P<0.01)、长期随访期间的MACE(RR=1.55, 95%CI=1.21~1.97, P<0.01)。此结果表明,不同诊断亚型病人PLR较高者发生死亡及MACE事件风险均较高。其中PLR与长期随访死亡事件发生风险关系的研究经分组后I2值有所下降,提示疾病诊断分型可能为异质性的一种潜在来源。为寻找PLR与ACS预后关系的各项研究其他异质性来源,根据文献发表国家(亚洲与非亚洲)、病人年龄(≤60岁与>60岁)、随访时间(≤1年与>1年)、样本数量(≤500例与>500例)等的不同进行Meta回归分析。结果表明,样本纳入数量(Coef=-0.637,P=0.005)与发表国家(Coef=-0.556,P=0.076)可能是住院期间MACE事件发生风险纳入研究的潜在异质性来源,但并不是其他研究的异质性来源。另外,病人年龄与随访时间不是研究间异质性的来源。
2.7 敏感性分析敏感性分析采用逐一剔除纳入文献后再进行Meta分析的方法,结果表明纳入的各项研究对结果无明显影响,其中PLR与ACS住院期间发生死亡事件风险关系的敏感性见图 8。
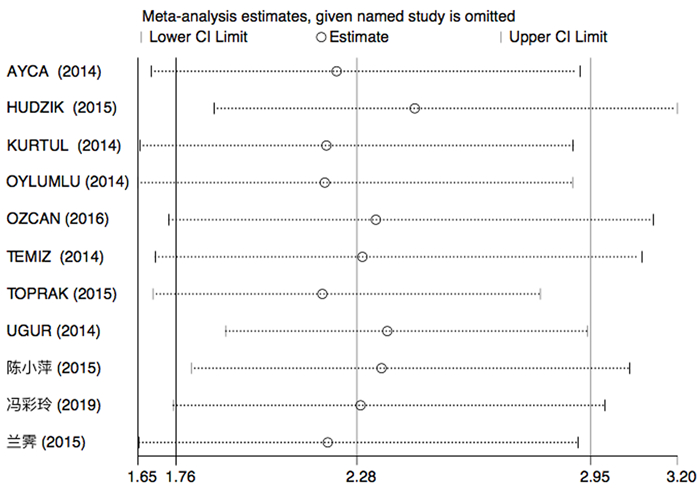 |
| 图 8 PLR与ACS住院期间发生死亡事件风险关系研究的敏感性分析图 |
近年来,ACS的发病率逐渐增高,并严重危及病人的生命。由血小板计数及淋巴细胞计数衍生的PLR是一种新型反映机体内炎症及血栓状态的指标。血小板的活化(包括其黏附和聚集的过程)在ACS的病理生理过程中起着重要的作用。血小板通过分泌促炎性因子和细胞因子参与血管炎症的过程,并可被血管壁细胞所释放的物质进一步激活,这种相互作用的反馈回路调节失衡则会导致疾病进展[27]。研究表明,血小板计数的增加预示着发生急性心肌梗死风险的增加,ACS病人血小板计数的增加预示着短期或长期死亡风险的增加[28-29]。ACS的发病过程中除了血小板的活性增加外,炎症反应也同样参与其中,包括动脉粥样斑块的形成、失稳及破裂等[30]。白细胞计数是炎症诊治及检测的重要指标,其各种亚型参与了ACS发生的过程,在临床心血管病的诊疗中已有广泛的应用。有研究发现,ACS病人发病过程处于应激状态,可刺激机体下丘脑功能亢进,进一步刺激靶腺器官分泌类固醇激素增加,使得淋巴细胞计数进一步减少[31]。PLR值同时包含了血小板计数及淋巴细胞计数的信息,其变化可以反映体内血小板与淋巴细胞水平的平衡状态以及全身炎症情况,较单一的指标更能反映ACS的疾病情况。此外,由于PLR是两种常规细胞计数的比值,能有效减少系统误差和偶然极端值的出现,使其具有更好的统计学效力,稳定性优于单一指标。因此,PLR在ACS中的应用备受关注,其数值高低与ACS中SYNTAX评分、Gensini评分、Grace评分及无复流现象的出现等呈正相关[32-35]。邵学明等[36]研究显示,ACS病人PLR与Gensini评分呈显著正相关。ACET等[32]的研究则分析了ACS病人PLR值与Grace评分之间的相关性,结果表明两者呈显著正相关性。YILDIZ等[34]研究显示,PLR为PCI术后STEMI病人无复流现象的独立预测因子,其灵敏度和特异度分别为75%和71%。以上研究结果均表明PLR在判断ACS疾病严重程度中具有临床应用价值,为PLR临床应用提供了依据。
本文Meta分析通过对国内外相关研究进行筛选及综合评定,共纳入16项研究,包括10篇英文文献和6篇中文文献。本文结果表明,ACS病变严重组的PLR值高于病变非严重组,差异有统计学意义; 较高PLR值的病人在住院期间发生死亡事件以及MACE事件的风险较低PLR病人分别高出2.26和2.33倍; 另外,较高PLR值病人在长期随访过程中发生死亡事件及MACE事件的风险较低PLR病人分别高出2.14和1.68倍。发表偏倚分析结果表明,PLR与ACS长期随访死亡事件、MACE事件发生风险关系的研究可能存在潜在的发表偏倚,主要原因是由于本Meta分析针对的是观察性研究,所收集的资料为已发表的文献,其中多为阳性结果,对灰色文献的收集相对较少,因此可能会漏掉阴性结果的研究。其次,本研究纳入文献限制语言为中文与英文,因此可能会导致因其他语言的缺失所引起的发表偏倚。敏感性分析结果表明,纳入的研究中无明显影响结果的研究,说明本文Meta分析的结果较为稳定可靠。根据亚组分析和Meta回归分析的结果对研究间异质性的来源进行探讨,首先是样本的异质性,包括不同地域人群血液学状态存在差异、纳入研究样本数量的差异、各项研究中纳入人群疾病亚型未能完全统一等方面; 其次各项研究之间可能存在其他未知的混杂因素影响异质性,如病人是否接受过治疗干预,但由于资料不完全等原因,无法发现所有的异质性来源。
本研究的优势在于同时纳入国内外关于PLR与ACS严重程度和预后关系的相关研究,并对其进行Meta分析,扩大了国内人群样本,增加了结果准确性。本文Meta分析结果表明,PLR值高的病人疾病程度相对严重,且预后较差。本研究仍存在一定局限性。①由于纳入研究的文献数量不足,未能将ACS的3种不同疾病亚型分别进行Meta分析,使得研究间异质性较大。②在数据处理方面,由于高低PLR的分组临界值不同,可能会增加错误分类风险。且由于无法获得各项研究的原始数据,从而未能得到预测ACS病人发生不良预后的PLR具体范围值。③纳入研究中评价病变严重程度采用的是SYNTAX评分,关于PLR与Grace评分、Gensini评分之间的关系未得到充分的研究,故PLR与疾病的严重程度关系仍需进一步探讨。
综上所述,PLR可一定程度上预测ACS病人的病变严重程度及预后,在ACS发生发展过程中监测PLR值的变化具有重要的意义,可为临床诊断及治疗提供参考。
| [1] |
BUDZIANOWSKI J, PIESZKO K, BURCHARDT P, et al. The role of hematological indices in patients with acute coronary syndrome[J]. Disease Markers, 2017, 2017: 3041565. |
| [2] |
PANT S, DESHMUKH A, GURUMURTHY G S, et al. Inflammation and atherosclerosis-revisited[J]. Journal of Cardiovascular Pharmacology and Therapeutics, 2014, 19(2): 170-178. |
| [3] |
NORDING H M, SEIZER P, LANGER H F. Platelets in inflammation and atherogenesis[J]. Frontiers in Immunology, 2015(6): 98. |
| [4] |
SLAVKA G, PERKMANN T, HASLACHER H A, et al. Mean platelet volume may represent a predictive parameter for overall vascular mortality and ischemic heart disease[J]. Arteriosclerosis Thrombosis and Vascular Biology, 2011, 31(5): 1215-1218. DOI:10.1161/ATVBAHA.110.221788 |
| [5] |
BIAN Chang, WU Yihua, SHI Yu, et al. Predictive value of the relative lymphocyte count in coronary heart disease[J]. Heart and Vessels, 2010, 25(6): 469-473. DOI:10.1007/s00380-010-0010-7 |
| [6] |
彭松. 血小板-淋巴细胞相互作用与动脉粥样硬化[J]. 中国动脉硬化杂志, 2014, 22(8): 853-858. |
| [7] |
ANWAR I W, WIJAYA I P, SUKRISMAN L, et al. Diagnostic accuracy of platelet/lymphocyte ratio for screening complex coronary lesion in different age group of patients with acute coronary syndrome[J]. Acta Medica Indonesiana, 2018, 50(3): 185-192. |
| [8] |
ZHOU Dong, FAN Yan, WAN Zhaofei, et al. Platelet-to-Lymphocyte ratio improves the predictive power of GRACE risk score for long-term cardiovascular events in patients with acute coronary syndrome[J]. Cardiology, 2016, 134(1): 39-46. |
| [9] |
BEKLER A, GAZI E, YILMAZ M, et al. Could elevated platelet-lymphocyte ratio predict left ventricular systolic dysfunction in patients with non-ST elevated acute coronary syndrome[J]. ? The Anatolian Journal of Cardiology, 2015, 15(5): 385-390. DOI:10.5152/akd.2014.5434 |
| [10] |
KURTUL A, MURAT S N, YARLIOGLUES M A, et al. Association of Platelet-to-Lymphocyte ratio with severity and complexity of coronary artery disease in patients with acute coronary syndromes[J]. American Journal of Cardiology, 2014, 114(7): 972-978. DOI:10.1016/j.amjcard.2014.07.005 |
| [11] |
STANG A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. European Journal of Epidemiology, 2010, 25(9): 603-605. DOI:10.1007/s10654-010-9491-z |
| [12] |
AYCA B, AKIN F, CELIK O, et al. Platelet to lymphocyte ratio as a prognostic marker in primary percutaneous coronary intervention[J]. Platelets, 2015, 26(7): 638-644. DOI:10.3109/09537104.2014.968117 |
| [13] |
AZAB B, SHAH N, AKERMAN M, et al. Value of platelet/lymphocyte ratio as a predictor of all-cause mortality after non-ST-elevation myocardial infarction[J]. Journal of Thrombosis and Thrombolysis, 2012, 34(3): 326-334. DOI:10.1007/s11239-012-0718-6 |
| [14] |
HUDZIK B, SZKODZINSKI J, GOROL J A, et al. Platelet-to-lymphocyte ratio is a marker of poor prognosis in patients with diabetes mellitus and ST-elevation myocardial infarction[J]. Biomarkers in Medicine, 2015, 9(3): 199-207. |
| [15] |
OYLUMLU M, YILDIZ A, OYLUMLU M, et al. Platelet to lymphocyte ratio is a predictor of in-hospital mortality patients with acute coronary syndrome[J]. European Heart Journal, 2014, 35(1): 648. |
| [16] |
OZCAN CETIN E H, CETIN M S, ARAS D, et al. Platelet to lymphocyte ratio as a prognostic marker of in-hospital and long-term major adverse cardiovascular events in ST-segment elevation myocardial infarction[J]. Angiology, 2016, 67(4): 336-345. DOI:10.1177/0003319715591751 |
| [17] |
SUN Xipeng, LI Jing, ZHU Weiwei, et al. Impact of platelet-to-lymphocyte ratio on clinical outcomes in patients with ST-segment elevation myocardial infarction[J]. Angiology, 2017, 68(4): 346-353. DOI:10.1177/0003319716657258 |
| [18] |
TEMIZ A, GAZI E, GUNGOR O, et al. Platelet/lymphocyte ratio and risk of in-hospital mortality in patients with ST-elevated myocardial infarction[J]. Medical Science Monitor, 2014, 20: 660-665. DOI:10.12659/MSM.890152 |
| [19] |
TOPRAK C, TABAKCI M M, SIMSEK Z, et al. Platelet/lymphocyte ratio was associated with impaired myocardial perfusion and both in-hospital and long-term adverse outcome in patients with ST-segment elevation acute myocardial infarction undergoing primary coronary intervention[J]. Advances in Interventional Cardiology, 2015, 11(4): 288-297. |
| [20] |
UGUR M, GUL M, BOZBAY M, et al. The relationship between platelet to lymphocyte ratio and the clinical outcomes in ST elevation myocardial infarction underwent primary coronary intervention[J]. Blood Coagulation & Fibrinolysis, 2014, 25(8): 806-811. |
| [21] |
陈小萍, 陈泗林. 血小板和淋巴细胞比率对急性冠状动脉综合征患者住院和长期病死率的预测[J]. 岭南心血管病杂志, 2015, 21(3): 290-294. DOI:10.3969/j.issn.1007-9688.2015.03.005 |
| [22] |
冯彩玲, 李利军. 血小板/淋巴细胞比值对ST段抬高型心肌梗死的预测价值[J]. 检验医学与临床, 2019, 16(5): 677-681. DOI:10.3969/j.issn.1672-9455.2019.05.029 |
| [23] |
胡昌灿, 于海初, 孙桂霞, 等. PLR和NLR对非ST段抬高型急性冠状动脉综合征院内不良事件的预测[J]. 青岛大学学报(医学版), 2019, 55(4): 485-491. |
| [24] |
兰霁, 陶贵周, 刘洪光. 血小板淋巴细胞比率对急性冠脉综合征患者住院病死率的危险性分析[J]. 医学与哲学, 2015, 36(8): 22-25. |
| [25] |
陶利, 吴继雄. 血小板-淋巴细胞计数比值与急性冠脉综合征冠脉病变严重程度的相关性研究[J]. 安徽医药, 2017, 21(7): 1215-1219. DOI:10.3969/j.issn.1009-6469.2017.07.012 |
| [26] |
徐锐, 赖红梅, 杨毅宁, 等. ST段抬高型心肌梗死患者血小板计数/淋巴细胞比值与冠状动脉病变程度及短期预后的相关性[J]. 中国循环杂志, 2015, 30(3): 230-234. DOI:10.3969/j.issn.1000-3614.2015.03.008 |
| [27] |
LANGER H, GAWAZ M. Platelet-vessel wall interactions in atherosclerotic disease[J]. Thrombosis and Haemostasis, 2008, 99(3): 480-486. |
| [28] |
KLOVAITE J, BENN M, YAZDANYAR S, et al. High platelet volume and increased risk of myocardial infarction: 39 531 participants from the general population[J]. Journal of Thrombosis and Haemostasis: JTH, 2011, 9(1): 49-56. |
| [29] |
KILICLI-CAMUR N, DEMIRTUNC R, KONURALP C, et al. Could mean platelet volume be a predictive marker for acute myocardial infarction[J]. ? Medical Science Monitor, 2005, 11(8): CR387-CR392. |
| [30] |
HANSSON G K. Inflammation, atherosclerosis, and coronary artery disease[J]. New England Journal of Medicine, 2005, 352(16): 1685-1695. DOI:10.1056/NEJMra043430 |
| [31] |
EKELOF S, JENSEN S E, ROSENBERG J, et al. Reduced oxidative stress in STEMI patients treated by primary percutaneous coronary intervention and with antioxidant therapy: a systematic review[J]. Cardiovascular Drugs and Therapy, 2014, 28(2): 173-181. |
| [32] |
ACET H, ERTAS F, AKIL M A, et al. Relationship between hematologic indices and global registry of acute coronary events risk score in patients with ST-segment elevation myocardial infarction[J]. Clinical and Applied Thrombosis-Hemostasis, 2016, 22(1): 60-68. |
| [33] |
KURTUL A, YARLIOGLUES M, MURAT S N, et al. Usefulness of the platelet-to-lymphocyte ratio in predicting angiographic reflow after primary percutaneous coronary intervention in patients with acute ST-segment elevation myocardial infarction[J]. American Journal of Cardiology, 2014, 114(3): 342-347. |
| [34] |
YILDIZ A, YUKSEL M, OYLUMLU M, et al. The utility of the platelet-lymphocyte ratio for predicting no reflow in patients with ST-segment elevation myocardial infarction[J]. Clinical and Applied Thrombosis-Hemostasis, 2015, 21(3): 223-228. |
| [35] |
CELIK T, BALTA S, OZTURK C, et al. Predictors of No-reflow phenomenon in young patients with acute ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. Angiology, 2016, 67(7): 683-689. DOI:10.1177/0003319715605977 |
| [36] |
邵明学, 吴向起, 李小波, 等. 血小板/淋巴细胞比值评估急性冠脉综合征冠脉病变严重程度的临床价值[J]. 现代生物医学进展, 2017, 17(31): 6057-6060. |
 2020, Vol. 56
2020, Vol. 56

